改性活性炭吸附二氯乙烷性能
2013-06-04李立清石瑞顾庆伟梁鑫姚小龙马卫武
李立清,石瑞,顾庆伟,梁鑫,姚小龙,马卫武
(中南大学 能源科学与工程学院,湖南 长沙,410083)
活性炭(activated carbon, AC)是一种具有丰富孔隙结构和巨大比表面积的优质吸附材料,在有机气体的处理领域中得到广泛应用[1-3]。活性炭的物理、化学性质主要依赖于它的孔结构和表面官能团。许多学者就活性炭的物化性质对其吸附性能的影响进行了研究,Chiang等[4]研究了活性炭孔结构对有机气体的吸附影响,发现活性炭吸附性能与孔的大小、形状及孔径分布有关;Chuang等[5]通过强酸和强碱对净化活性炭进行改性,改变了活性炭表面的含氧官能团性质,提高了其对挥发性有机化合物的选择吸附;Lillo-Rodenas等[6]在研究活性炭表面含氧官能团对苯和甲苯的吸附行为影响时,发现活性炭表面存在含氧官能团会在一定程度上抑制其对苯和甲苯的吸附。许多研究表明[7-8]:活性炭经过化学改性和高温改性后形成的官能团有很大差异。但是,很少学者对比研究酸改性和热改性对吸附挥发性有机气体的影响。本文作者选用商业活性炭,采用不同酸及不同温度对活性炭进行改性,借助Boehm滴定、傅式转换红外光谱(FTIR)和比表面积分析仪等方法对改性活性炭的物化性质进行分析。以二氯乙烷为吸附质进行吸附实验,从微观角度探讨有机气体吸附与改性活性炭表面官能团、多孔隙结构相互作用的机制。
1 材料与方法
1.1 活性炭改性
酸改性:采用硝酸(HNO3,65%),盐酸(HCl,37%),硫酸(H2SO4,98%)处理活性炭。称取50 g预处理(煮沸,水洗,烘干)的活性炭,分别放在200 mL,浓度为1 mol/L的不同酸中,在323 K下加热12 h,经过去离子水洗涤和干燥,得到改性样品,依次记为N-AC,Cl-AC和S-AC。
热改性:称取10 g经预处理(煮沸,水洗,烘干)的活性炭,在高纯度氮气气氛下,置于管式炉的石英管中加热30 min。改性温度为600,700和800 ℃。所得改性样品依次记为600-AC,700-AC和800-AC。
1.2 活性炭性能表征
1.2.1 表面基团测试
依据Boehm滴定和傅式转换红外光谱(FTIR)测试进行表面官能团表征。Boehm滴定确定表面含氧官能团数量,红外光谱分析仪(Nicolet380,光谱4 000~ 500 cm-1)确定表面的特定官能团结构。
1.2.2 孔结构测试
活性炭样品的比表面积和孔隙分布由气体吸附法测定,采用比表面积及孔隙分析仪(BECKMAN COULTER,SA3100)测试,样品比表面积由标准BET方法计算得到;微孔容和外表面积由BJH法获得;孔径分布用 HK方程和密度函数理论(DFT-Density Functional Theory)正则化方法计算。
1.3 吸附实验
实验以二氯乙烷为吸附质,吸附温度283 K,二氯乙烷进气质量浓度分别为2.79,4.51,10.32,15.17,51.92和103.51 g/m3,进行吸附实验。实验装置如图1所示。抽取的室内空气经过装有硅胶的干燥器(2个干燥器交替使用)干燥水分后,一部分直接进入混合器;另一部分穿过微型喷淋器(用一个微型泵循环将有机气体发生器里的二氯乙烷溶剂泵入恒温控制的喷淋器)。调节混合器前的2个气阀,使两股气流在混合器中的混合浓度达到一定值,用真空泵将该混合气送入恒温水箱(DC1015,上海天平仪器公司)中以维持恒定的二氯乙烷进气温度,待二氯乙烷浓度稳定于某一值30 min后再进行吸附实验。当二氯乙烷排气浓度与进气浓度相同时,并维持30 min以上时,认为吸附已达到平衡。称取活性炭的质量。进气和排气中二氯乙烷浓度采用气相色谱仪测定(P-6890,山东鲁南瑞虹化工仪器公司)。
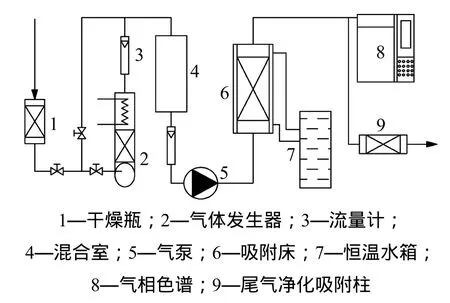
图1 实验装置Fig. 1 Experimental device
2 结果与讨论
2.1 改性对表面基团的影响
2.1.1 Boehm滴定结果对比
Boehm滴定结果见表1。酸改性样品的酸性基团量比未改性活性炭(AC-1)明显提高,而碱性基团明显减少;热改性样品中的酸性基团比AC-1明显减小,而碱性基团明显增加。
酸改性官能团数量由大到小依次为N-AC,S-AC,Cl-AC。这表明,随着酸试剂氧化性增强,酸性基团数量增多。但Cl-AC表面酸性官能团数量没有显著提高,表明盐酸改性使活性炭表面官能团的含量有轻微增大。这与Chen等[9]发现相似,用37%盐酸处理过的活性炭总酸度容量比用蒸馏水洗涤的活性炭的总酸度容量轻微增大。
热改性活性炭样品碱性官能团数量由大到小为800-AC,600- AC,700-AC,表明随着加热温度的增高,碱性官能团数量增加,酸性官能团变化不大。加热温度在600 ℃时,活性炭表面逐渐形成碱性官能团;在温度达到700~800 ℃时,活性炭表面的酸性官能团开始逐渐分解,大量的碱性官能团形成。
7种活性炭样中N-AC的羧基数量最大,是AC-1羧基数量的8倍;800-AC的羧基数量最少。这表明改性酸试剂氧化能力增强会使活性炭羧基数量增多;改性温度提高到800 ℃附近,活性炭羧基大部分已被分解。据文献[10]可知:在低氧化程度下,酚羟基更容易广泛存在。Cl-AC的酚羟基摩尔分数最大,为50.7%。另外,600-AC,700-AC和800-AC的酚羟基摩尔分数均比Cl-AC的小,这是由于在加热过程中,酸性基团逐渐分解,尽管在氮气环境中,但是酚羟基的质量摩尔浓度没有增多,反而逐渐减小。
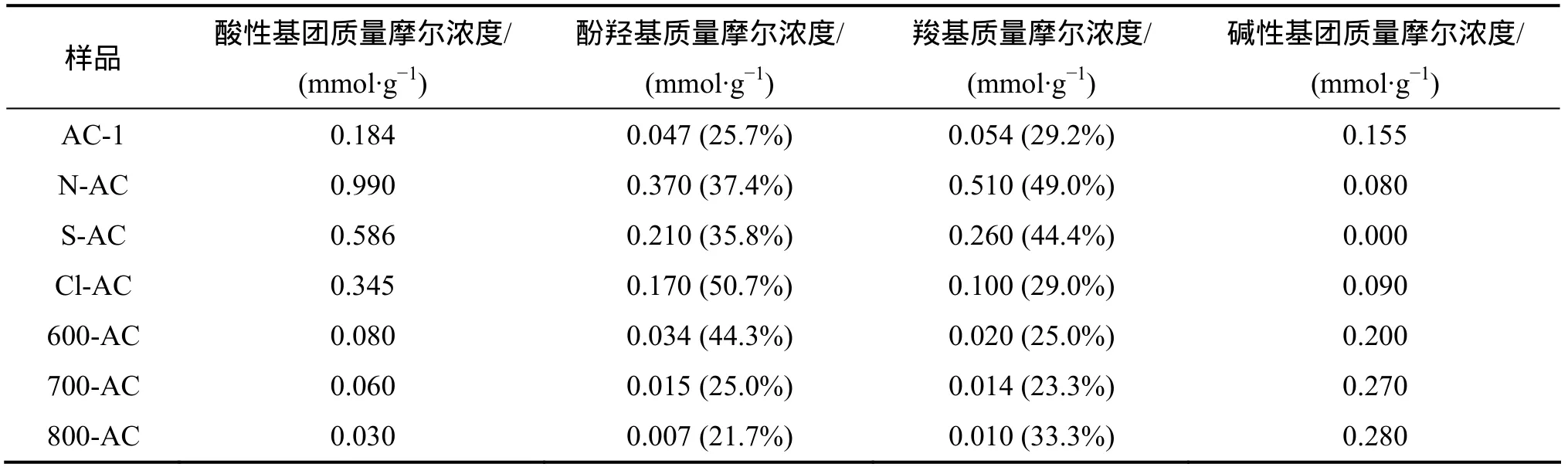
表1 活性炭样品表面基团质量摩尔浓度Table 1 Quantity of activated carbon surface groups
2.1.2 傅式红外光谱(FTIR)测试结果对比
7种活性炭FTIR测试结果如图2所示。 由图2可知:活性炭样品的红外光谱图均出现吸收波峰。在3 200~3 600 cm-1范围内的波峰,显示出O—H键的存在,O—H键可能来源于羟基[11]。在1 500~1 600 cm-1范围内的波峰,显示出羧酸基团的存在[12]。峰值在1 000~1 200 cm-1范围内时,显示出不同官能团中的单键氧原子,这些单键氧原子可能来源于酚羟基或内酯基。
N-AC样品的红外光谱上存在波峰为1 380~1 400 cm-1范围内的峰值。表明硝酸对活性炭改性给活性炭表面引进大量羧基结构[11-13]和硝基官能团[14]。
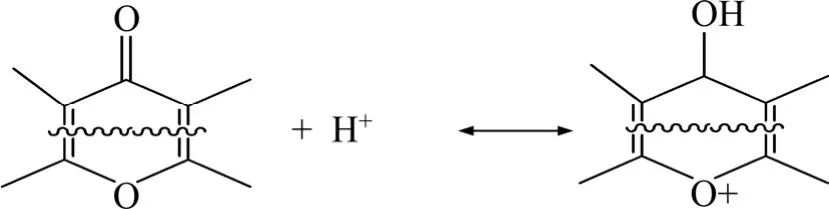
Cl-AC样品的表面官能团中,含有单键氧的官能团都相对提高,如酚羟基,内酯。出现这种情况的原因可能是发生了如下反应[15]:
S-AC样品在1 142 cm-1(SO2)和1 116 cm-1(C=S)出现显著波峰,由于硫酸改性活性炭引入磺酰基[16]。
600-AC,700-AC和800-AC的红外光谱中,吸收峰出现的位置相近,这表明,随着温度变化,活性炭表面没有引进不同结构的官能团。热改性图谱没有酸改性图谱的波峰位置显著,这充分说明酸改性可以给活性炭表面引入大量含氧官能团,而高温加热到700~800 ℃含氧官能团逐渐分解[17]。
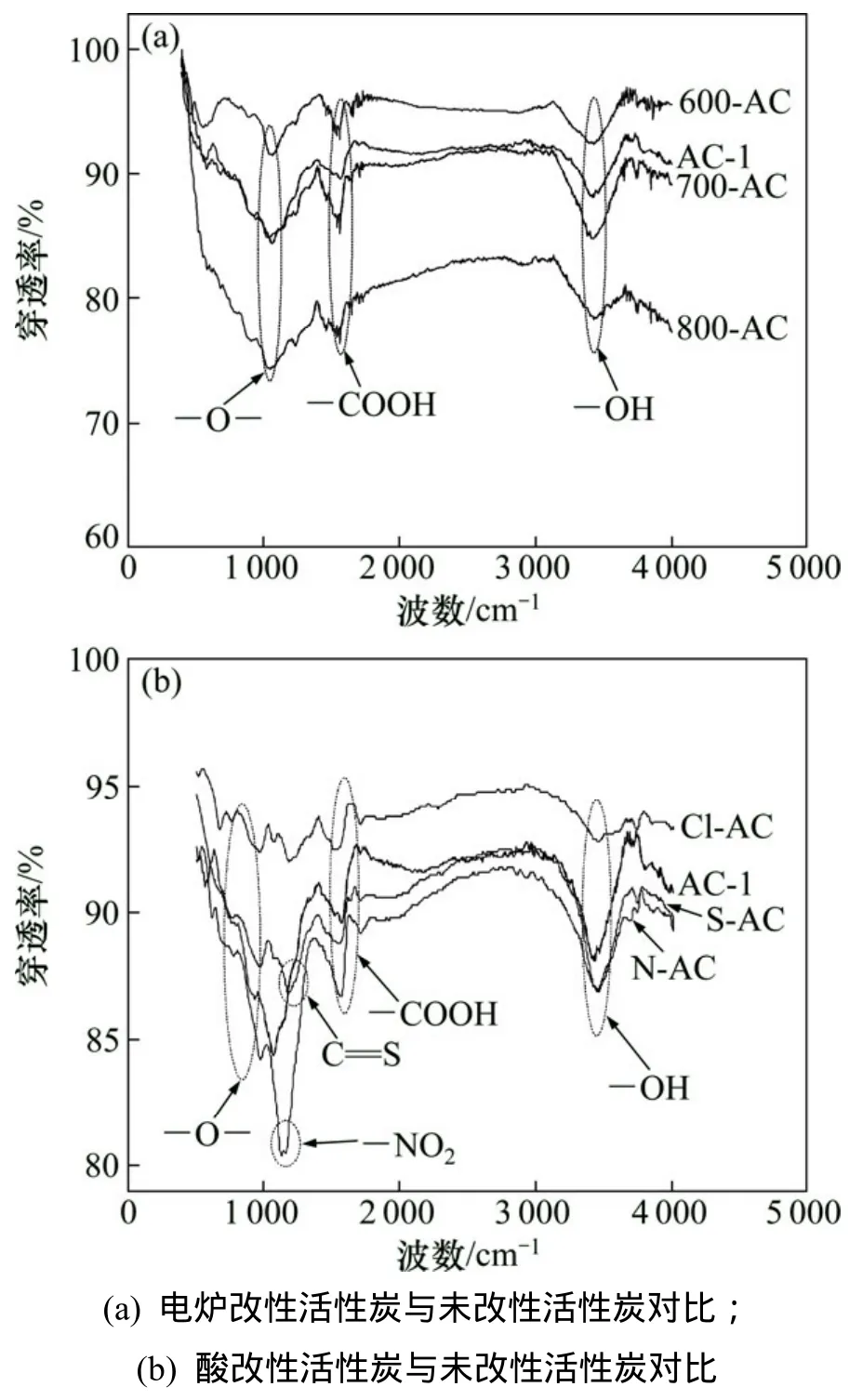
图2 活性炭样品的红外光谱Fig. 2 Infrared spectra of activated carbon
2.2 改性对活性炭物理结构影响
改性活性炭样品及原样的孔结构参数列于表 2。图3所示为DFT方法计算的活性炭孔径分布。
由表2可知:600-AC,700-AC和800-AC的比表
面积增幅分别为22.6%,5.0%和5.9%,理论有效孔容的增量分别为0.09,0.06和0.05 mL/g。酸改性中N-AC的比表面积增大3.8%,而S-AC和Cl-AC的分别减小5.6%和14.6%。Cl-AC的理论有效孔容减小0.02 mL/g,而N-AC和S-AC的增大分别为0.03和0.02 mL/g。综上所述,在优化活性炭物理结构方面,热改性比酸改性效果更显著。
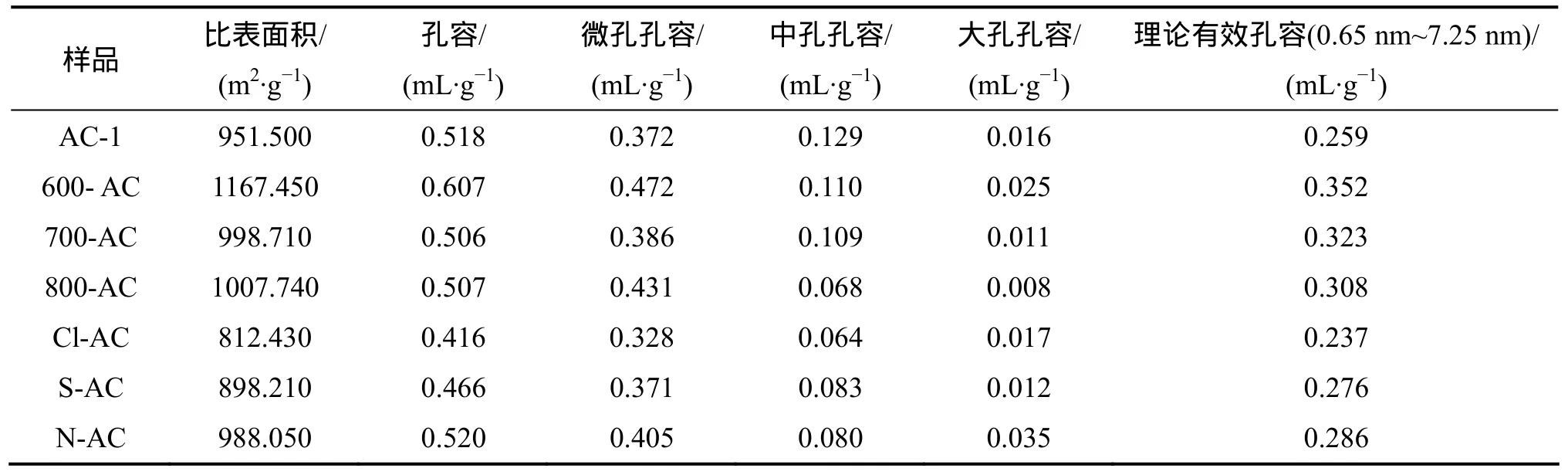
表2 活性炭样品的孔结构参数Table 2 Pore structure parameters of activated carbon sample
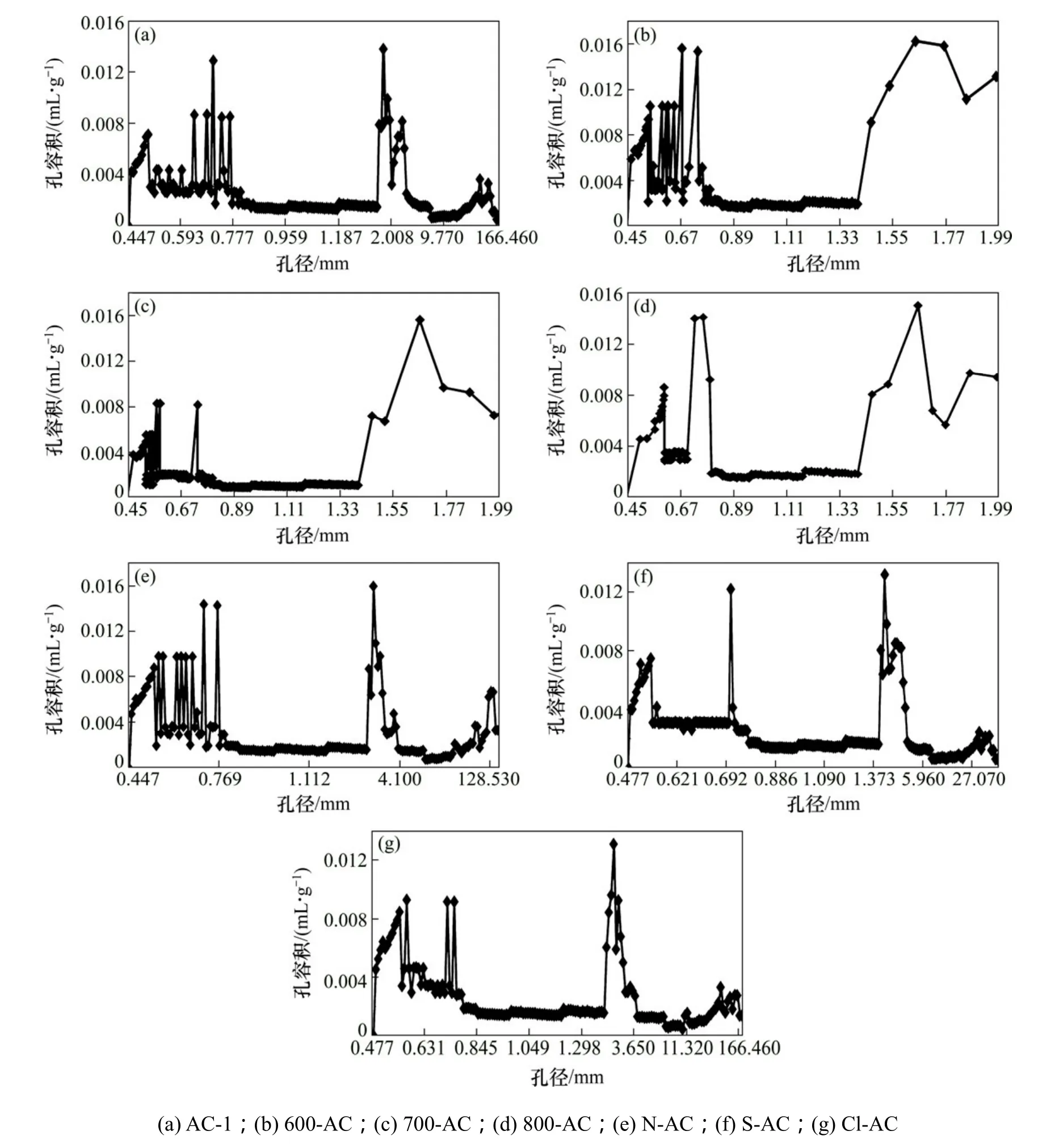
图3 DFT方法计算的活性炭孔径分布Fig. 3 Activated carbon pore size distribution calculate by DFT
由图3可见:孔径范围为0.4~170 nm,各样品孔径基本分布在微孔和较小的中孔范围。在孔径0.57~0.78 nm范围内600-AC的孔容较AC-1的明显增强,这是由于活性炭在600 ℃下,孔道内杂质分解,畅通孔道,增大孔容积;与 AC-1相比,700-AC和800-AC的微孔孔径分布集中在0.6 nm以下,微孔孔径分布变窄。此时,活性炭微孔壁受700和800 ℃高温作用,类石墨微晶的碳层面趋于规整化,导致层间孔收缩造成的[18]。
N-AC在孔径0.58~0.77 nm范围内孔容积增大显著,出现明显的扩孔现象。S-AC和 Cl-AC分别在0.6~0.72 nm和0.6~0.63 nm范围内,孔容积明显减小,由于硫酸、盐酸对活性炭内部侵蚀出现孔结构塌陷现象,堵塞了部分微孔[19]。
2.3 吸附性能
图4所示为活性炭在283 K下对二氯乙烷的等温吸附曲线。从图4可以看出,活性炭样品BDDT分类均属于Ⅰ型等温线,且改性活性炭样品对二氯乙烷的吸附量均大于 AC-1的吸附量。活性炭样品的等温线的平台均为水平状,且在较低的相对压力下开始平衡,说明样品中含有大量的微孔。600-AC,700-AC,800-AC和 N-AC在吸附二氯乙烷初期的吸附量大于AC-1,而S-AC和Cl-AC的吸附量小于AC-1。吸附等温线的初始部分代表微孔充填,说明通过加热、硝酸的改性方法增大了活性炭的微孔容积,硫酸、盐酸的改性方法减小了微孔容积,这与孔结构测试结果相符合。
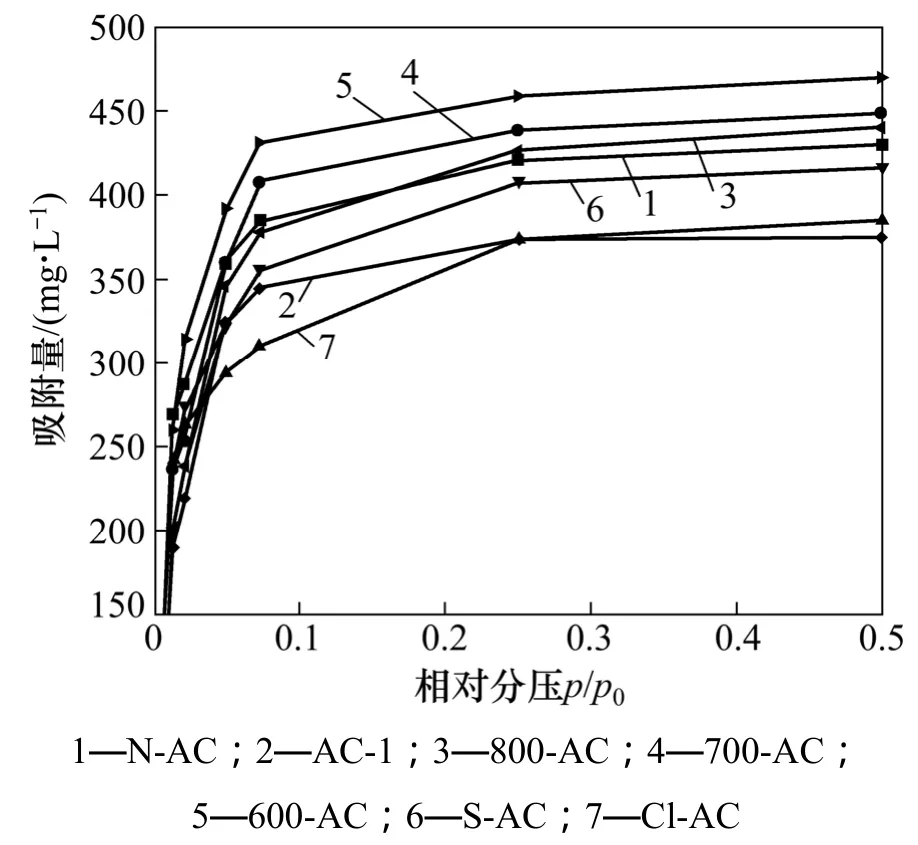
图4 活性炭在283 K下对二氯乙烷的等温吸附曲线Fig. 4 Adsorption isothermal curves of 2-dichloroethane at 283 K
2.3.1 改性活性炭孔结构对吸附量的影响
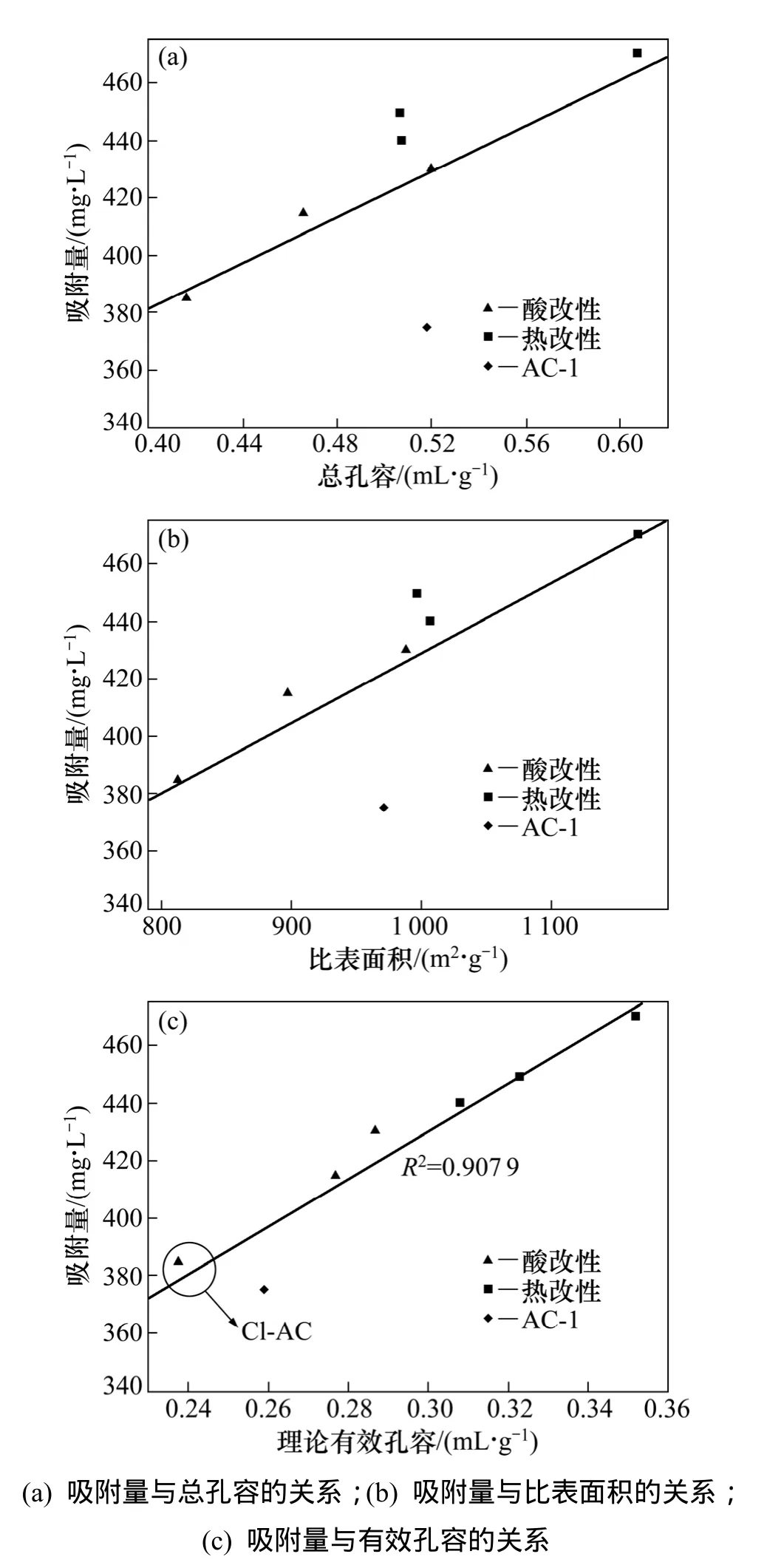
图5 吸附量与总孔容、比表面积、有效孔容的关系Fig. 5 Relationships between pore properties and adsorption capacity of activated carbons
吸附量与总孔容、比表面积和有效孔容关系见图5。二氯乙烷在活性炭上的吸附量与总孔容、比表面积的线性相关性不明显,但总体趋势是吸附量随着总孔容和比表面积的增大而增大。这与Gao等[20]研究的比表面积的增大有益与吸附量的提高一致。
二氯乙烷在活性炭上的吸附量与理论有效吸附孔容存在良好的线性相关性,表明热改性、酸改性扩大活性炭理论有效吸附孔容是提高二氯乙烷在活性炭表面吸附量的有效原因。然而,Cl-AC的活性炭理论有效孔容比AC-1的小,但二氯乙烷在Cl-AC上的吸附量比 AC-1的大,这可能受到 Cl-AC表面官能团的影响。
2.3.2 改性表面官能团对吸附量的影响
表面官能团含量对二氯乙烷吸附量影响如图6所示。可见:碱性官能团大量存在的活性炭样品二氯乙烷吸附量较大,而酸性官能团大量存在的活性炭样品吸附量高于 AC-1,却低于碱性官能团大量存在的样品。这是由于碱性官能团通常给活性炭石墨层分配 π电子,增强活性炭表面的π电子云密度,增强与二氯乙烷之间的π-π色散力,促进活性炭对二氯乙烷的吸附。二氯乙烷分子的偶极矩比较大,酸性含氧官能团增大样品与二氯乙烷之间的偶极-偶极相互作用,促进吸附。对于吸附性能的影响,π-π色散力比偶极-偶极相互作用更有效[21]。
综上所述,改性提高活性炭的理论有效孔容是提高二氯乙烷吸附量的有效途径。改性增加表面官能团辅助增强了吸附能力,促进吸附作用。
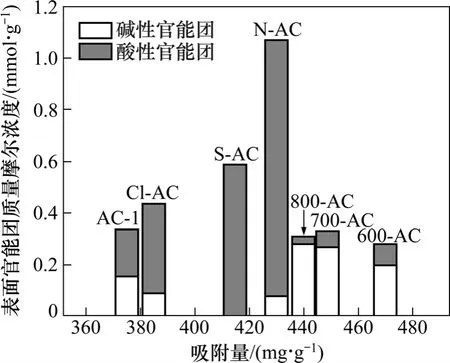
图6 表面官能团质量摩尔浓度与二氯乙烷吸附量的关系Fig. 6 Relationships between surface group and adsorption capacity of 2-dichloroethane
2.3.3 改性对吸附能的影响
D-R方程可以很好地描述化合物在炭材料上的吸附行为,通过对吸附等温线用D-R方程进行线性拟合,可得出活性炭的特征吸附能E0。D-R方程的形式为:
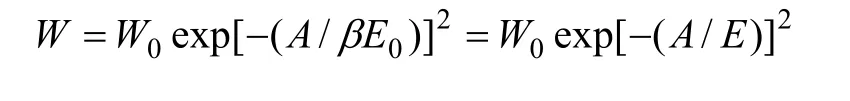
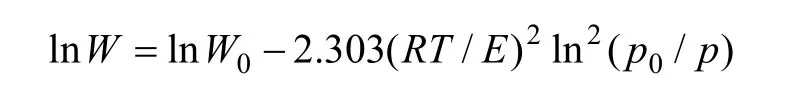
式中:W为孔中吸附质的平衡吸附容量;p/p0为相对压力;W0为微孔极限吸附容积;A为吸附势,A=RTln(p0/p);β为吸附亲和系数;E0和E分别为标准吸附质苯和所用吸附质的特征吸附能;p0和p分别为饱和蒸汽压和平衡压力;R为摩尔气体常数;T为热力学温度。将7种炭样氮吸附等温线按照D-R方程进行线性关联,得到转化为分压 ln2(p0/p)与吸附容积对数lnW的关系,结果如图7所示。根据D-R方程线性拟合得到的直线斜率为2.303(RT/βE0)2,N2的亲和系数为0.33,由此求得600-AC,700-AC,800-AC,Cl-AC,N-AC,S-AC和 AC-1的特征吸附能分别为 14.85,15.93,15.20,15.01,14.95,15.10 和 14.49 kJ/mol。二氯乙烷的亲和系数β为0.71,则可计算活性炭对二氯乙烷的吸附能,表4所示为活性炭对二氯乙烷的吸附能。可见,改性增大了活性炭吸附二氯乙烷的吸附能,吸附能主要由分子间作用力提供,吸附非极性分子二氯乙烷时色散力的贡献最大,表面官能团增大与二氯乙烷分子作用力,这与活性炭表面官能团促进吸附作用结果是一致的,说明吸附能在一定程度上反映官能团对吸附性能的影响程度。
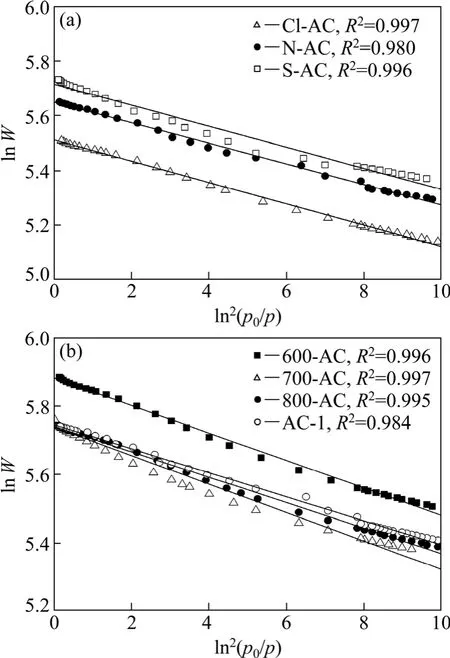
图7 氮吸附等温线D-R方程线性拟合曲线Fig. 7 D-R equation of linear regression graph based on nitrogen adsorption isotherms of activated carbon
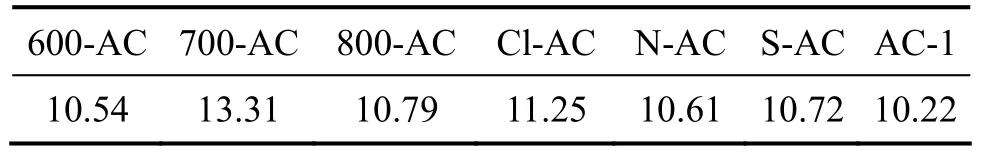
表4 活性炭对二氯乙烷的吸附能Table 4 Adsorption energy of AC to 2-dichloroethane
3 结论
(1) 酸改性活性炭可以增加酸性基团数量,且酸氧化性越强,酸性官能团数量越多;热改性可以提高碱性基团数量,且加热温度升高,碱性基团形成增多,酸性官能团分解加剧。
(2) 热改性比酸改性优化孔结构的效果更显著。热改性可以疏通孔道,分解杂质,增加活性炭的比表面积、理论有效孔容;酸改性会出现扩孔、塌孔现象,导致盐酸改性比表面积、理论有效孔容减小,硝酸、硫酸略微增大。
(3) 提高有效理论吸附孔容是增大二氯乙烷吸附量的有效方法;表面官能团的增加,加强了活性炭与二氯乙烷分子间的π-π色散力、偶极-偶极相互作用,促进活性炭对二氯乙烷的吸附作用。
(4) 酸改性、热改性分别增大活性炭吸附二氯乙烷的吸附能,且改性活性炭表面官能团与二氯乙烷分子间色散力是主要影响因素。
[1] Ao C H, Lee S C. Indoor air purif i cation by photo catalyst TiO2immobilized on an activated carbon fi lter installed in an air cleaner[J]. Chemical Engineering Science, 2005, 60(1):103-109.
[2] Lillo-Rodenas M A, Fletcher A J, Thomas K M. Competitive adsorption of a benzene–toluene mixture on activated carbons at low concentration[J]. Carbon, 2006, 44(8): 1455-1463.
[3] Byeon J H, Park J H, Yoon K Y, et al. Removal of volatile organic compounds by spark generated carbon aerosol particles[J]. Carbon, 2006, 44(10): 2089-2108
[4] Chiang Y C, Chiang P C, Huang C P, et al. Effects of pore structure and temperature on VOC adsorption activated carbon[J]. Carbon, 2001, 39(4): 523-534.
[5] Chuang C L, Chiang P C, Chang E E, et al. Modeling VOCs adsorption onto activated carbon[J]. Chemosphere, 2003, 53(1):17-27.
[6] Lillo-Rodenas M A, Cazorla-Amoros D, Linares-Solano, et al.Behaviour of activated carbons with different pore size distributions and surface oxygen groups for benzene and toluene adsorption at low concentration[J]. Carbon, 2005, 43(8):1758-1767.
[7] Domingo-Garcia M, Lopez-Garzon F J, Perez-Mendoza M, et al.Effect of some oxidation treatments on the textural Characteristics and surface chemical nature of an activated carbon[J]. Journal of Colloid and Interface Science, 2000, 222(2):233-240.
[8] Valente Nabais J M, Carrott P J M, Ribeiro Carrott M M L, et al.Preparation and modification of activated carbon fibres by microwave heating[J]. Carbon, 2004, 42(7): 1315-1320.
[9] Chen P J, Wu S. Acid/base-treated activated carbons:Characterization of functional groups and metal adsorptive properties[J]. Langmuir, 2004, 20(6): 2233-2242.
[10] Strelko J V, Malik D J, Streat M. Characterisation of the surface of oxidized carbon adsorbents[J]. Carbon, 2002, 40(1): 95-104.
[11] Lopez-Garzon F J, Domingo-Garcia M. Textural and chemical surface modifications produced by some oxidation treatments of a glassy carbon[J]. Langmuir, 2003, 19(7): 2838-2844.
[12] Puziy A M, Poddubnaya O I, Martinez-Alonsb A, et al.Synthetic carbons activated with phosphoric acid: I. Surface chemistry and ion binding properties[J]. Carbon 2002, 40(13):1493-1505.
[13] Leon C, Leon Y, Calemma V, et al. Evidence for the protonation of basal plane sites on carbon[J]. Carbon, 1992, 30(5): 797-811.
[14] Biniak S, Szymaski G, Siedlewski J, et al. The characterization of activated carbons with oxygen and nitrogen surface groups[J].Carbon, 1997, 35(12): 1799-1810.
[15] Zielke U, Huttinger K, Hoffman WP, et al. Surface-oxidized carbon fibers: I. Surface structure and chemistry[J]. Carbon,1996, 34(16): 983-998.
[16] Huang C C, Li H S, Chen C C. Effect of surface acidic oxides of activated carbon on adsorption of ammonia[J]. Journal of Hazardous Materials, 2008, 159(2/3): 523-527.
[17] Pereira M F R, Soares S F, Orfao J J M, et al. Adsorption of dyes on activated carbons: Influence of surface chemical groups[J].Carbon, 2003, 41(4): 811-821.
[18] 乔志军, 李家俊, 赵乃勤. 高温热处理对活性炭纤维微孔及表面性能的影响[J]. 新型炭材料, 2004, 19(1): 53-56.QIAO Zhijun, LI Jiajun, ZHAO Naiqin. Influence on pore structure and surface groups of activated carbon fiber over high temperature heat treatment[J]. New Carbon Materiala, 2004,19(1): 53-56.
[19] Kim K J, Kang C S, You Y J, et al. Adsorption–desorption characteristics of VOCs over impregnated activated carbons[J].Catalysism Today, 2006, 111(3/4): 223-228.
[20] Gao F, Zhao D L, Li Y, et al. Preparation and hydrogen storage of activated rayon-based carbon fibers with high specific surface area[J]. Journal of Physics and Chemistry of Solids, 2010, 71(4):444-447.
[21] Almazan-Almazan M C, Perez-Mendoza M, Domingo-Garcia M,et al. The role of the porosity and oxygen groups on the adsorption of n-alkanes, benzene, trichloroethylene and 1,2-dichloroethane on active carbons at zero surface coverage[J].Carbon, 2007, 45(9): 1777-1785.
