禁水致脱水对大鼠睾丸内精子输送影响的形态定量研究
2013-05-30朱金钗李君安杨正伟
朱金钗,郭 洋,向 宇,彭 彬,李君安,唐 中,杨正伟
(1.川北医学院形态定量研究室;2.川北医学院细胞化学研究室;3.川北医学院附属医院检验科,四川 南充 637000)
本刊网址:http://www.nsmc.edu.cn 作者投稿系统:http://noth.cbpt.cnki.net 邮箱:xuebao@nsmc.edu.cn
笔者实验室的前期研究显示,成年大鼠严重高血糖合并高血脂5 ~6 周导致附睾内精子总数减少约60%,但睾丸内精子细胞总数的减少仅约15%[1]。考虑到睾丸内长形精子细胞有一定程度的滞留[1],且睾丸网似有增厚[2],附睾内精子大幅减少可能与睾丸内精子的淤积或精子向附睾的输送障碍有关。睾丸内精子尚无运动力,其输送主要取决于Sertoli 细胞分泌的睾丸液(精子输送的载体)和生殖管道(包括生精小管)的收缩(精子输送的动力)。鉴于严重高糖高脂血症势必导致严重脱水,而脱水又可能使睾丸液分泌减少,因此本文设计了一个急性脱水模型(禁水)来初步探讨脱水是否会影响精子的输送。
1 材料与方法
1.1 动物与实验
本文采用的动物是38 只51 ~52 天龄正常雄性Sprague-Dawley 大鼠(体重约67 ~131 g),由川北医学院动物中心提供,均单笼饲养。动物按体重排序(根据修匀法)后等距随机[3]分成两组:对照组(n =18)与实验组(n =20)。对照组既喂食(颗粒饲料)又喂水,实验组只喂食不喂水。实验4 d 后分别从对照组和实验组随机抽选9 只和7 只动物取材,5 d后从余下存活动物(对照组和实验组各9 只和5只)取材(取材前对照组没有动物死亡,而实验组共有8 只动物死亡)。
取材时先用戊巴比妥钠腹腔内注射麻醉,然后剖开胸腔充分暴露心脏,用真空采血管直接从左心室采集血液(2 mL 左右)。(实验组有两只动物采血不成功,没有血液标本)紧接着剖开腹腔,取出双侧睾丸和附睾。
1.2 血液检查
采血后在3 ~4 h 之内测量红细胞比容(采用美国贝克曼L750 型全自动血细胞分析仪)以及血清钠、钾浓度(采用美国贝克曼DXC800 型全自动化分析仪)。从每个动物的血液标本中取样3 次进行每个指标的测量,以其3 次测量值的均值作为各个动物的结果。
1.3 切片制备
器官标本取出后立即用Bouin 液浸润固定48 h,然后换入70%乙醇保存。1 周后游离一侧(左侧或右侧,不同动物交替确定)睾丸和附睾,并称重、测密度以估计器官体积[3],接着切取组织块。
大致沿垂直于睾丸、附睾长轴的方向,分别从每个睾丸、每个附睾头部和每个附睾尾部等距随机切取厚约2 mm 的两个组织块。组织块经乙醇和正丁醇脱水后包埋入甲基丙烯酸树脂(2-hydroxyethyl methacrylate,德国Leica Microsystems Nussloch GmbH产品)。
从每个组织块切取1 张切片(20 μm 厚)用于研究。睾丸切片用PAS(过碘酸与Schiff 试剂)和苏木精染色(各1 h),附睾切片仅用苏木精染色(1 h)。
1.4 形态定量研究
1.4.1 睾丸的形态定量研究 用体视学图像系统(丹麦Visiopharm 产品)所配置的光学显微镜(日本Olympus,BX51 型)的20× 物 镜(UPlanSApo,NA 0.75)摄取图像,在电脑显示屏上观察(图1 是用100 ×物镜所摄图像)。从切片左上角开始依次向右、向下、向左、向下、向右……等距(随机)抽选测试视野(视野间距设定为600 μm),直至测完整张切片。视野图像上叠加有4 个(2 ×2)测点(其横向与纵向间距均为437 μm)和1 个禁线框(位于视野左下角,200 μm×200 μm 大小)。先在切片上表面聚焦,然后向下移动3 μm 聚焦,以此聚焦平面作为测量平面。每2 个视野进行1 个视野的测点计数(即间隔1 个视野进行测点计数):观察记录位于不同结构(生精小管壁、生精小管腔、间质)的测点数。测完后根据测点数计算睾丸内生精小管、生精小管腔以及间质的体积分数,并进一步结合睾丸体积计算睾丸内这些结构的总体积[3]。在每个睾丸的2张切片上,总共计数了(249 ±46)个测点。
在每个视野上用禁线框根据禁线法则抽选有管腔的近似圆形或椭圆形的生精小管轮廓,然后测量其直径(短径)[3],并定性判断其生精细胞是否排列疏松、是否有长形精子细胞滞留[4-5]。生精细胞排列疏松指的是,生精小管轮廓内至少可见两个裂隙,每个裂隙至少可见两个紧邻的生精细胞与另两个紧邻的生精细胞之间有明显的裂缝[4];长形精子细胞滞留指的是,本该出现在生精周期前半期且位于生精小管近腔面的长形精子细胞,却出现在生精周期后半期的生精小管上,或位于生精小管近基膜的位置,甚至朝向紊乱(即细胞核头尾端的方向错乱)[5],见图1。在每个睾丸的两张切片上,总共观测了(56 ±12)个生精小管轮廓。
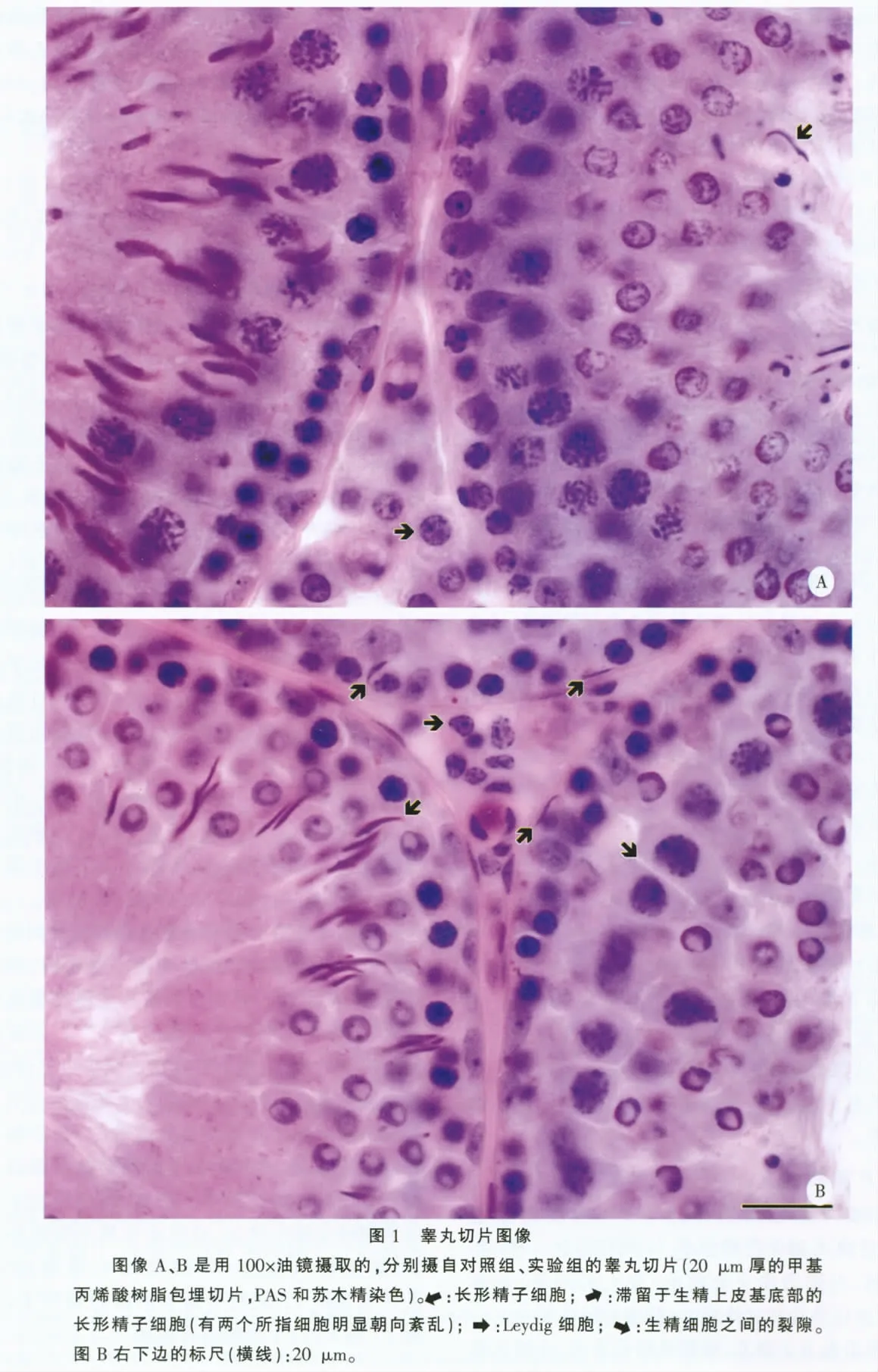
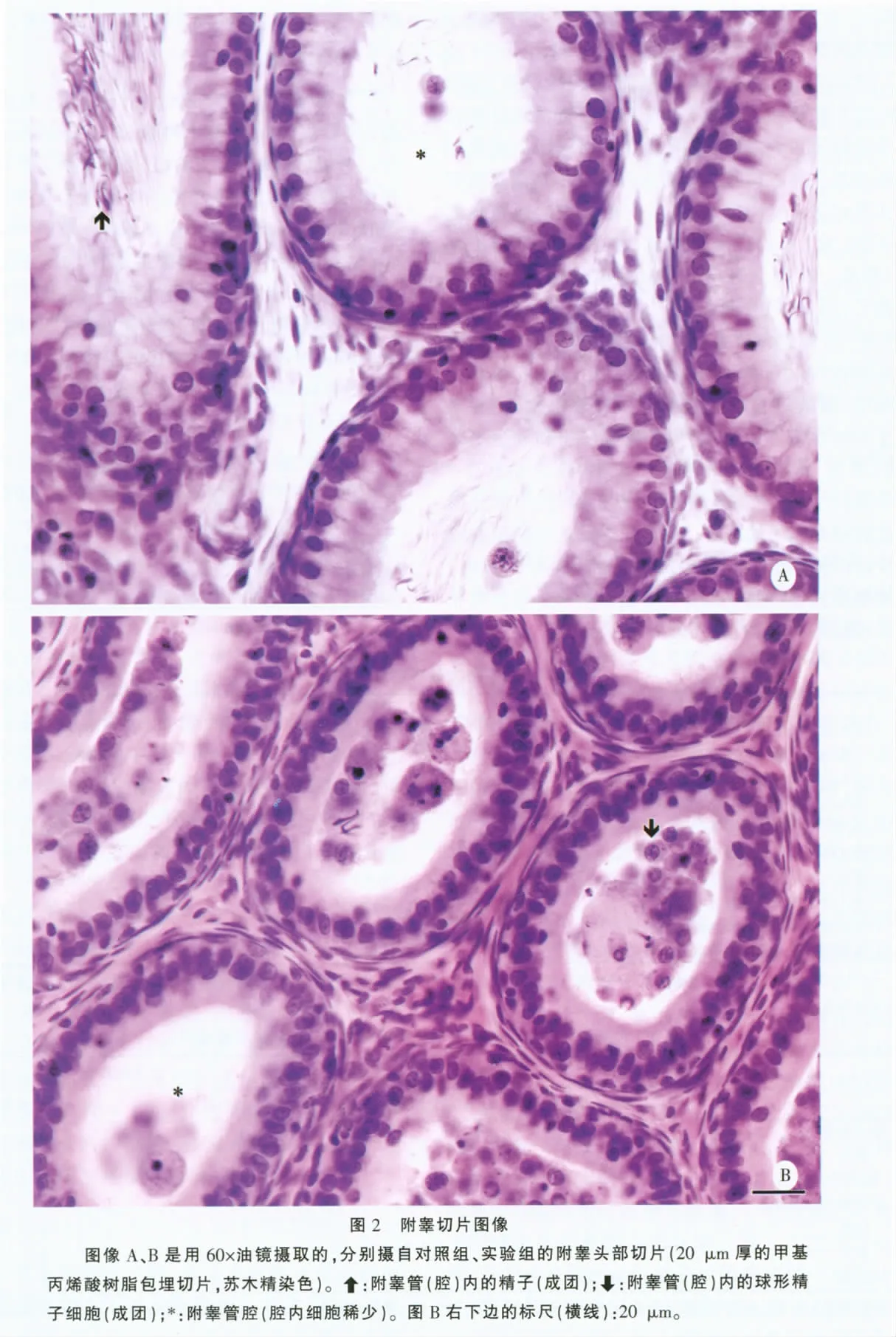
1.4.2 附睾的形态定量研究 如上所述用体视学图像系统进行测点计数,不过所用物镜是100 ×油镜(UPlanSApo,NA 1.40),视野间距为200 ~800 μm,每个视野上仅叠加1 个测点。根据测点计数分别估计附睾内的附睾管、附睾管内细胞团和间质的体积分数及其总体积。附睾头部内的所谓附睾管在本文里包括输出小管,附睾管内的细胞团由密集的精子和(或)未成熟生精细胞(主要是球形精子细胞)构成。在每个附睾头或尾的两张切片上,总共计数了(78 ±44)个测点。
1.4.3 附睾管内细胞数的半定量分析 用普通光学显微镜的40 ×物镜观察附睾切片,盲法(不看切片编号)判断每张切片附睾管内的细胞数(主要是精子和球形精子细胞)。精子数分较多和较少两个(级)结果,球形精子细胞数分较多、较少和散在3个结果。“较多”、“较少”分别指大部分、小部分附睾管腔内见成团的细胞,“散在”指仅见少量散在或稀少的细胞(图2)。每个附睾头或尾(附睾管内)的细胞数,以其两张切片中细胞数较多(如果两张切片的结果不同)的那张切片的结果表示,或以其1张切片的结果表示(如果两张切片的结果一样)。
1.5 统计学分析
表1 大鼠脱水相关指标(±s)

表1 大鼠脱水相关指标(±s)
* P≤0.05,两组指标相比。
对照组(n=18) 实验组(n=12)体重(g) 113 ±25*78 ±16血细胞比容(%) 36.1 ±2.9* 50.1 ±4.1血清钠(mmol/L) 144 ±2* 166 ±15血清钾(mmol/L)5.26 ±0.87 4.75 ±1.23
表2 大鼠睾丸形态定量结果( ±s)

表2 大鼠睾丸形态定量结果( ±s)
* P≤0.05,两组指标相比;#随机抽选的生精小管轮廓( 有管腔,圆形或椭圆形) 中,可见生精细胞排列疏松或长形精子细胞滞留的小管轮廓所占百分比。
对照组(n=18) 实验组(n=12)睾丸体积(mm3) 751 ±186*612 ±166生精小管平均直径(μm) 219 ±18* 204 ±22睾丸内生精小管的体积分数(%) 72.4 ±2.8* 76.2 ±4.9睾丸内生精小管的总体积(mm3) 543 ±134 464 ±120睾丸内间质的体积分数(%) 27.6 ±2.8* 23.8 ±4.9睾丸内间质的总体积(mm3) 208 ±57* 148 ±56睾丸内生精小管管腔的体积分数(%) 3.4 ±1.3 4.2 ±2.6睾丸内生精小管管腔的总体积(mm3) 25 ±8 27 ±22生精细胞排列疏松的生精小管轮廓数(%)# 5.9 ±12.5* 29.4 ±27.0有长形精子细胞滞留的生精小管轮廓数(%)# 14.2 ±11.3*53.5 ±15.5

表3 大鼠附睾内精子和球形精子细胞的数量(半定量观察结果)
表4 大鼠附睾形态定量结果(±s)

表4 大鼠附睾形态定量结果(±s)
* P≤0.05,两组的附睾头部或尾部指标相比;#P≤0.05,对照组的附睾头部与尾部指标相比。
附睾头部对照组(n=18) 实验组(n=12)附睾尾部对照组(n=18) 实验组(n=12)体积(106μm3) 90.0 ±30.0* # 53.2 ±27.3 32.2 ±11.5*23.9 ±11.6附睾管的体积分数(%) 59.9 ±10.8 62.9 ±9.2 53.2 ±6.9 54.7 ±7.6附睾管的总体积(106μm3) 55.6 ±27.6* # 34.0 ±19.3 17.1 ±6.7* 13.5 ±8.4间质的体积分数(%) 40.2 ±10.8 37.1 ±9.2 46.8 ±6.9 45.4 ±7.6间质的总体积(106μm3) 34.5 ±8.6* # 19.2 ±9.6 15.1 ±5.9* 10.5 ±3.9附睾管内细胞团的体积分数(%) 9.2 ±10.7 14.6 ±13.5 8.3 ±12.3* 19.2 ±13.1附睾管内细胞团的总体积(106μm3) 10.1 ±12.5# 7.9 ±7.8 3.8 ±7.0*5.3 ±5.5
2 结果
与对照组相比,实验组动物体重(实验结束时)减少了30%,血细胞比容和血清钠水平分别增加了40%和15%,但血清钾水平无显著性改变(表1)。
睾丸切片的一般组织学观察可见实验组(与对照组相比)主要有以下特征:生精小管壁(生精上皮)内的生精细胞排列较疏松,有长形精子细胞滞留;Leydig 细胞核似有皱缩,边缘不光滑(图1)。对照组动物有5.9%和14.2%的生精小管轮廓分别可见生精细胞排列疏松、长形精子细胞滞留,而实验组的这两个结果分别高达29.4%和53.5%(表2)。定量研究表明,实验组睾丸的主要变化是:睾丸的体积减少19%,其中生精小管的总体积减少15%(小管直径缩小7%),而间质的总体积减少29% (表2)。
附睾头或尾的一般组织学观察难以看出两组间有什么不同的形态特征。半定量分析显示,实验组附睾头部或尾部附睾管内的球形精子细胞较多(表3、图2)。形态定量研究表明,实验组附睾头部、尾部的体积分别减少约41%、26%,其中附睾管以及附睾管之间的间质的总体积都减少,间质总体积的减少幅度(44%、30%)更大(表4)。不过,附睾头部或尾部附睾管内的细胞团的总体积没有减少,尾部细胞团的总体积甚至有增加(表4)。
3 讨论
从血液化验指标来看,本文通过禁水成功创建了一个高渗性脱水[6]的动物模型。不过,实验过程中我们注意到,禁水期间动物的饲料消耗量日渐减少(未发表数据)。因此,这种禁水模型不仅可造成脱水,还可能造成营养不良甚至紧张、焦虑。
本文研究显示,禁水致脱水伴有动物体重下降,器官体积减少。就睾丸与附睾来讲,体积减少更多的是间质。
从睾丸精子发生过程的组织学观察来看,本文所用禁水致脱水的短期模型,并未明显影响或阻断精子发生的各个阶段。精子发生虽仍在继续,但明显有生精细胞排列疏松并脱落以及长形精子细胞滞留的征象。精子发生继续的同时,精子和脱落的未成熟生精细胞从睾丸向附睾的输送也仍在进行,因为在附睾里我们看到了更多的球形精子细胞。睾丸网的形态特征也支持这个判断[7]。这说明,睾丸液这种细胞外液(精子和未成熟生精细胞输送的载体)的分泌还没有受到明显的影响。也许这是因为本文所用短期脱水模型,还处在一个细胞内液向细胞外液转移的病理生理过程[6]。因此,禁水致脱水这种模型对精子发生与输送的影响,与高糖高脂血症可能引起的改变[1-2]是不相同的。
本文研究发现,禁水致脱水使大鼠睾丸内的生精细胞排列疏松并大量脱落,这说明脱水容易损害生精细胞与Sertoli 细胞之间的连接结构或粘附分子,或者说生精细胞与Sertoli 细胞之间的连接结构或粘附分子对脱水很敏感。笔者以为,这个发现或推测值得进一步研究。不过有一点也值得注意,那就是生精细胞如此疏松与脱落,一定程度上可能与所用动物是青春期动物有关。因为本文研究也发现,正常青春期大鼠附睾管内的球形精子细胞较多见,甚至可见其成团分布,其中相对较多且容易分辨的是球形精子细胞,而正常成年大鼠附睾管内仅偶尔可见散在的未成熟生精细胞[5,8]。此外,笔者实验室以前就注意到,精子发生活跃的较年轻大耳白兔更易出现球形精子细胞脱落的征象[9]。就是说,青春期大鼠睾丸的生精细胞本来就容易脱落,这可能使某些因素(例如禁水致脱水)更易诱导其大量脱落。
本文也发现,未成熟生精细胞提前脱落伴有长形精子细胞滞留(释放障碍)。这二者看似矛盾,其实可能是统一的,即生精细胞疏松既导致了生精细胞脱落,也导致了一定程度的长形精子细胞滞留。生精细胞疏松可导致其脱落容易理解,它也可导致长形精子细胞滞留是因为,长形精子细胞的释放有赖于Sertoli 细胞的功能,而生精细胞排列疏松势必伴有Sertoli 细胞与长形精子细胞之间的连接问题(事实上生精细胞排列疏松可能就是由于Sertoli 细胞与生精细胞之间的连接问题所致),从而使Sertoli细胞不能帮助长形精子细胞正常释放[10]。这种情况下从生精上皮“释放”的长形精子细胞(附睾内所见精子),可能实际上是随其他生精细胞一起提前脱落的细胞(图2)。
本文见实验组睾丸Leydig 细胞核似有皱缩,那可能是脱水所致。不过,鉴于细胞形态改变小,细胞数量也看不出有什么变化,它可能不会影响睾酮分泌,即不会降低睾酮水平(尤其是睾丸内睾酮水平)。进一步讲,睾酮水平的短期、小幅变化也难以影响睾丸的精子发生。例如,大鼠睾酮不全撤退即使持续4 个月,也仅使11.5%的生精小管轮廓出现生精细胞排列疏松[11-12],睾酮急剧或几乎完全缺乏(Leydig 细胞几乎完全破坏所致)7 d 也仅使4.6%的生精小管轮廓出现生精细胞排列疏松[5]。因此我们认为,本文所见禁水致脱水所致睾丸改变可能与睾酮无关;即使有关,关系想必也不大。
本文采用附睾管内的精子(和未成熟生精细胞)贮存尚少的青春期大鼠,是为了更敏感的显示实验因素对附睾管内细胞贮存量的可能影响。因为如果采用附睾内已有大量精子贮存的成年动物[5,8],短短几天(与精子发生周期相比)的实验因素对附睾精子贮存量的影响,即使有的话也相对较小。
[1] 廖 波.高糖高脂血症对大鼠睾丸和附睾组织结构的影响的体视学研究[D].四川南充:川北医学院,2010
[2] 廖 波,邓显忠,代小思,等.成年SD 大鼠睾丸网的分布[J].川北医学院学报,2010,25(3):199 -208
[3] 杨正伟.生物组织形态定量研究基本工具:实用体视学方法[M].北京:科学出版社,2012
[4] 张仁东,杨正伟.睾酮致成人精子发生抑制不伴有明显的生精细胞排列疏松[J].川北医学院学报,2006,21(3):215 -217
[5] Yang ZW,Kong LS,Guo Y,et al.Histological changes of the testis and epididymis in adult rats as a result of Leydig cell destruction after ethane dimethane sulfonate treatment:a morphometric study[J].Asian J Androl,2006,8(3):289 -299
[6] 李树清.水、电解质代谢紊乱[A].见:金惠铭,王建枝.病理生理学[M].第7 版,北京:人民卫生出版社,2009.15 -45
[7] 杨正伟,尹雨婷,郭 洋,等.禁水致脱水对大鼠睾丸网影响的形态定量研究[J].川北医学院学报,2013,28(3):207 -210
[8] Wen XH,Yang ZW.Quantitative (stereological)study on the spermatozoal storage capacity of epididymis in rats and monkeys[J].Asian J Androl,2000,2(1):73 -77
[9] Zhang RD,Wen XH,Kong LS,et al.A quantitative (stereological)study of the effects of experimental unilateral cryptorchidism and subsequent orchiopexy on spermatogenesis in adult rabbit testis[J].Reproduction,2002,124(1):95 -105
[10] O'Donnell L,Nicholls PK,O'Bryan MK,et al.Spermiation:the process of sperm release[J].Spermatogenesis,2011,1(1):14 -35
[11] Yang ZW,Guo Y,Lin L,et al.Quantitative (stereological)study of incomplete spermatogenic suppression induced by testosterone undecanoate injection in rats[J].Asian J Androl,2004,6(4):291 -297
[12] 邓显忠,廖 波,孔令淑,等.长期给予睾酮致大鼠生精小管伴有生精细胞排列疏松[J].中华男科学杂志,2011,17(6):507 -510
