气管滴注纳米二氧化硅颗粒致大鼠肺炎症反应及脏器中硅浓度变化的研究
2013-05-30崔冠群杜忠君侯松萍
崔冠群,杜忠君,高 静,侯松萍*
(1.吉林大学中日联谊医院a.呼吸内科;b.老年病科,吉林 长春130033;2.山东省医学科学院山东省职业卫生与职业病防治研究院,山东 济南250002)
随着科技的发展,生活中纳米产品的应用越来越多,环境中特别是职业环境悬浮大量的纳米颗粒物,呼吸道无疑是纳米颗粒进入人体的主要途径。张婷等[1]发现,纳米颗粒可沉积在动物的呼吸道各级支气管及肺泡内,即使吸入较低浓度的纳米颗粒,但因其粒径极小、数量大,也会对呼吸道产生明显的生物学效应,从而为纳米颗粒致肺脏损伤提供了可能。流行病研究也表明空气中的超细颗粒物是呼吸系统疾病入院率和死亡率增高的危险因素,且危害与颗粒物粒径相关,纳米颗粒对呼吸系统的影响不容忽视[2]。
纳米二氧化硅作为一种非金属氧化物,是当前世界最常用的工程化纳米材料,被广泛应用于材料、化工及生物医药等领域[3-5]。纳米二氧化硅颗粒可以通过呼吸道,皮肤接触,食物摄入以及医学静注等方式进入人体,而研究者认为呼吸道是人群暴露纳米颗粒的主要进入途径[6,7]。因此,肺脏就成为纳米二氧化硅颗粒作用的最直接、最主要的靶器官。纳米二氧化硅颗粒的肺毒理学研究也成为当前的研究热点,但目前实验数据较少,机制尚未明确,所得的研究结论也未完全一致。而且近年来的研究主要集中在纳米尺度与常规尺度的颗粒的急性毒性的比较研究[8-10],关于纳米二氧化硅颗粒对肺组织的时间效应报道较少,本研究采用非暴露式气管滴注30 nm二氧化硅颗粒染毒雄性Wistar大鼠,观察不同时间纳米二氧化硅颗粒可能产生的肺脏炎症反应。以便为纳米材料吸入机体后致肺脏毒性评价提供实验依据。
1 材料和方法
1.1 试剂和仪器 无定形纳米二氧化硅颗粒(30 nm)由吉林大学化学学院提供;透射电子显微镜(JEM-2010,日本JEOL公司);粒度分析仪(Nano ZS90,英国 Malvern公司);Scintag XRD-2000衍射仪(美国Scintag,Inc.Cupertino,CA);电感耦合等离 子体质 谱 (美国 PerKin-Elmer,Wellesley,MA);电感耦合等离子体发射光谱(美国PerKin-Elmer,Wellesley,MA);全自动生化分析仪(TBA-200FR,日本Toshiba Medical Systems公司);全自动红细胞分析仪(XT-2000iV,日本Toshiba Medical Systems公司);UV-752紫外分光光度计(中国棱光公司);光学显微镜(DM4000M,德国Leica公司);透射电子显微镜(JEM-100CXⅡ,日本JEOL公司);微波消解仪(MDS-6,意大利 Milestone公司)。
1.2 实验动物分组及染毒
128只健康雄性SPF级 Wistar大鼠,购自吉林大学白求恩医学部实验动物中心,体重在180-210g,动物房合格证书号:SYXK (Ji)2007-0011,大鼠购入后在SPF级饲养室内适应性喂养一周,饲养温度为18-24℃,相对湿度为45%,昼夜循环节律:12h:12h;动物实验全部遵循吉林大学白求恩医学部伦理委员会的评估和批准协议。实验设空白对照组及实验组(0.5、1及2mg/Kg·bw),每个剂量组含有32只大鼠,采用气管滴注法一次染毒,滴注体积为0.2ml;连续观察染毒后1d、7d、14d以及28d大鼠的情况。
1.3 表征纳米二氧化硅颗粒
采用透射电子显微镜测定粒子的粒径及分布;采用Scintag衍射仪表征粒子的晶体结构;采用ICP-MS检测纳米二氧化硅颗粒中的金属杂质。
1.4 大鼠脏器中Si含量的测定
染毒后不同时间点,处死大鼠,准确称量心、肝、脾、肺、肾、脑各0.4g,微波消解30分钟,采用ICPOES测量不同时间点各脏器中的Si含量。
1.5 肺泡灌洗液的制备及其指标的检测
染毒各个时间点后,用镊子固定结扎左肺,首先用3ml预热的生理盐水(37℃)灌洗右肺,得到的肺泡灌洗液(BALF)4℃、2 200rpm离心10min,上清液用来进行生物化学检测;然后再用2ml预热的生理盐水灌洗右肺2次,分别按照以上条件离心获得BALF,收集离心后的沉淀细胞进行细胞计数。
1.6 统计学分析
采用SPSS 16.0统计软件,计量资料以均数±标准差(±s)表示,组间比较采用单因素方差分析(One way ANOVA)。P<0.05表示差异有统计学意义。
2 结果
2.1 纳米二氧化硅颗粒的表征
如图1与表1所示,通过透射电镜观察,纳米二氧化硅颗粒呈椭球型,平均粒径在27.26±4.92 nm,并呈现轻微的聚合现象,这可能与颗粒的高表面活性有关。水合粒径与比表面积分别为71.43 nm和158.02m2/g;并且本研究所用颗粒经ICPMS检测,纯度高达99.8%,符合本实验的要求。

图1 无定形纳米二氧化硅颗粒的电镜图片

表1 Characterization of silica particles
2.2 组织中的硅浓度改变
大鼠气管滴注纳米二氧化硅颗粒后,不同时间点各脏器中硅浓度如图2所示,与对照组相比较,滴注后的四个时间点,每个暴露组的肺脏、肝脏、肾脏中的Si含量均显著升高,(P均<0.05)。脾脏中的硅含量,2mg/Kg·bw暴露组在滴注后四个时间点,1mg/Kg·bw暴露组在滴注后7、14以及28天后均显著升高,(P均<0.05)。各个暴露组心和脑中的硅含量虽然随着时间和剂量的增加有升高趋势,但(P 均>0.05)。
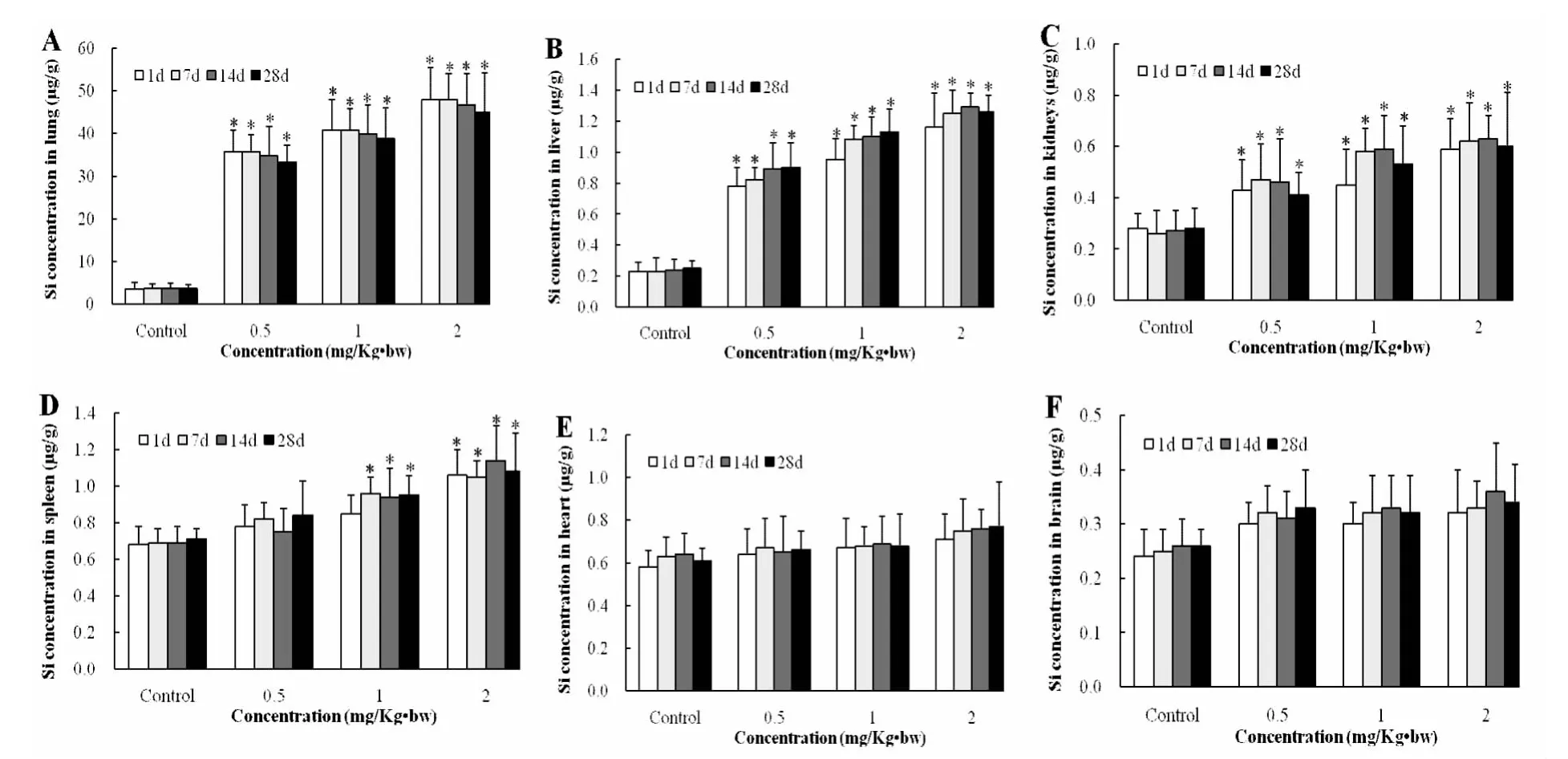
图2 气管滴注纳米二氧化硅颗粒后大鼠各组织中的硅浓度
2.3 肺泡灌洗液中的白细胞总数及生物化学的变化

图3 肺泡灌洗液中的白细胞总数及生物化学分析
肺泡灌洗液中的白细胞总数如图3A所示,每个时间点的1、2mg/Kg·bw暴露组以及滴注后14及28天的0.5mg/Kg·bw暴露组的白细胞总数明显高于各自的空白对照组(P<0.05),并且肺泡灌洗液中的白细胞总数呈现一定的剂量效应关系。每个观察时间点的2mg/Kg·bw暴露组,暴露后1及7天的0.5mg/Kg·bw暴露组以及暴露后1、7及14天的1mg/Kg·bw暴露组的蛋白含量明显高于各自观察时间点的对照组(P<0.05)(图3B)。每个观察时间点的0.5、1和2mg/Kg·bw暴露组的LDH活性显著高于其对照组(P<0.05)(图3C)。
3 讨论
本研究用Wistar大鼠制作动物模型,以生理盐水作为空白对照,采用非暴露式气管滴注方式进行染毒,本方法简便,容易掌握,便于控制染毒浓度,在熟练操作的前提下,安全有效,因此该染毒方式是研究颗粒物急性、亚急性毒性效应较佳的选择。肺泡灌洗液中含有肺脏的游离细胞,从肺泡中分泌和渗出以及从血管渗出的各种生化成分,因此,肺泡灌洗液中的成分变化可迅速,定量的反映吸入的颗粒物对肺脏的损伤程度。所以,本实验中主要采用分析肺泡灌洗液中的成分变化来研究纳米二氧化硅颗粒对Wistar大鼠的肺损伤作用。
流行病学研究显示,肺内颗粒负荷与肺纤维化和肺损伤密切相关,并且呼吸系统疾病发生率与空气中的单位体积超细颗粒物的数目密切相关[11]。滞留在肺内的二氧化硅颗粒含量及时间与肺纤维化的病理分级之间呈相关性[12]。本研究结果显示,各暴露组随着时间延长,肺组织内的硅含量有下降趋势,但肺组织内的硅含量降低幅度较小,并且,其可能主要通过“血-支气管肺泡屏障”进入循环系统,再分布到其他组织器官。肝脏、肾脏以及脾脏是纳米二氧化硅颗粒再分布的主要器官,心脏和脑中的硅含量也有增加,但与对照组比较差异无统计学意义。因此,本研究推测吸入进入机体的纳米二氧化硅颗粒主要作用于机体的肝脏、肾脏以及脾脏,并且进入脏器的纳米颗粒,很难随着时间的推移而从该器官排除,从而更易引起组织器官的损伤。
肺泡灌洗液中的白细胞总数是炎症反应程度的一种指标[13,14]。本研究中,除0.5mg/Kg·bw 暴露组在暴露1和7天后肺泡灌洗液中的白细胞总数与对照组无显著差异之外,该剂量暴露14和28天以及1和2mg/Kg·bw暴露组在各个时间点的白细胞总数均显著高于对照组。肺泡灌洗液中的蛋白主要来自于血浆的渗出,正常肺组织的肺泡膜和肺毛细血管膜可以阻止白蛋白的通过。因此,肺泡灌洗液中的蛋白含量的升高反映了肺泡上皮-毛细血管屏障的损伤程度[15]。本研究结果显示蛋白含量的升高提示即使是在暴露后最长的时间点,肺泡灌洗液中的蛋白含量明显高于其对照组,表明肺组织仍存在一定程度的损伤性改变,并且,本研究结果还显示纳米二氧化硅颗粒暴露剂量越大,肺组织损伤越严重、修复所需时间越长。乳酸脱氢酶活性是一种反应颗粒暴露后引起动物肺脏细胞毒性损伤程度的标志物[16],本研究结果显示纳米二氧化硅颗粒暴露组肺泡灌洗液中的乳酸脱氢酶活性显著高于同时间点的对照组,并且,二氧化硅颗粒暴露剂量越大,肺组织细胞毒性反应程度越大。总之,本研究结果显示,气管暴露纳米二氧化硅颗粒后,大鼠肺泡灌洗液中的蛋白含量、乳酸脱氢酶值均升高,提示大鼠暴露纳米二氧化硅颗粒后可引起肺实质细胞损伤,血管通透性增加,对大鼠肺脏产生了一定的毒性作用,并且具有一定的剂量效应关系。
本研究对气管滴注纳米二氧化硅颗粒致大鼠肺脏损伤进行了初步探讨,分别检测主要脏器中的硅浓度变化,肺泡灌洗液中肺部炎症指标随时间的变化而改变情况,为纳米材料对肺损伤影响提供了一定的理论依据和线索,关于纳米二氧化硅颗粒对机体影响的具体机制还有待进一步的研究。
[1]张 婷,唐 萌.纳米颗粒吸入毒性研究进展 [J].卫生研究,2008,37(5):633.
[2]Oberdorster G,Fefin J,Lehnert BE.Correlation between particle size,in vivo particle persistence,and lung injury [J].Environ Health Perspect,1994,102(Suppl 5):173.
[3]Burns AA,Vier J,OW H,et al.Fluoreseeni Silica Nanoparticles with Emcient Urinary Excretion for Nanomedieine [J].Nano Lett,2009,9(1):442.
[4]Sayescm,Warheitdb.Charaeterization of nanomaterials for toxieity assessment[J].Nanomed Nano-bioteehnol,2009,1(6):660.
[5]Murdock RC,Braydich-stoll EL,Scharand AM,et al.Characterization of nanomateriald is persioninsolution priortoin vitro exposure using dynamic light scattering technique[J].Toxicol Sci,2008.101(2):239.
[6]Li Y,Sun L,Sun ZW,et al.Size-dependent cytotoxicity of amorphous silica nanoparticles in human hepatomaHepG2cells[J].Toxicology in Vitro,2011,25(7):1343.
[7]Oberdorster G,Oberdorster E,Oberdorster J,et al.Nanotoxicology:An emergingdiscipline evolving from studies of ultrafine particles[J].Environ Health Perspect,2005,113(7):823.
[8]Goman J.Taming high-tech partieles[J].Science News,2002,161(13):200.
[9]Shvedova AA,Kisin ER,Mercer R,et al.Unusnal inflammatory and fibrogenic pulmonary responses to single-walled carbon nanotubes in mice[J].Physieo lLung Cell Mol Pgysiol,2005,289(5):698.
[10]Hnizdo E,Vallyathan V.Chronic obstructive pulmonary disease due to occupational exposure to silica dust:a review of epidemiological and pathological evidence[J].VMJ,2003,60(4):237.
[11]Boschetto P,Quintavalle S,Miotto D,et al.Chronic obstructive pulmonary disease(COPD)and occupational exposures[J].J Occup Med Toxieol,2006,l(1):11.
[12]Nagelschmidt G.The relation between lung dust and lung pathology in pneumoconiosis[J].Br Med J,1960,247.
[13]Shvedova AA,Kisin E,Murray AR,et al.Inhalation vs.aspiration of single-walled carbon nanotubes in C57BL/6mice:inflammation,fibrosis,oxidative stress,and mutagenesis [J].Am J Physiol,2008,295:1.
[14]Warheit DB,Webb TR,Reed KL,et al.Pulmonary toxicity study in rats with three forms of ultrafine-TiO2particles:differential responses related to surface properties[J].Toxicology,2007,230:90.
[15]Muller J,Huaux F,Moreau N,et al.Respiratory toxicity of multi-wall carbon nanotubes[J].Toxicol Appl Pharm,2005,207:221.
[16]Chung YJ,Coates NH,Viana ME,et al.Dose-dependent allergic responses to an extract of Penicillium chrysogenum in BALB/c mice[J].Toxicology,2005,209(1):77.
