菹草(Potamogeton crispus L.)对酞酸酯污染沉积物的净化作用*
2013-05-28郝雪龙
迟 杰,郝雪龙
(天津大学环境科学与工程学院,天津 300072)
邻苯二甲酸酯(Phthalic Acid Esters,简称PAEs),别名酞酸酯,在化学工业中被普遍用做塑料的增塑剂和软化剂.研究表明,PAEs 具有致癌、致畸和致突变性,在生物体内会产生多种扰乱动物内分泌的生化效应[1].世界卫生组织已于1995年将PAEs 列为必须控制的能扰乱人体内分泌功能的化学物质;美国环保局和我国也将其列为优先控制污染物.我国水体中PAEs 污染相对严重,大部分水体沉积物中酞酸二丁酯(DBP)和酞酸二异辛酯(DEHP)的浓度已超过美国华盛顿州的警戒值[2].
植物修复是目前水体生物修复技术的一种,因其经济、对环境破坏性小等优点被人们广泛应用[3].沉水植物一方面能够通过茎叶富集降解水中有机污染物[4];另一方面由于根生底质,根系分泌的营养物质可以提高根际微生物的数量和降解活性,从而提高微生物对沉积物的修复作用[5].其中,微生物降解是沉积物中污染物的主要消减途径[6].磷脂是构成生物细胞膜的主要成分,不同种类微生物体内磷脂脂肪酸(PLFA)的组成及含量差异显著,可反映微生物的生物量及群落结构信息,已被广泛用于微生物生态研究[7].目前,有关沉水植物的研究主要集中在氮、磷元素的去除,鲜见对沉积物中有机污染物去除作用的报道.
菹草是春季浅水湖泊、河流和水库中占据主体的沉水植物,覆盖面积可达20% ~70%[8].本论文利用菹草作为受试植物,模拟海河水环境建立菹草微宇宙,研究菹草对沉积物中酞酸酯的去除作用,以及根际和非根际沉积物中微生物数量和群落结构的变化,分析去除作用机制.研究结果可为沉水植物根际污染物修复机理提供理论依据.
1 材料与方法
1.1 沉积物前处理与植株的获得
采集海河表层15 cm 的沉积物,于通风处自然阴干,压碎,过2 mm 筛.用丙酮溶解一定量的DBP 和DEHP,喷洒于1/6 的沉积物中.翻动沉积物使溶剂挥发,然后喷洒蒸馏水,使其含水量为60%,再经湿法灭菌后(每天1 次,连续3 d)置于25℃恒温培养箱中一个月,中间定期补充水分.取出染毒沉积物,摊开,快速风干后,与剩余5/6 未染毒沉积物混合并再次过2 mm 筛,备用.
从天津大学敬业湖采集菹草,组织培养繁殖后[9],放入经过曝气的自来水中备用.
1.2 微宇宙系统的建立和样品采集
为研究菹草对沉积物中DBP 和DEHP 去除作用,实验采用2 组微宇宙系统,即有草组和无草对照组.具体方法是:取30 cm×60 cm×40 cm 的玻璃水族箱2 个,底部铺约3 cm 厚已染毒的海河沉积物.采用根袋法[10]区分根际土与非根际土,根袋直径2 cm,2 个根袋间隔2.5 cm,一个水族箱放置21 个根袋,每个根袋栽种5 g 菹草.向每个缸中加入约20 L 经曝气的自来水,稳定2 d 开始计时.实验期间光照强度为2200 ±100 lx,光暗比为12 h∶12 h,温度为25 ±1℃.实验连续运行27 d.每隔一定时间采集水、沉积物(根际和非根际)和菹草的样品,并在实验结束时收集菹草根系,分析DBP 与DEHP 的浓度.取1、15 和27 d 的沉积物测定磷脂脂肪酸(PLFA)含量.
1.3 样品的制备和分析
1.3.1 酞酸酯的分析 水样:用虹吸法取水表面下10 cm 左右的水样10 ml,置于25 ml 具塞比色管中,加入1 ml 二氯甲烷,充分振摇10 min,静置分层,共萃取3 次,合并有机相后N2吹定容.
植物样:取植物的茎叶或根系部分,蒸馏水冲洗后吸干表面水分,称取1 g(鲜重),剪碎后放入组织研磨器,加5 ml 二氯甲烷,研磨5 min.移出植物匀浆至40 ml 离心管中,4000 转/min 离心10 min.吸取二氯甲烷层至K-D 浓缩器后N2吹定容.
沉积物样:取1 g 沉积物(冷冻干燥后过80 目筛)于10 ml 离心管中,加3 ml 二氯甲烷,超声萃取10 min,然后4000 转/min 离心5 min,重复3 次合并有机相,N2吹定容.
以上每个样品均做3 个平行,不同样品数据进行显著性差异分析.样品分析采用Agilent 6890 N 型气相色谱仪,配 FID 检测器;色谱柱为 HP-5 型石英毛细管柱(30.0 m×320 μm×0.25 μm);进样口 250℃,检测器250℃;N2流量25 ml/min,H2流量45 ml/min,空气流量450 ml/min;进样量1 μl;程序升温:130℃(1 min)→25℃/min→280℃(3 min).DBP 和 DEHP 的加标回收率分别为:水样100.5% 和93.2%;沉积物样品87.0%和78.8%;菹草样品95.6%和81.2%.
1.3.2 磷脂脂肪酸的分析 采用王爱丽[11]的方法提取分离1、15 和27 d 沉积物中的PLFAs.样品分析采用Agilent 6890 N 型气相色谱仪,5975 C 质谱检测器,HP-5 ms 5%石英毛细管柱(30.0 m×250 μm×0.25 μm).选用全扫描方式进行分析,升温程序:初始温度80℃,以30℃/min 升到150℃,再以3℃/min 升至230℃,保持1 min,再以10℃/min 升至280℃,保持2 min,总用时37 min.载气为He,流量1.0 ml/min,不分流进样,进样口温度为250℃,检测器温度为250℃,接口温度为280℃,四级杆为150℃,离子源为230℃,EI 源70 eV.
根据文献[7]将所有 PLFAs 之和作为总量;i15∶0、a15∶0、i16∶0、i17∶0、a17∶0 作为革兰氏阳性菌的标记PLFAs,其和作为革兰氏阳性菌的总量;cy17∶0、cy19∶0、16∶1ω7、16∶1ω9、18∶1ω7、18∶1ω9 作为革兰氏阴性菌的标记PLFAs,其和作为革兰氏阴性菌总量;革兰氏阳性菌、革兰氏阴性菌、15∶0、17∶0 作为细菌的标记PLFAs,其和作为细菌总的生物量;18∶2ω6,9 是真菌的标记 PLFAs.
根据所测得的PLFA 数据计算多样性指数(H),计算公式为:

式中,Pi为样品中某一种PLFA 的摩尔百分含量;S 为某一土壤样品中所有PLFA 种类的数目.不同样品的PLFA 数据使用SPSS(Statistics 20.0)进行聚类分析,聚类方法为Hierarchical cluster analysis,采用Betweengroups linkage 方法.
2 结果
2.1 酞酸酯在微宇宙中的浓度变化
系统运行过程中,水中DBP 浓度始终低于定量限(8 μg/L).DEHP 的浓度则由初始的65 μg/L和70 μg/L 逐渐降低,至第3 d 后低于定量限(8 μg/L),两个系统中 DEHP 浓度除第 3 d 外,均无显著差异.
菹草茎叶中DBP 和DEHP 的浓度在实验初始阶段含量变化不显著,第7 d 之后逐渐上升,系统运行结束时含量分别升高133%和68%.整个实验过程中,菹草体内DEHP 的浓度平均是DBP的6 倍左右.实验结束时测定了菹草根系DBP 和DEHP 浓度,分别为 73.9 和 75.9 mg/kg,约为茎叶含量的200 倍(图1).
对照土和非根际土中DBP 浓度变化趋势基本一致,11 d 后逐渐下降,结束时降解率为32.2% ~36.5%;根际土中DBP 浓度总体呈下降趋势,0 ~15 d 波动较大,最终降解率达50.0%.对照组沉积物和非根际沉积物中DEHP 浓度变化趋势总体一致,0 ~23 d 时无显著变化,始终在9.80 ~10.31 mg/kg 范围内波动,23 d 后浓度开始明显降低,实验结束时对照组沉积物和非根际沉积物中DEHP 降解率达10.3% ~11.4%;根际沉积物中 DEHP 在 0 ~23 d 于 7.26 ~8.95 mg/kg 范围内波动,23 d 后迅速下降,降解率达 80.9%(图 2).

图1 菹草中DBP 和DEHP 的浓度Fig.1 Concentrations of DBP and DEHP in Potamogeton crispus L.
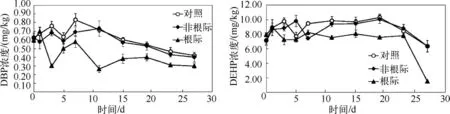
图2 沉积物中DBP 和DEHP 的浓度Fig.2 Concentrations of DBP and DEHP in sediment samples
2.2 沉积物中磷脂脂肪酸的含量和聚类分析结果
经测定,从沉积物中检出12 ~17 种PLFA,包括饱和脂肪酸、支链脂肪酸、单不饱和脂肪酸和多不饱和脂肪酸,未检测到环丙烷脂肪酸和带羟基的脂肪酸.偶数碳饱和脂肪酸的相对含量为18.3% ~47.3%,是沉积物中含量最丰富的脂肪酸种类,其次是单不饱和脂肪酸,相对含量为17.9% ~43.2%.其中,饱和脂肪酸16∶0和 18∶0、单不饱和脂肪酸 18∶1ω9 和 18∶1ω6、双不饱和脂肪酸 18∶2ω6,9 为优势脂肪酸.支链脂肪酸和奇数碳饱和脂肪酸的相对含量较低,在有些沉积物中未检出(图3).

图3 沉积物中的PLFAs 组成Fig.3 Composition of PLFAs in sediment samples
在对照、非根际和根际沉积物中微生物总量、细菌总量、真菌总量以及革兰氏阳性菌(G +)和革兰氏阴性菌(G-)的含量这五个指标总体上呈现出依次升高的趋势(27 d 时G +除外,非根际浓度高于根际),且随着系统运行时间的增长这3 种沉积物中微生物量均呈现不同程度的增加(表1).
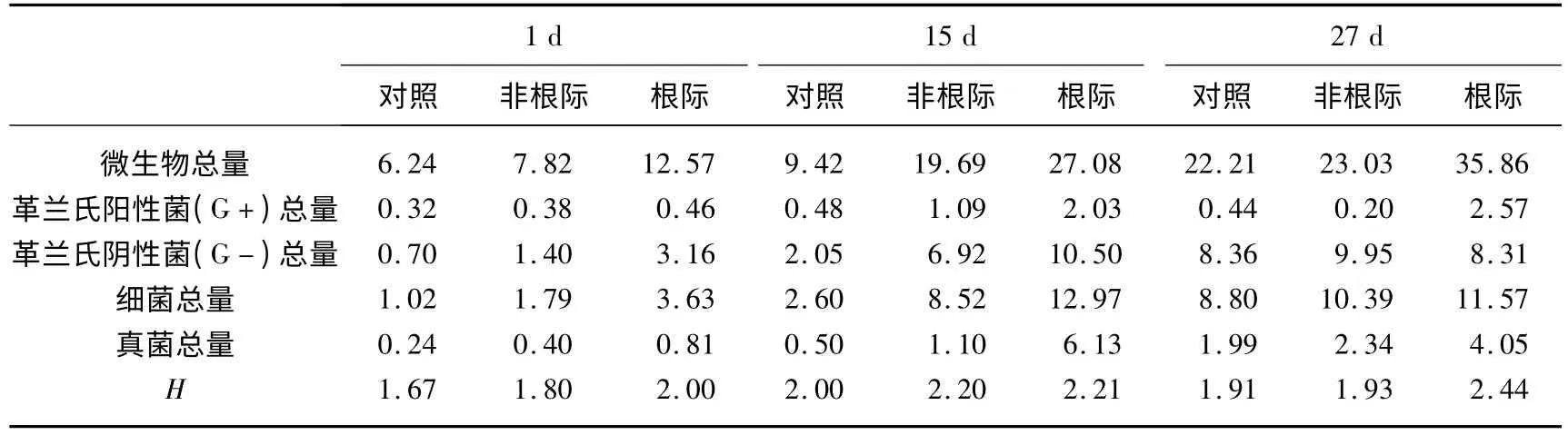
表1 沉积物中PLFAs 含量(nmol/g(DW))及多样性指数(H)Tab.1 Contents of PLFAs and biological divers ity index in sediment samples
将对照、非根际和根际沉积物中PLFA 进行聚类分析,结果表明可聚为4 类(图4):第1 d 的3 种沉积物(即对照、非根际和根际沉积物)和第15 d 的对照和非根际沉积物聚为一类;第27 d 对照和非根际沉积物为一类;第15 d 根际和第27 d 根际沉积物各单独为一类.
3 讨论
3.1 菹草对沉积物中微生物特征的影响
沉积物中微生物量在对照、非根际和根际沉积物中依次升高(表1),说明种植菹草能够显著提高沉积物中微生物的数量.影响根际微生物量的因素较复杂:根系分泌物可为根际微生物提供碳源和能源,使得根际沉积物中微生物量要高于非根际沉积物[5];根系分泌物对微生物具有趋化作用,使微生物在根际聚集[12].非根际沉积物中微生物含量略高于对照组,这可能是由于菹草的促淤作用增加了非根际沉积物中的营养物质,从而促进了微生物的生长[13].
菹草对沉积物中微生物的群落结构影响也很大.系统运行初期(第1 d),微生物群落结构差异不大;随着时间的增长,与非根际和对照沉积物相比,根际沉积物的微生物群落结构变化较大(图4),表明植物的生长对沉积物中微生物群落结构产生显著影响.这与陆生植物的研究结果一致[14].
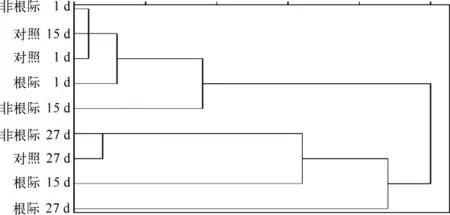
图4 沉积物中PLFA 数据聚类分析Fig.4 Cluster analysis of PLFA data from sediment samples
根据PLFA 数据计算微生物群落的多样性指数发现,实验过程中根际沉积物的生物多样性高于非根际和对照组沉积物(表1),表明根系分泌物不仅影响根际微生物的数量而且影响微生物群落的多样性.
3.2 菹草对沉积物中酞酸酯消减作用的影响
系统运行期间水体中DBP 和DEHP 浓度始终很低;菹草体内这2 种PAEs 浓度第7 d 后逐渐升高,说明菹草可以从沉积物中富集这2 种污染物.通过计算,系统运行结束时菹草对DBP 和DEHP 的富集量约增加0.15 和0.28 mg,不足沉积物中这2 种PAEs 去除量的1/8.可见,虽然菹草可以对污染物起一定的富集作用,但微生物的降解起主要作用.
系统运行初期,根际、非根际和对照沉积物中这2 种PAEs 的浓度总体上差异并不显著,此时微生物数量相对较少,群落结构也较相似.这主要是系统运行初期,沉积物中微生物需要一个增殖的过程,根际作用尚不显著,因此使得沉积物中污染物浓度差异不大.系统运行中后期,根际沉积物中2 种PAEs 浓度始终低于对照组和非根际沉积物,此时不仅根际沉积物中微生物量高于其他两组,且微生物群落结构也发生了明显变化.这是由于菹草根系分泌物为微生物提供了大量的碳源和营养物质,促进了根际微生物的生长[5],同时改变了微生物的群落结构[14],形成的根际环境有效提高了PAEs 的降解速率.
沉积物中DBP 的浓度始终低于DEHP,并且在实验过程中始终呈下降趋势.据报道[15],PAEs 的生物降解性由化合物分子大小决定,而这类化合物分子的大小由支链组成决定.与DEHP 相比,DBP 支链小,化合物空间位阻小,因此易于被微生物利用.DEHP 则在系统运行23 d 前浓度变化不显著,其原因可能是一方面DEHP 分子量大,较难降解,另一方面DEHP 的浓度较高,抑制了微生物的降解作用[16].23 d 后DEHP 浓度才开始明显下降,尤其是根际沉积物中DEHP 的浓度在第27 d 迅速下降,而此时根际微生物群落结构变化也较大,与DEHP 的去除数据相吻合,说明微生物群落结构是影响这类污染物降解的重要因素.
4 结论
1)PLFA 结果表明沉积物中微生物量和多样性指数在根际、非根际和对照沉积物中依次降低.利用PLFAs数据进行聚类,分析沉积物中微生物群落结构,表明实验中后期根际沉积物中微生物群落结构发生显著变化.
2)实验过程中水中DBP 和DEHP 浓度始终较低.菹草能够富集沉积物中这2 种PAEs,但沉积物中这类物质的降解主要依靠微生物的作用.根际沉积物中这2 种PAEs 的浓度始终低于对照组和非根际沉积物,与PLFA 的结果相吻合.计算得出,根际沉积物中DBP 和DEHP 的降解率分别为50.0%和80.9%,均高于对照组和非根际沉积物(DBP:32.2% ~36.5%;DEHP:10.3% ~11.4%).
菹草扎根于沉积物,能够通过根际作用促进根际微生物生长,改变微生物群落结构,进而提高对这2 种PAEs 的降解能力.污染物在根际环境中的降解是一个复杂的过程,根系分泌物是产生根际效应的关键因素,今后应加强这方面的研究,为利用沉水植物修复受PAEs 污染沉积物提供科学依据.
[1]Cao XL.Phthalate estersin foods:sources,occurrence,and analytical methods.Comprehensive Reviews in Food Science and Food Safety,2010,9:21-43.
[2]崔学慧,李炳华,陈鸿汉等.中国土壤与沉积物中邻苯二甲酸酯污染水平及其吸附研究进展.生态环境学报,2010,19(2):472-479.
[3]Louisa WP.In situ and bioremediation of organic pollutants in aquatic sediments.Journal of Hazardous Materials,2010,177:81-89.
[4]Chi J.Phthalate acid esters in Potamogeton crispus L.from Haihe River,China.Chemosphere,2009,77(1):48-52.
[5]Fan SX,Li PJ,Gong ZQ et al.Promotion of pyrene degradation in rhizosphere of alfalfa (Medicago sativa L.).Chemosphere,2008,71(8):1593-1598.
[6]Mallavarapu M,Balasubramanian R,Kadiyala V et al.Bioremediation approaches for organic pollutants:A critical perspective.Environment International,2011,37:1362-1375.
[7]Xue D,Yao HY,Ge DY et al.Soil microbial community structure in diverse land use system:A comparative study using Biolog,DGGE,and PLFA analyses.Pedosphere,2008,18(5):653-663.
[8]杨文斌,王国祥.南京玄武湖菹草种群的效应.湖泊科学,2007,19(5):572-576.
[9]Zhou CF,An SQ,Jiang JH et al.An in vitro propagation protocol of two submerged macrophytes for lake revegetation in east China.Aquatic Botany,2006,85(1):44-52.
[10]弋良朋,张 辉.滨海4 种盐生植物根际土壤酶活性特征与主要养分的关系.生态环境学报,2011,20(2):270-275.
[11]王爱丽.酞酸酯在湿地植物根际环境中的消减行为[学位论文].天津:天津大学,2011.
[12]贾 永,宋福强.丛枝菌根(AM)对根瘤菌趋化作用研究.微生物学通报,2008,35(5):743-747.
[13]Barko JW,Gunnison D,Carpenter SR.Sediment interactions with submersed macrophyte growth and community dynamics.Aquatic Botany,1991,41(1/2/3):41-65.
[14]夏北城.植被对土壤微生物群落结构的影响.应用生态学报,1998,9(3):296-300.
[15]Xu G,Li FS,Wang QH.Occurrence and degradation characteristics of dibutyl phthalate (DBP)and di-(2-ethylhexyl)phthalate (DEHP)in typical agricultural soils of China.Science of the Total Environment,2008,393(2/3):333-340.
[16]Liang DW,Zhang T,Fang HHP et al.Phthalates biodegradation in the environment.Applied Microbiology and Biotechnology,2008,80(2):183-198.
