尼妥珠单抗联合术后同步放化疗治疗华人恶性胶质瘤的Ⅰ期临床试验*
2013-05-25李文斌赵艳杰陈怡东邱晓光
李文斌 陈 静 赵艳杰 康 勋 陈怡东 邱晓光
脑胶质瘤是颅内最常见的恶性肿瘤,约占颅内肿瘤的35%~61%[1]。目前,恶性胶质瘤的治疗策略是以手术、放疗和化疗结合的综合治疗。由于恶性胶质瘤呈广泛侵袭性生长,与周围正常脑组织无明显分界,加上脑组织具有重要功能,很难真正完全切除肿瘤。恶性胶质瘤对放化疗存在抵抗[2],术后复发率高并常以同级别或更高级别复发[3],很难获得良好疗效。即使采用目前的标准治疗Stupp方案同步放化疗,胶质母细胞瘤的中位生存期仅为14.6个月[4]。因此,寻求和探索新的治疗方法来进一步提高疗效,显得尤为迫切。
原癌基因表皮生长因子受体(EGFR)通常在上皮源性肿瘤中过度表达。这一事件被认为是肿瘤形成和发展的原因,且与不良预后有关。因此EGFR靶向药物的研究越来越引起人们的兴趣。尼妥珠单抗(nimotuzumab,泰欣生)是一个新的人源化单克隆抗体,它和EGFR的胞外区紧密结合,强烈抑制EGFR依赖型细胞的转化。在过度表达EGFR的肿瘤中通过其抗肿瘤增殖、抗血管生成和促细胞凋亡活性的多种作用,从而发挥其抗肿瘤作用。大量研究表明,EGFR在50%~63%的神经胶质瘤中有不同程度的表达[5]。且大多数高级别星型细胞瘤,存在表皮生长因子受体的过表达[6]。目前在一些国家进行了尼妥珠单抗治疗胶质瘤的Ⅰ/Ⅱ期临床试验,近期疗效较好,且毒性较小,显示了良好的前景[7-8]。而在国内相关的研究仍很少。本研究为尼妥珠单抗联合术后同步放化疗治疗华人恶性脑胶质瘤的Ⅰ期临床研究,探讨该方案的毒性和耐受剂量,并为后期临床研究给药方案提供参考。
1 材料与方法
1.1 材料
1.1.1 患者入组标准 1)经病理学确认的幕上原发恶性胶质瘤,包括胶质母细胞瘤、间变性星形细胞瘤、间变性少枝星形细胞瘤。2)年龄18~75岁,性别不限。3)签署知情同意书。4)至少有1个可测量的病灶,普通CT或MRI扫描≥20 mm,螺旋CT扫描直径≥10 mm者。5)有生育能力的男性或女性在试验中愿意采取避孕措施。6)足够的骨髓功能储备:白细胞计数≥3 000/μL,绝对中性粒计数≥2 000/μL,血小板计数≥120 000/μL;无心、肺、肝、肾功能异常和免疫缺陷。7)体力状况评分ECOG 0~2分。8)预测生存期>6个月。
1.1.2 患者排除标准 1)试验前1个月内接受过放射治疗、化学治疗或抗肿瘤生物治疗。2)试验前3个月内接受免疫治疗的患者。3)试验前3个月内参加过其它临床试验的患者。4)严重的过敏史或过敏体质的患者。5)妊娠、哺乳期或有生育能力但未采取避孕措施者。6)有其它严重的内科疾患或严重不可控制的感染。7)吸毒、药物滥用、长期嗜酒以及艾滋病患者。8)有不可控制的癫痫发作、或因精神病丧失自制力者。
1.2 方法
1.2.1 放疗方案 手术后2~4周开始放疗,每周5天,共6周;总剂量60 Gy/30~33次 ,1.8~2 Gy/d。放疗定位:采用热塑面罩固定,模拟CT下做体表标记,按3 mm层厚行CT扫描,扫描层面为头顶至下颌骨下缘,完成后将CT图像传输至治疗计划系统(TPS)。靶区勾画:参考手术前后MRI图像并CT模拟定位,在TPS接受的CT图像上确定靶区如下:大体肿瘤体积(GTV):MRI增强病灶;临床靶体积(CTV):GTV+2.5 cm;计划靶体积(PTV):CTV+0.5 cm。照射方法:采用6 MV的X线3~6个共面或非共面固定适形野等中心照射,同时使用楔形板调整剂量分布。95%的处方剂量包括靶区,靶区内的剂量分布均匀,在处方剂量的±5%以内。在放疗中根据病情间断性使用20%甘露醇,地塞米松降颅压处理,口服抗癫痫药物预防或控制癫痫发作。
1.2.2 化疗方案 采用替莫唑胺(temozolomide,TMZ)同步放疗。用法用量:TMZ口服,75 mg/m2/日,从放疗第1天开始至最后1天结束全程服用。放疗前空腹服用,服药前加用止吐药。
1.2.3 尼妥珠单抗(泰欣生)用法用量 尼妥珠单抗加入250 mL生理盐水静脉滴注,滴注时间不少于60 min,在放疗期间给予,每次给药均在放化疗治疗前输注完成。每周1次,共6次(图1)。剂量组分别为100、200和400 mg/周,拟3~6例/组。从低剂量组开始进行试验,每个剂量组先采用3例入组。如某一剂量组有1例出现3级以上不良反应,则该剂量水平增加3例受试者,如不再出现,可进入下一剂量组,如仍出现,即停止剂量爬坡。只有当特定剂量水平获得足够评价资料后方可进入下一个剂量水平。具体用药时间及放化疗治疗规程见图1所示。
1.2.4 观察项目 用药前1~2周完成有关检查,作为治疗前基础资料,治疗期间复查。观察项目包括生命征、常规体检(尤其神经功能检查)、三大常规、肝肾功能、胸部X线摄片、B型超声、头颅MRI。用药期间详细记录不良反应出现时间和程度等。考虑试验药物的不良反应可能延迟发生,观察时间为用药期间及用药后3周。
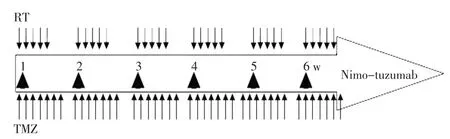
图1 尼妥珠单抗联合同步放化疗治疗方案给药时间Figure 1 Administration time of nimotuzumab combined with radioche⁃motherapy
1.2.5 评价标准 安全性评价:根据NCI CTCAE 3.0版不良事件常用术语标准分级系统推荐的分级方法,对不良事件的强度进行分级。肿瘤疗效评价:按RECIST标准分为完全缓解(CR)、部分缓解(PR)、无变化(SD与治疗开始以来所记录的最小长径之和相比,既不符合疾病进展又不符合部分缓解的评判标准)和进展(PD)。
2 结果
2.1 临床资料
2011年4月至2012年8月首都医科大学附属北京世纪坛医院收治的恶性脑胶质瘤受试患者共9例入组,其中男性6例,女性3例。年龄34~68岁,平均年龄48.56岁。入组者均为行近全切除手术后经病理学确认的WHOⅢ~Ⅳ脑胶质瘤患者,其中Ⅲ级胶质瘤7例,Ⅳ级2例,具体特征见表1。
2.2 耐受量
尼妥珠单抗从100 mg/周开始,1次/周,连用6周,100 mg/周剂量组、200 mg/周剂量组及400 mg/周剂量组中受试者均未出现3级以上不良反应,患者耐受良好。当尼妥珠单抗剂量达400 mg/周时亦未出现MTD maximal tolerance dose。国外文献报道,尼妥珠单抗应用于实体瘤的实验中当其剂量达800 mg时仍未出现MTD[9]。
2.3 不良反应
不良反应主要是Ⅰ~Ⅱ度骨髓抑制,包括白细胞减少(7例)、中性粒细胞减少(1例)和血小板减少(1例)。另有恶心(1例)、皮疹(1例)、尿潜血(3例)和无症状的转氨酶升高(2例)。经过对症治疗后均可减轻或消失,无3级以上不良反应的发生。用药期间观察生命征良好,体温、呼吸、脉搏、血压均无明显异常。尼妥珠单抗输注时无发热、心悸、血压升高、胃肠道出血等不良事件发生。具体不良事件发生及分级见表2。
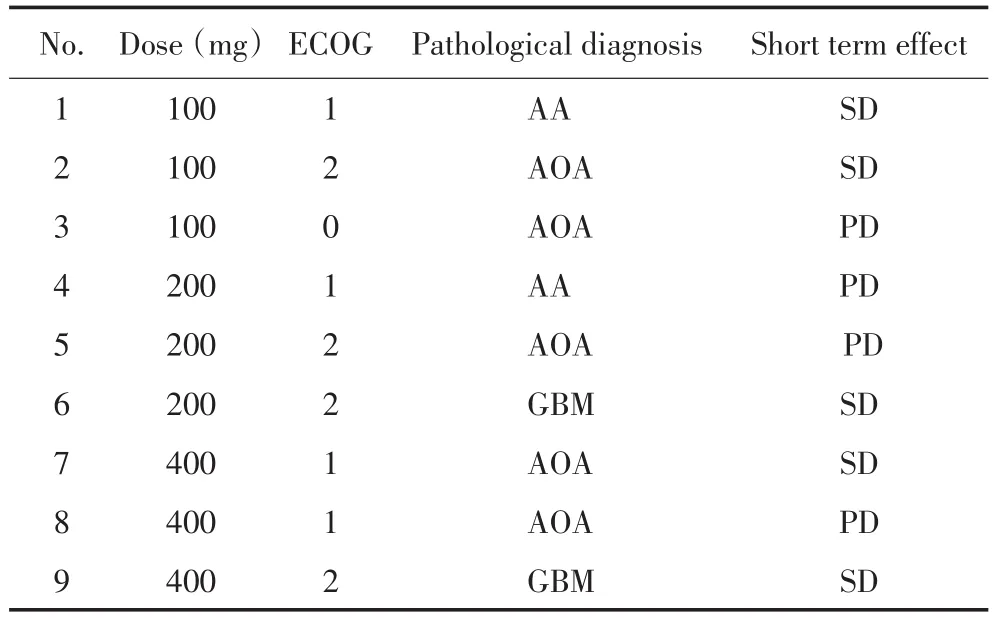
表1 患者情况Table 1 Patient characteristics
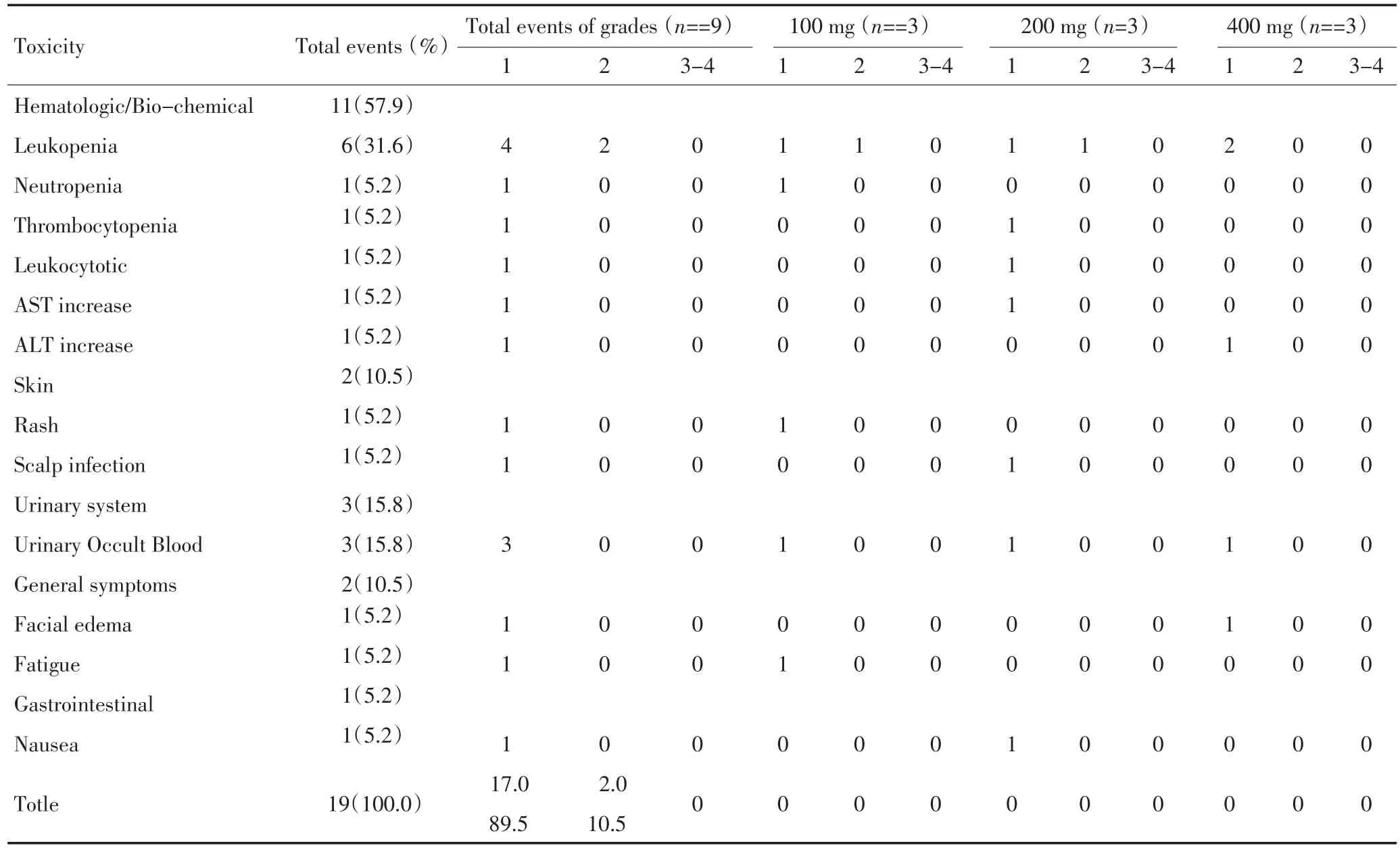
表2 治疗期间主要不良事件分级(CTCAE3.0分级)Table 2 Adverse events during treatment(grade of CTCAE 3.0)
2.4 近期疗效
在完成治疗方案后3个月所有患者接受头颅MRI平扫加增强检查。100 mg组:SD 2例,PD 1例;200 mg组:SD 1例,PD 2例;400 mg组:SD 2例,PD 1例。由于本试验为Ⅰ期临床试验,主要目的为观察药物毒性及耐受剂量,故要进行临床疗效等方面的研究应更进一步的行Ⅱ、Ⅲ期临床试加以验证。但已有研究明确显示尼妥珠单抗联合放、化疗对恶性胶质瘤有一定的临床获益。
3 讨论
EGFR抑制剂联合放化疗治疗上皮源性肿瘤是目前肿瘤治疗领域的热点。有学者研究发现在高分级胶质瘤(60%GBM,20%AA)中EGFR突变(特别是EGFRⅧ突变)频率较高[10]。而在国内外该类靶向药物治疗恶性胶质瘤的相关报道还比较少。尼妥珠单抗作为IgG1型人源化的EGFR单克隆抗体,能够特异性地阻断由EGFR介导的下游信号传导通路。通过配体介导的EGFR的活化使RAS-RAF-MEK-ERK和PI3K-AKT-mTor信号通路激活。尼妥珠单抗结合EGFR从而阻止其与配体结合后激活信号通路[9]。
在实验研究中,有学者发现尼妥珠单抗已经在能提高非小细胞肺癌细胞株的放射敏感性中显示出放疗敏感性[11]。而有些Ⅰ、Ⅱ期的临床试验已经初步证实尼妥珠单抗在治疗头颈部肿瘤时联合放、化疗治疗头颈部肿瘤对总体生存率和无进展生存时间提升的安全性和意义,且安全性很好[12-13]。在未行手术切除的头颈部肿瘤中,Crombet等[14]研究发现,尼妥珠单抗200 mg联合同步放化疗对于肿瘤缓解和提高生存期是合适的。而本试验前也初步确定400 mg/周为本实验的最高剂量。
You等[9]研究的尼妥珠单抗应用于实体瘤的Ⅰ期临床试验表明,尼妥珠单抗从100 mg开始应用,可被安全应用到最高剂量800 mg。其报道的1~2级不良反应多见为:疲乏(56%),皮肤干燥(31%),贫血(31%),畏寒(19%),恶心(19%),呕吐(19%),淋巴细胞减少(19%),低钠血症(19%),低蛋白血症(19%)和痤疮样皮疹(19%)。在另一临床试验中,尼妥珠单抗单独应用到最高剂量400mg/周也是安全的,没有发生3级毒性事件。这两个剂量递增试验显示,尼妥珠单抗至少400 mg/周单独应用是安全的,并未发现和药物相关的明显不良反应[9,15]。
由于多数文献缺乏华人应用尼妥珠单抗的药物毒性的报道,故本研究初次探讨了尼妥珠单抗标准同步放化疗治疗华人恶性胶质瘤的不良反应和安全剂量。结果证实最高剂量为400 mg/周的尼妥珠单抗联合同步放化疗是安全的。据表2可见,试验中9例患者出现的不良反应均为1~2级,并未出现3级及以上不良反应。全剂量组0例发生3级及以上不良事件,其中血液/骨髓系统不良事件11例次(57.9%);皮肤系统2例次(10.5%);泌尿系统3例次(15.8%);全身症状2例次(10.5%);胃肠道1例次(5.2%)。本试验中只有一例患者出现皮疹,且为1级反应。一些头颈部的临床试验中证实,尼妥珠单抗的皮肤毒性比其它抗EGFR单抗要低[12,16]。另有文献报道增加尼妥珠单抗治疗并不增加放疗相关不良反应[17-18]。尼妥珠单抗联合同步放化疗期间观察到的毒性反应对比于单纯同步放化疗无显著意义。U87MG(ATCC HTB-14,Rockville,MD,USA)人类胶质母细胞瘤细胞系试验研究中,尼妥珠单抗可增加人类U87MG肿瘤细胞系的放疗敏感性,从而增强放疗效应[19]。国外小规模的临床研究亦有研究显示,尼妥珠单抗单药或联合放、化疗对恶性胶质瘤患者有一定的临床获益[20-21]。
综上所述,尼妥珠单抗400 mg/周联合同步放化疗是患者可耐受且较为安全的。尼妥珠单抗的MTD在本实验中尚未出现。本研究可更进一步的进行Ⅱ、Ⅲ期临床试验来验证尼妥珠单抗联合标准治疗方案对华人恶性脑胶质瘤的临床获益。
1 Hargrave DR,Zacharoulis S.Pediatric CNS tumors:current treat⁃ment and future directions[J].Expert Rev Neurother,2007,7(8):1029-1042.
2 Sarissky M,Lavicka J,Kocanova S,et al.Diazepam enhances hy⁃pericin-induced photocytotoxicity and apoptosis in human glioblas⁃toma cells[J].Neoplasma,2005,52(4):352-359.
3 Hulsebos TJ,Troost D,Leenstra S.Molecular-genetic characterisa⁃tion of gliomas that recur as same grade or higher grade tumours[J].J Neurol Neurosurg Psychiatry,2004,75(5):723-726.
4 Stupp R,Hegi ME,Mason WP,et al.Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomised phaseⅢstudy 5-year analysis of the EORT C-NCIC trial[J].Lancet Oncol,2009,10(5):459-466.
5 Herbst RS,Shin DM.Monoclonal antibodies to target epidermal growth factor receptor-positive tumors:a new paradigm for cancer therapy[J].Cancer,2002,94(5):1593-1611.
6 Nishikawa R,Sugiyama T,Narita Y,et al.Immunohistochemical analysis of the mutant epidermal growth factor,detla EGFR,in glio⁃blastoma[J].Brain tumor pathol,2004,21(2):53-56.
7 Casacó A,López G,García I,et al.Phase I single-dose study of in⁃tracavitary-administered Nimotuzumab labeled with 188 Re in adult recurrent high grade glioma[J].Cancer Biol Ther,2008,7(3):333-339.
8 Ramos TC,Figueredo J,Catala M,et al.Treatment of high-grade glioma patients with the humanized anti-epidermal growth factor receptor(EGFR)antibody h-R3:report from a phaseⅠ/Ⅱtrial[J].Cancer biol ther,2006,5(4):375-379.
9 You B,Brade A,Magalhaes JM,et al.A dose-escalation phase I tri⁃al of nimotuzumab,an antibody against the epidermal growth fac⁃tor receptor,in patients with advanced solid malignancies[J].Invest New Drugs,2011,29(5):996-1003.
10 Bode U,Massimino M,Bach F,et al.Nimotuzumab treatment of malignant gliomas[J].Expert opin Biol Ther,2012,12(12):1649-1659.
11 Akashi Y,Okamoto I,Iwasa T,et al.Enhancement of the antitumor activity of ionising radiation by nimotuzumab,a humanised mono⁃clonal antibody to the epidermal growth factor receptor,in non-small cell lung cancer cell lines of differing epidermal growth factor receptor status[J].Br J Cancer,2008,98(4):749-755.
12 Cooper JS,Guo MD,Herskovic A,et al.Chemoradiotherapy of locally advanced esophageal cancer[J].JAMA,1999,281(17):1623-1627.
13 Minsky BD,Pajak TF,Ginsberg RJ,et al.INT 0123(Radiation Therapy Oncology Group 94-05)phaseⅢ trial of combined-mo⁃dality therapy for esophageal cancer:high-dose versus standard-dose radiation therapy[J].J Clin Oncol,2002,20(5):1167-1174.
14 Crombet T,Osorio M,Cruz T,et al.Use of the humanized an⁃ti-epidermal growth factor receptor monoclonal antibody h-R3 in combination with radiotherapy in the treatment of locally advanced head and neck cancer patients[J].J Clin Oncol,2004,22(9):1646-1654.
15 Crombet T,Torres L,Neninger E,et al.Pharmacological evalua⁃tion of humanized anti-epidermal growth factor receptor,monoclo⁃nal antibody h-R3,in patients with advanced epithelial-derived cancer[J].J Immu nother,2003,26(2):139-148.
16 Dragovich T,Campen C.Anti-EGFR-targeted therapy for esophageal and gastric cancers:an evolving concept[J].J Oncol,2009:804108.
17 Ramos TC,Figueredo J,Catala M,et al.Treatment of high-grade glioma patients with the humanized anti-epidermal growth factor receptor(EGFR)antibody h-R3:report from a phaseⅠ/Ⅱ trial[J].Canc Biol Ther,2006,5(4):375-379.
18 Lam C,Bouffet E,Bartels U.Nimotuzumab in pediatric glioma[J].Future Oncol,2009,5(9):1349-1361.
19 Miqueli AD,Rolff J,Lemm M,et al.Radiosensitisation of U87MG brain tumours by anti-epidermal growth factor receptor monoclo⁃nal antibodies[J].Br J Cancer,2009,100(6):950-958.
20 Harari PM.Epidermal growth factor receptor inhibition strategies in oncology[J].Endocr Relat Cancer,2004,11(4):689-708.
21 Minsky BD,Pajak TF,Ginsberg RJ,et al.INT 0123(Radiation Therapy Oncology Group 94-05)phaseⅢtrial of combined-modality therapy for esophageal cancer:high-dose versus standard-dose ra⁃diation therapy[J].J Clin Oncol,2002,20(5):1167-1174.
