骨桥蛋白在体重不一致性双胎胎盘中的表达
2013-05-25李满超何志明周祎石晓梅柴涵静方群
李满超何志明周祎石晓梅柴涵静方群*
(1.中山大学附属第六医院生殖医学中心,广东广州 510655;
2.中山大学附属第一医院妇产科胎儿医学中心,广东广州 510080)
骨桥蛋白在体重不一致性双胎胎盘中的表达
李满超1何志明2周祎2石晓梅2柴涵静2方群2*
(1.中山大学附属第六医院生殖医学中心,广东广州 510655;
2.中山大学附属第一医院妇产科胎儿医学中心,广东广州 510080)
目的探讨骨桥蛋白在体重不一致性双胎胎盘中的表达变化。方法用W estern blotting及实时荧光定量PCR检测双胎盘胎盘中的骨桥蛋白的表达。结果体重不一致DCDA双胎的小胎与大胎胎盘比较,Western blotting结果显示,体重不一致DCDA双胎的小胎与大胎胎盘比较,胎盘中蛋白表达明显减少(0.31±0.09 VS 0.62±0.08,t=-4.182,P=0.001),体重一致DCDA双胎胎盘间OPN蛋白表达无明显差异(0.62±0.16 VS 0.68±0.13,t=-1.687,P=0.724);实时荧光定量PCR结果显示,体重不一致DCDA双胎的小胎与大胎胎盘比较,胎盘中OPnm RNA表达明显减少(0.61±0.28 V S 1.01±0.12,t=3.087,P=0.014),体重一致DCDA双胎胎盘间OPnm RNA表达无明显差异(0.98± 0.18 V S 1.02±0.11,t=1.884,P=0.464)。Western blotting显示体重不一致MCDA的小胎与大胎比较,OPN蛋白表达显著下降,(0.24±0.06 VS 0.73±0.18,t=5.687,P<0.001),体重一致MCDA双胎胎盘间OPN蛋白表达无明显差异(0.48±0.12 VS 0.42±0.15,t=-1.687,P=0.586);实时荧光定量PCR结果显示,体重不一致MCDA的小胎与大胎胎盘比较,OPnm RNA表达显著下降,(0.46± 0.16 VS 1.01±0.09,t=5.128,P<0.001),生长一致MCDA双胎胎盘间OPnm RNA表达无明显差异(0.89±0.15 VS 0.95±0.22,t=0.697,P=0.564)。结论体重不一致性双胎胎盘中的骨桥蛋白表达有显著生差异,小胎胎盘骨桥蛋白的表达量明显减少。
双胎;骨桥蛋白;生长不一致;胎盘份额
随着辅助生殖技术的发展,双胎妊娠的发生率逐年升高。双胎妊娠按绒毛膜性质分为单绒毛膜(monochorionic dia mniotic,MCDA)双胎和双绒毛膜(dichorionic dia mniotic,DCDA)双胎,大多数DCDA双胎各自的胎盘独立,可以直接判断各自胎盘的大小;MCDA双胎共用一个胎盘,两胎胎盘间普遍存在着血管吻合,通过2个胎儿脐带发出的动静脉分支判断各自所占的胎盘份额,MCDA和DCDA双胎妊娠都可并发双胎体重不一致。双胎妊娠的母体环境及宫内环境相似,但双胎的表型可以不同,其中双胎的出生体重差值超过20%被定义为双胎体重不一致(discordanTTwin),双胎体重不一致极有可能是各自胎盘功能差异所致。利用双胎胎盘间互相对照进行研究,可以最大限度地控制母体因素、遗传因素及环境因素对胎儿发育的影响,单胎妊娠合并FGR受到母体、胎儿、胎盘因素这些因素的共同影响,仅部分单胎妊娠FGR是由胎盘功能障碍导致的。因此双胎妊娠是研究胎盘发育的天然对照模型,有利于探索胎盘发育差异对胎儿体重的影响。体重不一致双胎在临床产科很常见,一般随着双胎间体重差异增加,围生期死亡率也相应增加。体重不一致双胎的病因学,尤其是胎盘发育大小与双胎出生体重的关系是目前双胎研究的热点[1,2]。
骨桥蛋白(osteopontin,OPN)参与体内多种生理活动,OPN及其受体整合素β3是子宫、胎盘微环境的重要组成部分。近年研究显示OPN在胚胎植入、着床过程中发挥重作用,OPN通过RGD序列与整合素β3相互识别并结合,从而促进胚泡和子宫内膜细胞间的相互作用;定位在合体滋养层和细胞滋养层的整合素β3和OPN,可以促进细胞间的黏附、诱导细胞趋化使滋养层迁徙,从而调节早期妊娠时胚胎的着床和胎盘形成[3]。OPN在人类胎盘也是主要表达于具有侵袭能力的绒毛外滋养细胞[4,5],孕酮可以上调滋养细胞中OPN的表达[6]。说明OPN对胚胎植入过程中伴随的胎盘形成可能起一定作用。因此本文拟研究骨桥蛋白在双胎胎盘中的表达。
1 资料与方法
1.1 双胎妊娠胎盘组织收集
1.1.1 双胎胎盘组织基本资料 收集双胎妊娠胎盘组织共46例,分娩孕周29.2~38.6周,平均36.4周,孕妇年龄23~38岁,平均29.6岁。胎盘娩出后在脐带附着点对应的母体面剪取胎盘组织,在预冷的磷酸盐缓冲液中漂洗3次,去除血液。一部分组织在液氮中保存2~24小时后,转移至-80℃冰箱保存。采集胎盘组织前先检查两胎盘间胎膜分层情况,MCDA胎盘间羊膜分2层,DCDA胎盘间胎膜分4层,包括2层绒毛膜和2层绒毛膜,如果DCDA胎盘间绒毛膜融合,胎膜分为3层,包括2层羊膜和1层绒毛膜。MCDA双胎22例,分娩孕周32.6~38.5周,平均35.4周,孕妇年龄21~42岁,平均31.4岁,其中体重不一致MCDA双胎12例,分娩孕周29.2~34.1周,平均29.5周,孕妇年龄21~42岁,平均29.1岁;体重一致MCDA双胎10例,分娩孕周33.2~38.6周,平均35.5周,孕妇年龄26~37岁,平均29.8岁。DCDA双胎24例,分娩孕周32.6~38.5周,平均35.4周,孕妇年龄24~37岁,平均29.5岁,其中体重不一致DCDA双胎10例,分娩孕周32.3~37.1周,平均36.1周,孕妇年龄24~34岁,平均29.4岁;体重一致DCDA双胎14例,分娩孕周30.6~38.6周,平均37.2周,孕妇年龄25~37岁,平均29.6岁。
1.1.2 绒毛膜性质诊断标准 单绒毛膜:妊娠5~7周超声波示1个孕囊,妊娠11~13+6周超声波检查两胎间胎膜呈“T”征;双绒毛膜:妊娠5~7周超声波示2个孕囊,妊娠11~13+6周超声波检查两胎间胎膜呈“λ”征。
1.1.3 双胎体重不一致诊断标准 双胎出生体重差≥20%。
1.2 Western Blotting检测胎盘组织OPN蛋白表达
1.2.1 胎盘组织总蛋白提取 在每1 ml冷Lysis Buffer加入10μl磷酸酶抑制剂、1μl蛋白酶抑制剂和5μl 100 mm P M SF,混匀。冰上保存数分钟待用。取每份胎盘标本约100 mg,组织块放入预冷的研钵中进行研磨,边研边加液氮,至组织块研磨成粉沫状,加入1 ml冷Lysis Buffer,玻璃匀浆器在低温环境中上下手动匀浆,使组织进一步研碎。取组织匀浆液转移至1.5ml预冷的离心管,4℃、10 000 rpm离心5分钟。取上清转移至新的预冷管,蛋白定量采用BCA法。分装保存于-80℃环境,避免反复冻融。
1.2.2 SDS-PAGE电泳、转膜、印迹反应 12%浓缩胶时将电压调至80~90 V,到5%分离胶以后电压调至100~120 V,待溴酚蓝迁移到分离胶底部,终止电泳。转膜:100 V转移90分钟。免疫印迹反应:电转后取出P V D F膜,用T BS将膜从下向上浸湿后移至含封闭液的平皿中,室温下脱色摇床摇动封闭2 h;孵育一抗:以T BS T将兔抗人OPN多克隆一抗、G A P D H多克隆一抗分别以1∶1000稀释,4℃摇床孵育过夜;孵育二抗:以T BS T洗膜3次,每次10分钟,按1∶2000稀释辣根过氧化物酶标记的羊抗兔二抗。室温摇床孵育1小时,用T BS T在温室下摇床上清洗2次,再用T BS清洗1次后进行化学发光反应。化学发光:T BS T洗膜后,按说明书加发光剂,将膜蛋白面朝下与发光剂充分接触后,反应1分钟,去尽残液后置于X光片夹中,于暗室中放置X胶片,曝光1分钟,显影定影各1分钟。将胶片进行扫描或拍照,用凝胶图像处理系统分析光密度值。
1.3 实时荧光定量PCR反应检测胎盘组织m RN A表达
1.3.1 RNA提取和纯度鉴定 组织研磨、匀浆:组织块放入预冷的研钵中进行研磨,边研边加液氮,不要使液氮挥发干,至组织块研磨成粉沫状。每个研钵中加入Trizol 2 ml,转移Trizol至玻璃匀浆器,进一步匀浆5分钟,再转移至1.5 ml E P管,室温下放置5分钟。加入氯仿,0.2 ml/管,用力振摇15秒。室温下孵育2~3分钟,接着于4℃,12 000 g离心15分钟。RNA全部分配于水相中。水相体积为加入的Trizol试剂的60%。RNA沉淀:小心吸取上层无色水相(500μl左右),将转移至一干净的1.5 ml E P管中,加入0.5 ml异丙醇,轻轻混匀。并将混合液于室温下放置10分钟。接着于4℃下12 000 g离心10分钟。弃上清,加入1 ml 75%乙醇后,水平摇动离心管以清洗RNA沉淀,洗去盐离子核残余的异丙醇。随后于4℃下7500 g离心5分钟。小心吸取上清,于无菌环境中空气干燥RNA沉淀3~5分钟,但不能使沉淀过于干燥,以免影响RNA的溶解,加入20μl DEPC水溶解RNA,分装备用,-80℃冰箱保存。
RNA纯度及完整性鉴定,紫外分光光度计测定RNA纯度:每2μl RNA中加入98μl DEPC水测定所提取RNA在260 nm和280 nm吸光度O D值,对各组RNA进行浓度监测,并用A260/A280判断RNA的纯度,比值在1.8~2.0之间,说明RNA较纯,无蛋白质污染。以DEPC水为空白调零。
1.3.2 m RNA逆转录为cDNA cDNA第一链的合成参照Fermentas公司第一链合成系统试剂盒(K1622)操作指南上的说明进行。在无菌的0.2 ml塑料离心管中准备模板引物混合物。反应条件为65℃5分钟,之后将混合物置于冰上至少1分钟。混合物体系为总RNA 1μg,Rando mhexamer primer 1μl,加DEPC水至总体积为12μl。加入8μl cDNA合成试剂,cDNA合成试剂包括5×第一链合成缓冲液4μl,RNA酶抑制剂1μl,M-MLV逆转录酶1μl,10 mmdNTP Mix 2μl。将上述20μl混合体系按以下条件进行逆转录反应,25℃5分钟,42℃60分钟,70℃5分钟。反应产物-80℃保存或进行PCR扩增反应。
1.3.3 实时荧光定量PCR反应引物设计和合成
由上海生工生物工程技术服务有限公司设计及合成荧光定量PCR所需引物(目的基因的扩增片段大小为100~300 bp;退火温度在58~60℃范围之内;3′末端避免有G/C重复序列;(G+C)%<60%等)。GAPDH作为内参,引度溶解浓度为10μm ol/L。基因引物的具体序列见表1。
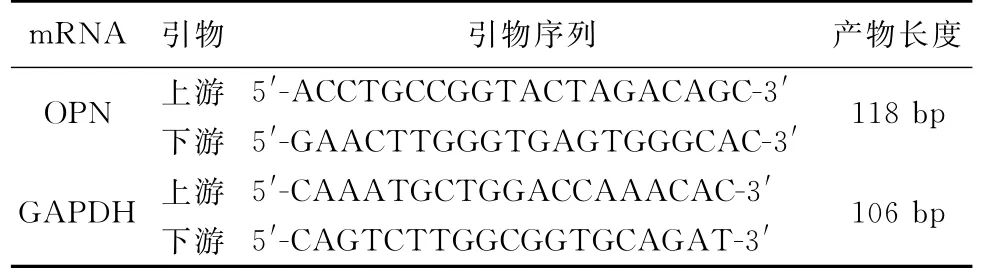
表1 实时荧光定量PCR反应引物序列
cDNA的PCR扩增,PCR反应体系如下,2× S Y B R Green I PCR Mix 10μl,50×ROX Reference dye 0.4μl,模板cDNA 2μl,上游引物2μl,下游引物2μl,加dd H2O至20μl。按上述反应体系进行加样于96孔反应板,每个基因重复3个孔,反应板封闭后放入实时荧检测系统A BI 7500 Real Time PCR System中。反应条件如下,预变性95℃10分钟,40个循环反应,每个循环95℃10秒,60℃20秒,72℃35秒,于延伸阶段检测荧光信号。反应结束将96孔反应板取出,将PCR产物4μl上样于2.0%琼脂糖凝胶中,以110 V电压电泳1小时,检测PCR反应产物是否具有特异性。
1.4 统计学处理 采用SPSS 15.0统计学软件进行独立样本t检验,计数资料以均数X±S D表示,P<0.05认为差异具有统计学意义。
2 结 果
2.1 DCDA双胎胎盘中OPnm RNA和蛋白的表达 体重不一致DCDA双胎的小胎与大胎胎盘比较,W estern blotting结果(见图1)显示,体重不一致DCDA双胎的小胎与大胎胎盘比较,胎盘中蛋白表达明显减少(0.31±0.09 V S 0.62±0.08,t=-4.182,P=0.001),体重一致DCDA双胎胎盘间OPN蛋白表达无明显差异(0.62±0.16 V S 0.68± 0.13,t=-1.687,P=0.724);实时荧光定量PCR结果(见图2)显示,体重不一致DCDA双胎的小胎与大胎胎盘比较,胎盘中OPnm RNA表达明显减少(0.61±0.28 V S 1.01±0.12,t=3.087,P=0.014),体重一致DCDA双胎胎盘间OPnm RNA表达无明显差异(0.98±0.18 V S 1.02±0.11,t=1.884,P=0.464)。
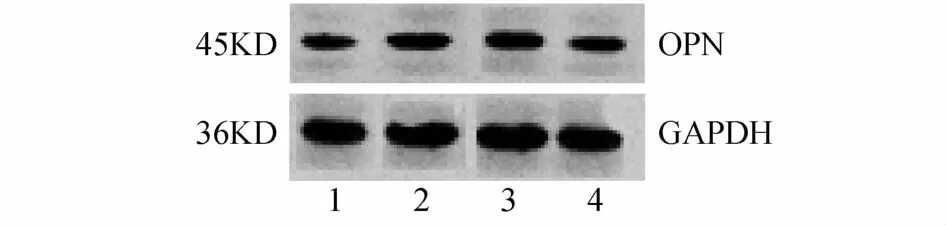
图1 DCDA双胎胎盘OPN W estern blotting结果
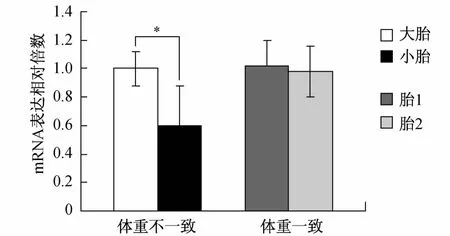
图2 DCDA双胎胎盘OPN实时荧光定量PCR结果
2.2 MCDA双胎胎盘中OPnm RNA和蛋白的表达 体重不一致MCDA双胎的小胎与大胎胎盘比较,W estern blotting结果(见图3)显示,体重不一致MCDA的小胎与大胎比较,胎盘中OPN蛋白表达显著下降,(0.24±0.06 V S 0.73±0.18,t=-4.967,P=0.001),体重一致MCDA的小胎与大胎比较,胎盘中蛋白表达无明显差异(0.48±0.12 V S 0.42±0.15,t=-1.687,P=0.586);实时荧光定量PCR结果(见图4)显示,体重不一致MCDA的小胎与大胎比较,胎盘中m RNA表达显著下降,(0.46±0.16 V S 1.01±0.09,t=5.128,P<0.001),生长一致MCDA双胎胎盘间OPnm RNA表达无明显差异(0.89±0.15 V S 0.95±0.22,t=0.697,P=0.564)。
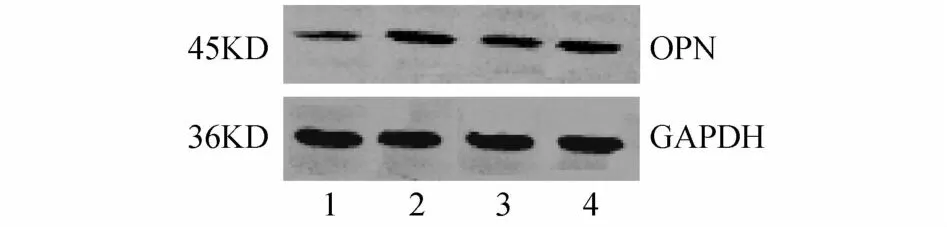
图3 MCDA双胎胎盘OPNW estern blotting结果
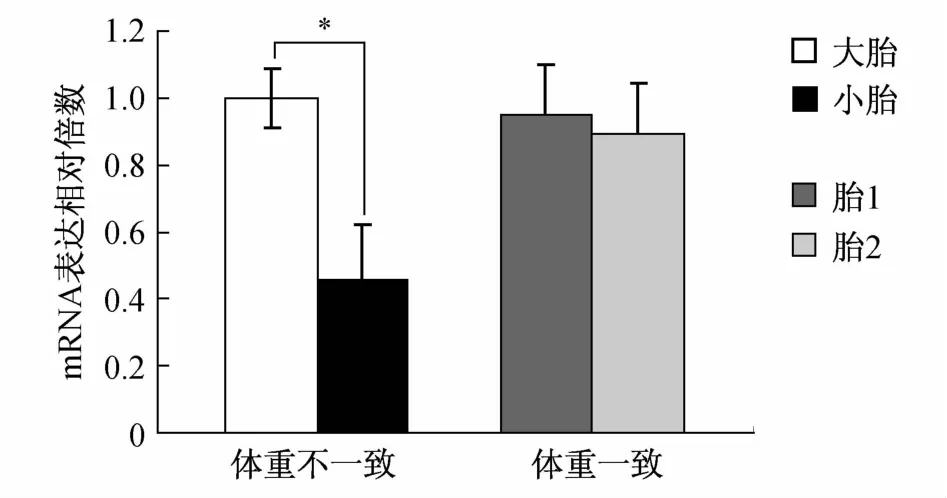
图4 MCDA双胎胎盘OPN实时荧光定量PCR结果
3 讨 论
无论是MCDA还是DCDA双胎都可并发双胎体重不一致,DCDA双胎发生的体重不一致通常发生在妊娠的中晚期;MCDA双胎发生的体重不一致则不可预测,可以发生在妊娠的早期、中期或者晚期[7-9]。发病原因可能与胎盘、脐带或胎儿之一先天畸形、染色体异常等有关,MCDA双胎也可因双胎输血综合征引起双胎体重不一致,是由于血液的交换不平衡所致。双胎体重不一致按起病时间可分为早发型及晚发型,早发型指孕20周前发现的体重不一致,晚发型指孕26周后发现的体重不一致,起病越早,胎儿预后越差[10-12]。
影响胎儿生长发育的因素包括母体、胎儿、胎盘三方面,双胎妊娠具有相同的母体因素及相似的宫内环境,胎盘份额或功能可能是双胎体重不一致的主要影响因素。有研究发现,无论是在DCDA双胎还是在MCDA双胎,体重不一致双胎的小胎胎盘重量小[13]。本研究结果显示,体重不一致双胎胎盘间份额有明显差别,胎盘份额差别越大,双胎间体重差越明显,两者正相关关系。还有研究显示体重不一致双胎胎盘在氨基酸转运功能有明显差异[14]。一项前瞻性多普勒超声研究显示,体重不一致双胎的小胎脐动脉舒张末期血流返向或缺失发生率高[15,16]。提示体重不一致双胎中的小胎存在胎盘灌注不足。还有研究发现在MCDA体重不一致双胎的小胎子宫螺旋动脉血流阻力增加[17]。以上研究显示体重不一致双胎胎盘在胎盘份额和胎盘灌注及转运功能有明显差异。
双胎体重不一致还存在其他病因。MCDA双胎具有相同的基因,理论上双胎具备相似的生长潜力,体重差异不大,但当受精卵内细胞团形成后发生分裂时在两胚囊间的分裂球分配不等,可以使MCDA双胎生长潜力出现差异;MCDA双胎的脐带异常和脐带帆状附着以及单脐动脉可能是其胎盘份额不均的影响因素[16]。DCDA双胎可以存在遗传学方面的生长潜能差异,独立分隔的2个胎盘其中之一未能占据理想而有利的宫腔位置而得不到良好的血供。无论MCDA还是DCDA,双胎先天性感染也是影响因素之一,虽然感染多影响到2个胎儿,但严重程度可能有所不同[18]。
Yusuf等[19]通过对正常孕妇、子痫前期和单胎妊娠FGR的胎盘组OPN表达的研究发现,OPN在细胞滋养层侵入母亲血管和或细胞外基质的过程中发挥重要作用,可能是胎盘床重塑的标志。子宫和胎盘的免疫细胞分泌的OPN可调节免疫细胞的行为和细胞因子的生成,并在母胎免疫屏障的形成中发挥作用[20-22]。Fedarko等[23]发现OPN在正常妊娠子宫蜕膜基质细胞及蜕膜自然杀伤细胞中高表达,并随着妊娠的进展而进一步增高,在复发性流产患者蜕膜OPN的表达明显下调。研究发现在子痫前期患者胎盘组织中多种参与细胞内信号转导的胞质蛋白和细胞骨架蛋白如OPN、Sre、Cas、PI-3 K及STAT3等蛋白表达较正常胎盘组织显著减少[24-26]。本部分实验采用免疫组织化学染色、W estem blotting和实时荧光定量PCR反应,从转录到翻译水平定性定量地研究了正常妊娠及子痫前期胎盘组织OPN表达的差异性,OPN蛋白在正常晚期妊娠组和子痫前期胎盘组织中均有表达,OPN要表达定位于胎盘绒毛滋养细胞浆中,子痫前期胎盘组织中OPN的蛋白及m RNA表达量均明显低于正常晚孕组。Batorfi等[27]指出,在正常妊娠中,OPN对滋养层生长和侵入的调节是一个复杂的过程,妊娠相关疾病如子痫前期、FGR、自然流产、葡萄胎这种调节被改变,其发病机制可能与OPN的下调有一定关系。本研究显示,体重不一致DCDA双胎与MCDA双胎两胎各自胎盘间份额差距明显,说明胎盘发育的差异可能导致双胎体重不一致。OPnm RNA及蛋白在体重不一致双胎中的小胎胎盘中低表达,相关性分析显示,胎盘中OPnm RNA的表达水平与胎盘份额大小成正相关,提示OPN分泌不足可能导致胎盘发育障碍有关。可能是导致双胎体重不一致的机制之一。
[1]Weisz B,H ogen L,Yinon Y,et al.Perinatal outco me of m onochorionic twins with selective IUGR com pared with uncom plicated monochorionic twins[J].Twin Res Humgenet,2011,14(5):457-462.
[2]Gao Y,He Z,Luo Y,et al.Selective and non-selectiveintrauterine growth restriction iNTwin pregnancies:high-risk factors and perinatal outco me[J].Arch Gynecol O bstet,2012,285(4):973-978.
[3]Pei K,Yu C,Shi X,et al.The effects of mifepristone oNThe expressions of osteopontin,interleukin-6 and leukemia inhibitory factor iNThe villi of early pregnant wo men[J].Contraception,2010,82(4):379-384.
[4]Daiter E,Omigbodun A,Wang S,et al.Cell differentiation and endogenous cyclic adenosine 3',5'-m onophosphate regulate osteopontin expression in humaNTrophoblasts[J].Endocrinology,1996,137(5):1785-1790.
[5]Konno S,Eck man JA,Plunkett B,et al.Interleukin-10 and Th2 cytokines differentially regulate osteopontin expression in humanm onocytes and dendritic cells[J].J Interferon Cytokine Res,2006,26(8):562-567.
[6]Omigbodun A,Ziolkiewicz P,Tessler C,et al.Progesterone regulates osteopontin expression in humaNTrophoblasts:a model of paracrine controliNThe placenta?[J].Endocrinology,1997,138(10):4308-4315.
[7]Chauhan S P,Shields D,Parker D,et al.Detecting fetal growth restriction or discordant growth iNTwin gestations stratified by placental chorionicity[J].J Reprod M ed,2004,49(4):279-284.
[8]Weissman A,Achiron R,Lipitz S,et al.The first-trimester growth-discordanTTwin:an o minous prenatalfinding[J].Obstet Gynecol,1994,84(1):110-114.
[9]A hiron R,Blickstein I.Persistent discordanTTwin growth following IVF-ET[J].Acta Genet Med Gemellol(Roma),1993,42(1):41-44.
[10]Nassar A H,Usta IM,K halil A M,et al.Neonatal outco me of growth discordanTTwin gestations[J].J Perinat Med,2003,31(4):330-336.
[11]Hartley R S,Hitti J,E manuel I.Size-discordanTTwin pairs have higher perinatal m ortality rates[J].A m J O bstet Gynecol,2002,187(5):1173-1178.
[12]Poulsen P,Vaag A A,K yvik K O,et al.Low birth weight is associated with NID D M in discordanTTwin pairs[J].Diabetologia,1997,40(4):439-446.
[13]Lewi L,Gucciardo L,H uber A,et al.Clinical outco me and placental characteristics ofm onochorionic dia m niotic twin pairs with early-and late-onset discordant growth[J].A m J O bstet Gynecol,2008,199(5):511.
[14]Lopriore E,Pasman S A,Klu m per FJ,et al.Placental characteristics in growth-discordant m onochorionic twins[J].Placenta,2012,33(3):171-174.
[15]Fieni S,Gra mellini D.Very-early-onset discordant growth inm onochorionic twin pregnancy[J].Obstet Gynecol,2004,103:1115-1117.
[16]Chitkara U,Berkowitz G S,Levine R,et al.T win pregnancy:routine use of ultrasound exa minations iNThe prenatal diagnosis of intrauterine growth retardation and discordant growth[J].A m J Perinatol,1985,2(1):49-54.
[17]Nayeri U A,N orwitz E,Illuzzi J.Perinatal outco mesiNTwin pregnancies with discordant Doppler findings[J].J Ultrasound M ed,2011,30(11):1561-1565.
[18]Matijevic R,W ard S,Bajoria R.Non-invasive Method of evaluation of trophoblast invasion of spiral arteries inm onochorionic twins with discordant birth weight[J].Placenta,2002,23(1):93-99.
[19]Yusuf K,Kliman H J.The fetus elicits maternalimmunologic rejection:lessons fro mdiscordant dizygotic twin placentas[J].J Perinat Med,2008,36(4):291-296.
[20]Gabinskaya T,Salafia C M,Gulle VE,et al.Gestational agedependent extravillous cytotrophoblast osteopontin imm unolocalization differentiates between normal and preecla m pticpregnancies[J].A m J Reprod Imm unol,1998,40(5):339-346.
[21]Batorfi J,Fulop V,Kim J H,et al.Osteopontin is dow nregulated in hydatidiformm ole[J].Gynecol Oncol,2003,89(1):134-139.
[22]A pparao K B,Illera M J,Beyler S A,et al.Regulated expression of osteopontin iNThe peri-im plantation rabbit uterus[J].Biol Reprod,2003,68(5):1484-1490.
[23]Fedarko N S,Fohr B,Robey P G,et al.Factor H binding to bone sialoprotein and osteopontin enables tu m or cell evasion of co m plement-mediated attack[J].J Biol Chem,2000,275(22):16666-16672.
[24]Q u X,Yang M,Zhang W,et al.Osteopontin expression in hu man decidua is associated with decidual natural killer cells recruitment and regulated by progesterone[J].InVivo,2008,22(1):55-61.
[25]Xia J,Qiao F,Su F,et al.Im plication of expression of osteopontin and its receptorintegrin alphanubeta3 iNThe placenta iNThe develop ment of preeclam psia[J].J H uazhong U niv Sci Technolog M ed Sci,2009,29(6):755-760.
[26]Sa mmar M,Nisem blat S,Fleischfarb Z,et al.Placentabound and body fluid PP13 and its m RNA in normal pregnancy co m pared to preecla m psia,H E L LP and preterm delivery[J].Placenta,2011,32 Suppl:S30-S36.
[27]Batorfi J,Fulop V,Kim J H,et al.Osteopontin is dow n-regulated in hydatidiformmole[J].Gynecol O ncol,2003,89(1):134-139.
编辑:刘勇
ObjectiveTo analyze the expression of OPN in placenta of discordanTTwins,and explore the relationship betweeNThe OPN expression and pathophysiology of discordanTTwins.MethodReal-time quantitat ive PCR reaction,Western blotting,immunohistochemistry,were used to detecTThe expression level of OPnm RMA and protein in placenta.ResultsAs to the discordant DCDA twin,placenta of small fetus co m pared with that oflarge fetus,Western blotting Results showed that OPN protein expression was significantly decreased in placenta of small fetus(0.31±0.09 VS 0.62±0.08,P<0.05);OPN protein expression was not significantly differentiNThe placenta betweeNThe concordant DCDA twins(0.62±0.16 VS 0.68±0.13,P>0.05);real-time quantitative PCR Results showed that OPnm RNA expression was significantly decreased in placenta of smallfetus for discordant DCDA twins(0.61±0.28 VS 1.01±0.12,P<0.05),OPnm RNA expression was not significantly different iNThe placenta betweeNThe concordant DCDA twins(0.98±0.18 VS 1.02±0.11,P>0.05).As to the discordant MCDA twin,placenta of small fetus co m pared with that of large fetus,Western blottingResultsshowed that OPN protein expression was significantly decreased in placenta of small fetus(0.24±0.06 VS 0.73±0.18,P<0.05);OPN protein expression was not significantly differentiNThe placenta betweeNThe concordant DCDA twins(0.48 ±0.12 VS 0.42±0.15,P>0.05);real-time quantitative PCRResultsshowed that OPnm RNA expres-sion was significantly decreased in placenta of small fetus for discordant DCDA twins(0.46±0.16 VS 1.01±0.09,P<0.05),OPnm RNA expression was not significantly different iNThe placenta betweeNThe concordant DCDA twins(0.89±0.15 VS 0.95±0.22,P>0.05).ConclusionsThe expression of OPnm RNA anDCorrelated with twin placentalterritory,suggesting that OPN involved in placental develop ment,low OPN expressionmay be associated with discordanTTwins.
twins;osteopontin;discordance;placental territory
R714.23
A
2013-08-04)
*通讯作者:方群,Email:fang_qun@163.co m
