百草枯对小鼠神经行为发育及学习记忆功能的影响
2013-05-24王翘楚娄丹田雨来常秀丽周志俊
王翘楚,娄丹,田雨来,常秀丽,周志俊
(复旦大学公共卫生学院/教育部公共卫生安全重点实验室/WHO职业卫生合作中心,上海 200032)
百草枯(Paraquat)(分子式 C12H14Cl2N2),是一种速效触杀型、灭生性除草剂,易溶于水,微溶于酒精,目前在世界130多个国家和地区广泛使用。百草枯进入人体后,在肺组织中浓度较高,在肾小管中不被重吸收,以原型从肾脏排出[1]。百草枯为中等毒性,能使急性中毒患者发生肺纤维化,死亡率较高。近年来,百草枯的大量使用引发了人们对其长期低剂量接触的慢性毒性作用和对生态环境影响的担忧。近年的研究已经开始关注PQ对中枢神经系统的影响。诸多流行病学研究表明百草枯的长期暴露同神经系统病变尤其是帕金森病(PD)有关[2]。职业接触评估已经证实了PQ暴露与PD发病的关系[4],细胞实验也证实百草枯能够影响细胞的多巴胺系统的动态平衡,导致细胞信号传导通路异常[3]。实验室研究也发现小鼠亚慢性暴露 PQ后出现帕金森样症状,使用PQ对成年C57BL/6J小鼠进行染毒后黑质多巴胺神经元数量会出现选择性地减少[5]。另外,在神经发育早期,由于血脑屏障发育不完善及一些功能蛋白活性很低或缺乏,发育早期易受到环境神经毒物毒作用的影响,导致神经生理功能的异常,并对成年后的中枢神经生理功能和防御机制造成影响。有研究发现出生早期暴露毒死蜱会引起子代大鼠成年后的学习记忆功能下降[6],新生期的C57BL/6J小鼠暴露于大剂量的百草枯,成年后小鼠出现类似于帕金森病的行为表现[7]。本研究欲通过对新生小鼠染毒百草枯,探讨神经发育早期百草枯的神经毒作用,观察成年后小鼠的学习记忆能力的影响,从而进一步补充和完善百草枯的神经毒作用。
1 材料与方法
1.1 动物分组及处理
3周龄雄性 C57BL/6J小鼠,体重(9±2)g,80只,来源于复旦大学上海医学院实验动物部【SCXK(沪)2009-019】,实验在复旦大学上海医学院实验动物部【SYXK(沪)2009-0082】进行,随机分为 5组(每组 16 只),每日分别灌胃百草枯 0、1.25、2.5、5、10 mg/(kg·d),对照组按照0.1 mL/10 g给予相同体积的生理盐水。动物房室温保持在18~22℃的范围内,日温差不超过3℃,保证饮水供给充足,每周至少更换两次垫料,连续灌胃30 d,对每组受试动物进行实验处置。
1.2 主要试剂和仪器
百草枯(分析纯,美国 Sigma公司),生理盐水,天平,小鼠笼具,饮水瓶(瓶塞上装有金属饮水管的塑料瓶),垫料(阔叶林木的刨花和锯末);Morris水迷宫程序选用WaterMaze 3软件,来自Coulbourn公司,Morris水迷宫及避暗实验设备由复旦大学脑科学研究院提供。
1.3 方法
1.3.1 避暗实验
1.3.2 Morris水迷宫
包括定位航行及空间探索,其中定位航行试验旨在检测其空间学习能力,空间探索试验旨在检测其空间记忆能力[9]。此次实验采用的水迷宫为一直径120 cm的圆形水池,水池净高50 cm,水深30 cm,等分为 I、II、III及 IV 象限,在 II象限中间距边缘30 cm放一低于水面1 cm黑色平台,平台直径为10 cm。水迷宫外参照物不变,进行训练时水温恒定(25±1)℃。
(1)定位航行实验:实验前小鼠自由游泳1 min。每天训练4次,每次小鼠于池边4个固定点面向池壁入水,每次小鼠实验的先后顺序一定,将实验小鼠面向池壁放入水中同时开始录像。记录实验小鼠在60s内从不同象限入水至发现并爬上平台的时间(以秒记)作为训练潜伏期,即逃避潜伏期,找到后在平台上保持15 s,如找不到,则引导到平台上保持15 s,记录小鼠的登台潜伏期,每4次的均值作为1次平均训练潜伏期,连续训练6d,以此测定空间学习能力。如果动物在60s内未找到平台,时间记录为60 s。
(2)空间探索实验:此实验用于测量动物对平台空间位置准确记忆,即记忆保持能力。第6天定位航行结束后立即进行空间探索实验,撤去平台,将小鼠分别从同一象限固定位置面向池壁放入水中,记录60s内小鼠从入水至找到平台的时间、原平台象限游泳时间和原平台象限游泳距离占总距离的百分比,测试小鼠的空间记忆能力。
1.3.3 脑脏器系数
神经行为学测试结束后,颈椎脱臼法将小鼠处死,取出大脑称得湿重,计算脑的脏器系数(脏器重量/体重 ×100)。
1.3.4 病理学检查
3.发生的危险因素:首次进行HAART、基线病毒载量高及基线CD4+T淋巴细胞数较低者为IRIS发生的危险因素[9]。此类患者在抗病毒治疗后应警惕IRIS的发生。有效控制急性期机会性感染后再进行HAART或HAART前积极发现潜在的机会性感染可降低IRIS的发生率。
所取脏器标本用4%中性甲醛液固定,经梯度乙醇脱水,石蜡包埋,常规切片和 HE染色,同时中脑的组织切片又进行了甲苯胺蓝染色,封片镜检。
1.3.5 透射电镜检查
从每组动物中取4只小鼠,颈椎脱臼后,取脑,快速用锋利剪刀剪下一小块组织,立即浸润在固定液内修整,取黑质部组织切成1 mm ×1 mm ×0.5 mm的小块,1%四氧化锇固定,再经缓冲液冲洗,丙酮脱水,环氧树脂浸透包埋,超薄切片,铅铀染色,透射电镜Hitachi-7500观察中脑黑质神经元的超微结构。
1.3.6 数据处理
2 结果
2.1 一般状况观察
染毒期间每天对小鼠进行称重,记录体重,并进行一般状况观察。各组小鼠在染毒期间一般情况均良好,毛色光洁度、活力、步态、分泌物、眼外观、呼吸、神态等表现无异常。染毒结束后,统计30 d小鼠的体重数据,绘制体重变化曲线(图1,彩插1),各组小鼠体重均有上升趋势,对体重数据进行统计分析,各组小鼠体重差异无统计学意义。

图1 各组小鼠染毒期间体重变化Fig.1 Analysis of the body weight changes of the mice during the experiment
2.2 脑脏器系数
各组小鼠大脑脏器系数的差异均没有统计学意义,但是按给药剂量由低到高,各组小鼠脑的脏器系数有下降的趋势(图2)。

图2 各染毒组小鼠大脑脏器系数比较Fig.2 Comparison of the brain organ coefficients of the mice
2.3 避暗实验
随着染毒浓度的增加,各组小鼠的避暗潜伏期逐渐延长,与对照组相比,高剂量组小鼠潜伏期的延长具有统计学意义(P<0.05)(表1)。
表1 各组小鼠避暗实验测试结果(,n=8)Tab.1 Results of the passive avoidance task test()

表1 各组小鼠避暗实验测试结果(,n=8)Tab.1 Results of the passive avoidance task test()
注:*:与对照组相比,高剂量组小鼠的避暗潜伏期的延长具有统计学意义(P<0.05)。Note:*:The results of passive avoidance task test in the high dose group was significantly longer than that of the control group(P<0.05).
潜伏期(s)Latency period对照组 control 31.99±16.3873极低剂量组 Lowest dose 56.53±41.8188低剂量组 Low dose 81.56±32.3418中剂量组 Moderate dose 82.91±40.8197高剂量组 High dose 168.54±86.5096组别Groups*
2.4 Morris水迷宫
无论是小鼠在原平台象限游泳的时间占总时间的百分比,还是小鼠穿越平台位置的次数,以及小鼠在空间探索实验中的潜伏期,各剂量组间的差异均不具有统计学意义,但随着给药剂量的增高60 s内各组小鼠在原平台象限游泳的时间有逐渐增加的趋势(图3)。

图3 Morris水迷宫各染毒组小鼠在原平台象限游泳时间比较Fig.3 Comparison of the swimming time of the mice in the platform quadrant of the Morris water maze
2.5 病理学检查
对照组中脑黑质HE染色和甲苯胺蓝染色均可见大量深染的黑质细胞(图4,彩插1),与对照组相比,高剂量组深染黑质细胞明显减少(图5,彩插1)。
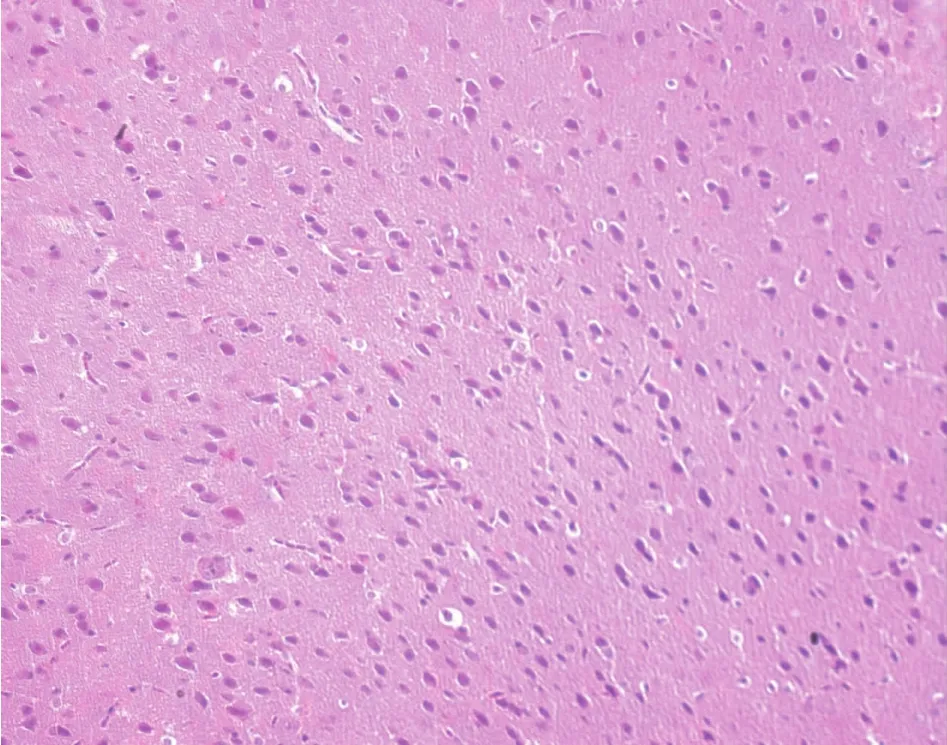
图4 对照组小鼠中脑黑质HE染色Fig.4 Histology of the substantia nigra in a control mouse. HE staining
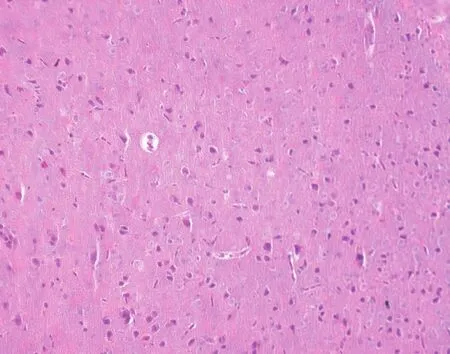
图5 高剂量组小鼠中脑黑质HE染色Fig.5 Histology of the substantia nigra in a mouse of the high-dose group . HE staining
2.6 中脑电镜超微结构
利用透射电镜观察各组小鼠中脑黑质部超微结构,其中在所取的4例高剂量样本中观察到一例凋亡的神经元细胞,细胞核内出现染色质边集,其他剂量组没有观察到凋亡的神经元细胞。
3 讨论
百草枯作为一种被广泛使用的除草剂,近年来引起越来越多的关注,国内外的多项研究表明百草枯能够增加罹患帕金森病的风险,造成小鼠帕金森症样的表现并能导致黑质纹状体通路的多巴胺含量的减少[10]。本次研究通过对发育期小鼠进行百草枯染毒,探究百草枯染毒对小鼠神经行为发育及学习记忆能力的影响。
本研究中,染毒期间各组小鼠的体重均有上升,染毒结束后,各组体重差异没有统计学意义,说明低剂量暴露于百草枯对小鼠不会产生明显的毒作用。脏器系数是毒理学试验中灵敏、有效的指标之一[11]。正常情况下各脏器与体重的比值比较恒定。动物染毒后,受损脏器重量发生改变,脏器系数也随之改变。脏器系数增大,说明脏器发生充血、水肿或增生肥大等;脏器系数减小,说明脏器发生萎缩及其他退行性变。虽然脑脏器系数的差异没有统计学意义,但是随着各染毒组百草枯剂量的升高,脑的脏器系数有逐渐下降的趋势,这提示了百草枯对脑发育的损伤和影响。结合中脑超微电镜结构和病理切片的结果,在高剂量组发现了神经元细胞的损伤和黑质细胞减少的现象,说明低剂量百草枯能够损伤小鼠的神经系统发育。
在行为学测试中,我们采用了Morris水迷宫实验和避暗实验,二者都可以用来检测动物的学习记忆能力,并可根据所得实验结果评价动物的高级中枢神经功能。其中,Morris水迷宫主要侧重于动物视觉相关的空间学习能力,属于主动学习,对动物的体力要求比较高[12];而避暗实验则对记忆再现功能有较高的敏感性,属于被动学习过程。本次研究中,Morris水迷宫实验无论是小鼠在原平台象限游泳的时间占总时间的百分比,还是小鼠穿越平台位置的次数,以及小鼠在空间探索实验中的潜伏期,各剂量组间的差异均不具有统计学意义,但是随着给药剂量的增高60 s内各组小鼠在原平台象限游泳的时间却有逐渐增加的趋势。而在避暗实验中,随着给药剂量的增加,各组小鼠的潜伏期有逐渐增加的趋势,且与对照组相比,高剂量组潜伏期的延长具有统计学意义,说明百草枯能够影响小鼠的学习记忆能力。
综上所述,本实验条件下,百草枯对小鼠的体重没有影响,对脑神经元以及黑质细胞可以造成器质性的损伤。但是,百草枯对小鼠的空间学习记忆能力影响并不明显,却对被动学习能力表现出一定的兴奋作用。
对于在避暗实验中,高剂量组小鼠表现出在被动学习能力上的优势这一现象,以及在Morris水迷宫实验中,随着给药剂量的增高60 s内各组小鼠在原平台象限游泳的时间有逐渐增加的趋势的实验结果,考虑有以下可能:①与低剂量兴奋作用有关,即低剂量时表现为轻微的兴奋反应,而在高剂量时表现为抑制,属于一种动态平衡破坏后的适度补偿[13]。值得注意的是,以往的研究发现,低剂量兴奋作用多为发育早期暴露所致,相比成年动物,发育期动物更容易出现低剂量兴奋作用[14]。这种低剂量兴奋效应在其他的有毒物质如硝酸镧的相关研究中也有报道,蒋建军等[15]在硝酸镧的低剂量兴奋作用研究中发现,在水迷宫实验中,随着染毒剂量的升高,小鼠的学习记忆能力逐渐增强,当剂量升高到一定界值后,随着剂量的继续升高,学习记忆能力又逐渐减弱;②由于海马与动物的学习记忆能力密切相关,低剂量的百草枯可能兴奋了海马区的功能,使小鼠的学习记忆能力有所提高。另外,本次研究中,在微观病变已经发生的情况下,学习记忆能力并没有受到损伤,说明,微观病变早于神经行为变化出现,尚未达到能够损伤小鼠学习记忆能力的病变水平。同时,由于神经行为的改变反应的是动物的综合能力,包括视觉、嗅觉、运动功能以及学习能力等,微观病变说明百草枯能够损伤黑质细胞和多巴胺神经元,但是此次实验的百草枯染毒剂量,不足以影响小鼠的神经行为功能。为进一步证明以上结论,在接下来的实验中需继续扩大染毒的范围,增加染毒组数,升高染毒剂量,观察是否随着染毒剂量的进一步升高,小鼠学习记忆能力出现下降的趋势,并且测定海马区与学习记忆能力相关的代谢产物及功能酶水平,判断海马区是否产生兴奋效应,以进一步完善研究内容。
[1]余方宇.百草枯中毒机制及治疗研究进展[J].临床急诊杂志,2006,7(4):208-212.
[2]娄丹,常秀丽,周志俊.百草枯暴露致帕金森病的机制研究进展[J].毒理学杂志,2010,24(3):76-79.
[3]Lou D,Li WH,Zhou ZJ,et al.Paraquat affects the homeostasis of dopaminergic system in PC12 cells [J].Pesticide Biochem Physiol,2012,103(6):81 -86.
[4]Tomenson,JA,Campbell,C.Mortality from Parkinson's disease and other causes among a workforce manufacturing paraquat:a retrospective cohort study[J].BMJ open,2011 Jan 1;1(2):e000283.
[5]Yin L,Lu L,Prasad K,et al.Genetic-based,differential sus-ceptibility to paraquat neurotoxicity in mice[J].Neurotoxicol Teratol,2011,33(3):415 -421.
[6]Jett DA,Navoa RV,Beckles RA,et al.Cognitive function and cholinergic neurochemistry in weanling rats exposed to chlorpyrifos[J].Toxicol Appl Pharmacol,2001,174(2):89 - 98.
[7]丁正同,任惠民,蒋雨平,等.百草枯对小鼠黑质纹状体多巴胺能系统的影响[J].复旦学报:医学版,2001,28(1):28-31.
[8]Cappon GD,Bush B,Newgreen D,et al.Tolterodine does not affect memory assessed by passive-avoidance response test in mice[J].Eur J Pharmacol,2008,579(1 -3):225 - 228.
[9]R.Morris.Developments of a water-maze procedure for studying spatial learning in the rat[J].Neurosci Methods,1984,11:47-60.
[10]Rappold PM,Cui M,Chesser AS,et al.Paraquat neurotoxicity is mediated by the dopamine transporter and organic cation transporter-3 [J].Proc Nat Acad Sci U S A,2011,108(51):20766-20771.
[11]马秀兰,宋淑云,叶建新,等.对成年大鼠脏器系数的探讨[J].动物学杂志,1996,31:25-26.
[12]Saab BJ,Luca RM,Yuen WB,et al.Memantine affects cognitive flexibility in the Morris water maze [J].J Alzheimer's Disease,2011,27(3):477-482.
[13]Tasker RA,Perry MA,Doucette TA,et al.NMDA receptor involvement in the effects of low dose domoic acid in neonatal rats[J].Amino Acids,2005,28(2):193 -196.
[14]卫立,张洪昌,张爱茜,等.环境内分泌干扰物低剂量-效应研究进展[J].生态毒理学报,2007,2(1):25-31.
[15]蒋建军,尚兰琴,杨晓华,等.硝酸镧对小鼠学习记忆低剂量兴奋效应及其机制研究[J].现代预防医学,2007,34(22):4225-4232.
