直视下行大鼠气管插管的方法比较
2013-05-22叶明霞孔利佳
叶明霞,孔利佳
(华中科技大学同济医学院实验动物学部,武汉 430030)
大鼠是国际通用的标准化的实验动物,在多种医学、生物学试验研究中广泛应用,在行大鼠开胸手术需呼吸机辅助呼吸、呼吸功能检测或气管内给药等动物实验中,顺利的大鼠气管插管是实验成败的前提。目前常用的插管方法有:颈部切口插管法[1]、颈部切口钢丝引导插管法[2、3]、盲插法、内窥镜辅助插管法[4、5]、经口明视插管法[6]和经颈部透照气管插管法等,但前两种是有创的插管方法,会对气管及咽喉部周围组织造成损伤,从而影响插管的重复进行,进而影响整个实验的结果。盲插的成功率低,反复插易损伤气道,容易造成喉痉挛、喉水肿、气管穿孔、出血和分泌物过多阻塞气管导致窒息等并发症,影响实验结果;所以无创的插管方法为大家所推崇,但由于大鼠呼吸频率较快、口腔狭小、声门位置较高,插管时声门暴露困难,多年来诸多学者对大鼠气管内插管的方法和插管器械做了大量的研究和改进。专用的大小鼠气管插管内窥镜小导管装置,价格昂贵,不适于教学实验;也有人借助临床耳鼻喉科的额镜进行辅助插管。我们在反复实践中,对直视插管方法进行了多方面的摸索,自创了小器械,取得了较为满意的效果,并采用经额镜辅助和经颈透照两种直视气管插管方法,为大鼠进行插管操作,对两种方法的安全性和有效性进行了比较,现报道如下:
1 材料和方法
1.1 动物
SD大鼠40只,雌雄各半,体重180~300 g,由华中科技大学实验动物中心提供【SCXK(鄂)2010-0009】。实验操作在华中科技大学实验动物中心屏障动物实验设施内进行【SYXK(鄂)2010-0057】。根据体重分层随机分配的原则,将大鼠分为经额镜辅助组和经颈透照组两个组。
1.2 其他材料
额镜、照明灯、干净纱布、大功率冷光源、自制开口器、气管导管、小棉签、玻片一个。
1.2.1 自制开口器
成年大鼠声门张开时直径约为1.5~2.5 mm,从切牙到舌根的距离约为3 cm,切牙到气管声门的距离约为5 cm,从第一气管环到气管分叉处的距离为3 cm左右,气管环呈扁椭圆形,水平径约3.5 mm,垂直径约2 mm。根据其解剖结构,使用一次性2 mL塑料注射器针筒,尾端部加工成为楔形(如图1,彩插4),楔形前端角度约为25°,前端处理光滑,以防刮伤大鼠口腔内黏膜组织,导管顶端和底端长度可根据大鼠体重略加修改。
1.2.2 气管导管
采用16~20 G静脉留置针,针头钝化处理,针头长度略短于套管,弯曲约15度;或者使用12号灌胃针[7](16 G)(如图 2,彩插 4)。根据不同体重大鼠选择不同型号留置针。150 g左右体重大鼠采用20G留置针、200~300 g大鼠采用18 G留置针、300~350 g大鼠采用16 G留置针。
1.3 麻醉
动物称重后,阿托品1 mg/(kg·bw)皮下注射,10 min后10%的水合氯醛,3 mL/kg体重的剂量腹腔注射麻醉,针刺大鼠脚掌无反射,证明麻醉完全。
1.4 经额镜辅助组
术者戴上额镜,调整光源。将大鼠仰卧于手术板上,头朝向术者,用棉线将大鼠上门齿固定于手术板一端的钉子上,倾斜手术板约45°,使大鼠头侧垫高,左手将鼠舌用纱布包裹,向左嘴角外上方拉出口腔,使口腔张开,调整额镜将照射光源引入口腔,右手持插管,弯曲端朝上,向上轻压大鼠舌根部,即能看到大鼠的声门随着呼吸开启与闭合,趁声门打开瞬间迅速将气管导管插入气道,退出管芯,将玻片放置于管口,如插管是在气道中,则有圆形雾斑产生(即水蒸气凝结),若无则判定插入不成功,应立即拔管,稍后重插。
1.5 经颈透照组
大鼠固定方法同上,将光源靠近大鼠下颌部,术者左手将鼠舌用纱布包裹,向左嘴角外上方拉出口腔,右手持自制开口器,长端在上插入大鼠口腔(如图3,彩插4),尾端抵住大鼠上门齿,然后捏住开口器,口腔外侧端下压,口腔内侧长端上挑,使其轻压舌根部,暴露声门,光源透过大鼠颈部薄薄的皮肤和肌层,能清楚的看到大鼠的声门随着呼吸如鱼嘴般开启与闭合(如图4,彩插4),此时术者左手放开鼠舌,捏住开口器,保持喉部暴露状态,右手持插管,弯曲端朝上(如图5,彩插4),从开口器中进入,趁声门打开瞬间迅速将气管插管插入气道,退出针芯,将留置套管留在气道内。将玻片放置于管口,如插管是在气道中,则有圆形雾斑产生(即水蒸气凝结),若无则判定插入不成功,应立即拔管,稍后重插。图6(彩插4)示插入气管成功后,插管前端到达的部位(箭头所示)。
1.6 观察指标
两组均用秒表计时,分别统计两组插管操作时间(从大鼠麻醉固定好,准备插管开始到确定插管成功所需时间,以秒为单位)、插管次数、插管一次成功率、一周后存活率。
1.7 统计学处理
2 结果
2.1 两组气管插管时间、插管次数及插管一次成功率的比较
经颈透照组的插管操作时间、插管次数、一次插管成功率均优于经额镜辅助组(P<0.05),见表1。
表1 两组气管插管时间、插管次数的比较(x±s,n=20)Tab.1 Comparison of the time and frequency of intubation between groups

表1 两组气管插管时间、插管次数的比较(x±s,n=20)Tab.1 Comparison of the time and frequency of intubation between groups
注:与经额镜辅助组比较,★P<0.05。Note:Compared with the conventional groups,★ P <0.05.
别插管时间 插管次数 一次插Thefrequency of intubation管成功率(%)组Group The time of intubation The success rate of the first intubation经额镜辅助组The conventional group 36.41±3.71 1.78±1.03 60(12/20)经颈透照组The homemade instruments group 10.83±1.69★ 1.04±0.21★ 95(19/20)★
表2 两组大鼠气管拔管1 w后存活率比较(±s,n=20)Tab.2 Comparison of the survival rate after extubation 1 week between two groups

表2 两组大鼠气管拔管1 w后存活率比较(±s,n=20)Tab.2 Comparison of the survival rate after extubation 1 week between two groups
注:与经额镜辅助组比较,★P>0.05。Note:Compared with the conventional groups,★ P >0.05.
经额镜辅助组The conventional group 17 85经颈透照组The homemade instruments group 20 100★
2.2 两组大鼠气管拔管1周后存活率比较
经颈透照组大鼠均存活,存活率100%,术后能自主饮食,活动自如。经额镜辅助组大鼠存活率80%,其中一只在术中死亡,另2只在术后1d内死亡,拔管1周后的存活率比较差异无统计学意义(P>0.05),见表 2。
3 讨论
3.1 顺利进行直视下插管须注意以下要点:
(1)适度的麻醉:合适的麻醉深度是成功完成气管插管的前提,麻醉过浅,过度牵拉舌体会造成大鼠抵抗,插管过程中会造成强烈应激反应,大鼠呕吐反射明显,并且出现肢体扭动、呼吸节律紊乱、声门关闭、气管高度紧张和分泌物增加等,不易将导管插入气道,强行插管易造成口咽部水肿、声带损伤、喉痉挛、会厌或上气道出血等并发症。麻醉过深则易造成实验动物发生呼吸抑制,如不能尽快完成气管插管极易致实验动物死亡。大鼠麻醉后用一小棉签轻触其喉头,以没有呕吐反射为宜。
(2)适当的体位:将大鼠的上切牙固定在手术板边缘,手术板抬高倾斜45°,保持大鼠头和颈背部在同一水平位,有利于显露声门和进行插管操作。
(3)大鼠呼吸道检查:麻醉剂容易使大鼠喉部产生分泌物,阿托品可有效减少气道分泌物产生。插管前先检查喉头、声门周围粘膜有无出血和水肿,有无分泌物,若有出血和水肿的大鼠放弃插管,并给予该动物相应的治疗;若只是有分泌物,先用自制小消毒棉签对口腔及喉部进行轻柔擦拭干净后,再行插管。术毕拔管后,仍需要再进行一次呼吸道清洁。
(4)合适的气管导管:采用笔者所介绍的静脉留置针或小鼠灌胃针,长度和直径合适,可避免插入过深进入一侧支气管,或管径过粗损伤气道。另外插管弯曲角度不可过大,插管方向要正确,避免将气道及喉部扎破而造成大鼠死亡。
(5)正确的插管方法:大鼠仰卧固定,气道在食道上方,开口器上挑,气道口一般清晰可见,声门呈鱼嘴状开合,将插管弧度朝上,把握好大鼠呼吸节奏、趁吸气时声门张开,快速插入导管,即可成功,可有效避免插入食管。
(6)插管成功的检测标准:将一张玻片放置在导管口处,观察玻片上是否有水蒸气凝结,插入成功有雾斑,不成功则没有,此方法简单方便,准确,节约时间。
3.2 采用本开口器直视插管法值得推广
本试验中对比使用了两种在大鼠试验中常用的无创直视气管插管的方法,发现这两种方法都能完成大鼠气管插管,额镜辅助插管的优点为材料易得,操作直观,缺点为插管视野狭小、口腔内亮度不足,影响声门的暴露和识别。采用笔者自制的开口器,经颈透照插管操作更简单,不需佩戴和调整额镜,而且视野更清楚,气道口清晰可见,只要把握好大鼠呼吸节奏,插管成功率很高,且缩短了操作时间,显著降低气管插管后的死亡率,是进行大鼠气管插管的好方法,而且此开口器材料易得,价格低廉,使用简单,值得大力推广,特别适用于广大动物实验教学中。
气管插管是多种动物实验的基本操作之一。多年来大鼠气管插管的方法不断改进,总体遵循着减少创伤和应激,改善声门暴露条件,提高插管速度和成功率,减少插管时缺氧发生的原则。随着科技不断进步,对大鼠气管插管方法的改进集中在插管工具的革新上,各种插管工具有效降低了大鼠气管插管的难度,使动物实验质量有了明显提高。与此同时,工具再好,操作者只有通过不断实践,积累经验,才能真正提高大鼠气管插管的质量。
(本文图 1,2,3,4,5,6 见彩插 4。)

图1 自制开口器Fig.1 Homemade instrument

图2 气管导管Fig.2 Orotracheal intubation

图3 开口器插入方法Fig.3 Method of the mouth-gag insert
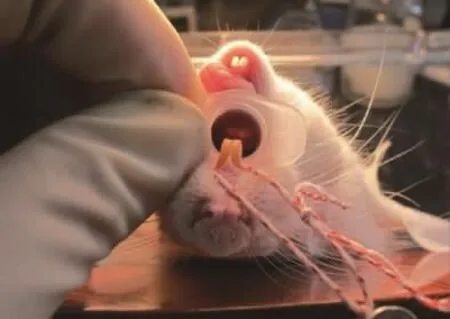
图4 通过开口器看到声门Fig.4 Seen glottis through the mouth-gag

图5 插管进入方法Fig.5 Method of the intubation insert

图6 插管到达的部位Fig.6 Parts of the intubation reach
[1]邱永明,田鑫.大鼠简易的气管插管方法[J].上海第二医科大学学报,2001,21(6):576.
[2]陶运明,莫绪明,戚继荣,等.一种新的大鼠气管插管方法[J].中华实验外科杂志,2004,2l(4):504.
[3]Weksler B,Ng B,Lenert J.A simplified method for endotracheal intubation in the rat[J].Journal of Applied Physiology,1994,76(4):1823.
[4]Clary E M,O'HalloranE K, dela Fuente S G,etal.Videoendoscopic endotracheal intubation Of the rat[J].Lab Anim.2004,38(2):158.
[5]Fuentes J M,Hanly E J,Bachman S L,et al.Videoendoscopic endotracheal intubation in the rat:a comprehensive rodent model of laparoscopic surgery[J].The Journal of Surgical Research.2004,22(2):240.
[6]Cambron H,Latulippe J F,Nguyen T,et al.Orotracheal intubation of rats by transillumination[J].Labortary Animal Science,1995,45(3):303.
[7]王响英,吴淑燕,李苏安,等.大鼠直视气管插管方法[J].上海实验动物科学,2004,24(2):107.
