工艺条件对发芽糙米中γ-氨基丁酸含量的影响
2013-05-18陈伟玲
马 涛,陈伟玲
(1.渤海大学化学化工与食品安全学院,辽宁锦州121013;2.沈阳农业大学食品学院,辽宁沈阳110866)
1 材料与方法
1.1 材料与仪器
稻米品种 辽星1号,辽宁省沈阳中稻股份有限公司提供;pH=9.0的硼酸缓冲液、6g/100mL重蒸苯酚溶液、60%乙醇溶液、10%次氯酸钠 济南鸿鑫化工有限公司;γ-氨基丁酸 SIGMA公司。
HH.B11-500电热恒温培养箱 上海跃进医疗器械厂;HH-601A超级恒温水浴锅 江苏省金坛市医疗仪器厂;SC-279GA海尔冰柜;UV1200紫外可见分光光度计 上海正慧工贸有限公司;PB-20标准pH计、1245电子天平 北京赛多利斯仪器系统有限公司;SD-A砻谷机 辽宁省沈阳农业大学水稻研究所;3mm米筛 浙江上虞市五四纱筛厂。
1.2 方法与步骤
1.2.1 糙米发芽 砻谷→谷糙分离→筛选→精选→清洗→浸泡→培养→沥干→检验→烘干→成品发芽糙米
1.2.1.1 糙米的制备及筛选 用实验用的小型砻谷机将稻谷砻壳后得到糙米,用3目的标准不锈钢筛子过筛,得到整米率约为98%的含胚糙米。
1.2.1.2 糙米的人工精选去杂 去除霉变、异色、虫蛀粒、未成熟粒、无胚米及石头等杂质。
1.2.1.3 称样 称取糙米样品20份,每份30g。用于分析糙米发芽的温度和时间与γ-氨基丁酸含量的关系。
1.2.1.4 糙米的清洗 先用自来水冲洗3遍,洗去表面的糠粉和灰尘,沥干后,再用纯净水冲洗3遍。
④中枢神经系统疾病:老年痴呆(Alzheimer's disease,AD)、帕金森病(Parkinson's disease,PD)等神经退行性病变;
1.2.1.5 糙米的浸泡与萌芽 将事先称好的样品30份,每份30g,用细尼龙网包好,设6份为一组,共五组,分别放在24、27、30、33、36℃的恒温水浴中浸泡,浸泡0、3、6、9、12、15h时,从每组中取出一份进行培养。将浸泡过的糙米放入垫有两层滤纸的发芽皿中,置于相对湿度为95%的恒温恒湿培养箱中催芽,设定培养温度与浸泡时的温度相一致。
1.2.1.6 取样 培养0、2、4、6、8、10、12h时分别取样。
1.2.2 γ-氨基丁酸含量的测定 采用比色法。取部分发芽糙米沥干,称量2.5g,加适量蒸馏水研磨匀浆,然后定容至50mL于30℃水浴锅中浸提2h。过滤后取上清夜0.5mL,加入0.2mL硼酸缓冲溶液(pH9.0),1mL浓度为6g/100mL的重蒸苯酚溶液,0.4mL有效氯含量10%的次氯酸钠溶液,充分振荡,置于沸水浴10min,再立即冰浴20min,并不断振荡,待出现蓝绿色后加入2mL体积分数60%的乙醇溶液,再次振荡均匀,静置后于645nm波长处测定其吸光度[5]。
1.2.3 单因素实验 在实验过程中分别考察了浸泡时间(0、3、6、9、12、15h)、培养时间(0、4、8、12、16、20、24h)和发芽温度(24、27、30、33、36℃)对发芽效果的影响,以糙米发芽过程中γ-氨基丁酸含量为评定指标。
1.2.4 响应面实验设计 根据单因素实验确定各因素的取值水平范围,结合Box-Benhnken的中心组合实验设计原理[6-11],分别选取浸泡时间(A)、培养时间(B)、发芽温度(C)作为自变量,每个因素取三个水平(-1、0、1),以芽糙米的γ-氨基丁酸含量作为响应值,设计响应面实验。响应面因素水平编码表如表1所示。

表1 Box-Behnken的中心组合设计因素和水平表Table 1 Factors and levels in Box-Behnken of response surface experiment
2 结果与分析
2.1 γ-氨基丁酸标准曲线的绘制
取准确配制好的0、20、40、60、80、100μg/mL的γ-氨基丁酸标准溶液,按照1.2.2的方法测定其吸光度。
以浓度为横坐标(x),吸光度为纵坐标(y),绘制标准曲线曲线,得回归方程为:
y=0.0052x-0.0057,R2=0.9993,如图1所示。

图1 γ-氨基丁酸的标准曲线Fig.1 Standard curve of γ-aminobutyric acid
2.2 单因素实验
2.2.1 浸泡时间对发芽糙米中γ-氨基丁酸含量的影响 设定培养时间为16h,发芽温度为27℃,不同浸泡时间对发芽糙米中γ-氨基丁酸含量的影响如图2所示。

图2 浸泡时间对γ-氨基丁酸含量的影响Fig.2 Effects of soaking time on the content of γ-aminobutyric acid
如图2所示,γ-氨基丁酸含量随浸泡时间的增大而升高,浸泡9h时,γ-氨基丁酸的含量达到最高,随着浸泡时间继续延长,γ-氨基丁酸含量又逐渐降低。在浸泡9h之前,糙米处于吸水、溶胀阶段,随着水分的增加,酶在溶液中的溶解性越大,谷氨酸在谷氨酸脱羧酶作用下生成γ-氨基丁酸,γ-氨基丁酸的含量呈增长趋势。浸泡时间超过9h后,大部分谷氨酸物质已经转化为γ-氨基丁酸,营养物质也被消耗部分,由于发芽的需要,已生成的γ-氨基丁酸也会被水解,生成率小于水解率,含量会随着浸泡时间的增大而降低。培养时间、发芽温度一定的条件下,γ-氨基丁酸含量最佳的浸泡时间是9h。
2.2.2 发芽温度对发芽糙米中γ-氨基丁酸含量的影响 设定浸泡时间为9h,培养时间为16h,发芽温度对发芽糙米中γ-氨基丁酸含量的影响如图3所示。

表2 响应面设计实验结果Table 2 Response surface test results

图3 发芽温度对γ-氨基丁酸含量的影响Fig.3 Effects of germination temperature on the content of γ-aminobutyric acid
如图3所示,发芽温度由24℃增到27℃时,γ-氨基丁酸含量呈增长趋势;温度高于27℃,随着发芽温度继续升高,γ-氨基丁酸含量呈下降趋势。温度越高,吸水越快,糙米萌芽越快,因为温度适当时会促进γ-氨基丁酸的增长;当温度过高时,在浸泡的时候吸水就过快,可能会破坏细胞的结构,导致营养物质流失,生成γ-氨基丁酸的底物减少,导致γ-氨基丁酸含量降低。浸泡时间、培养时间一定的条件下,γ-氨基丁酸含量最佳的发芽温度是27℃。
2.2.3 培养时间对糙米发芽中γ-氨基丁酸含量的影响 设定浸泡时间为9h,发芽温度为27℃,培养时间对发芽糙米中γ-氨基丁酸含量的影响如图4所示。

图4 培养时间对γ-氨基丁酸含量的影响Fig.4 Effect of culture time on the content of γ-aminobutyric acid
如图4所示,在浸泡后的培养过程中,随着培养时间的延长,γ-氨基丁酸含量升高,培养到16h时达到最高值;培养时间继续延长,γ-氨基丁酸含量逐渐降低。浸泡时间、发芽温度一定的条件下,γ-氨基丁酸含量最佳的培养时间是16h。
2.3 响应面法确定发芽糙米中γ-氨基丁酸含量最佳条件
2.3.1 响应面模型建立及显著性分析 响应面设计实验结果见表2。利用Minitab 15软件的Box-Behnken程序对实验结果进行响应面分析,经二次回归拟合后,得出回归模型参数估计值、方差分析,结果见表3~表4。
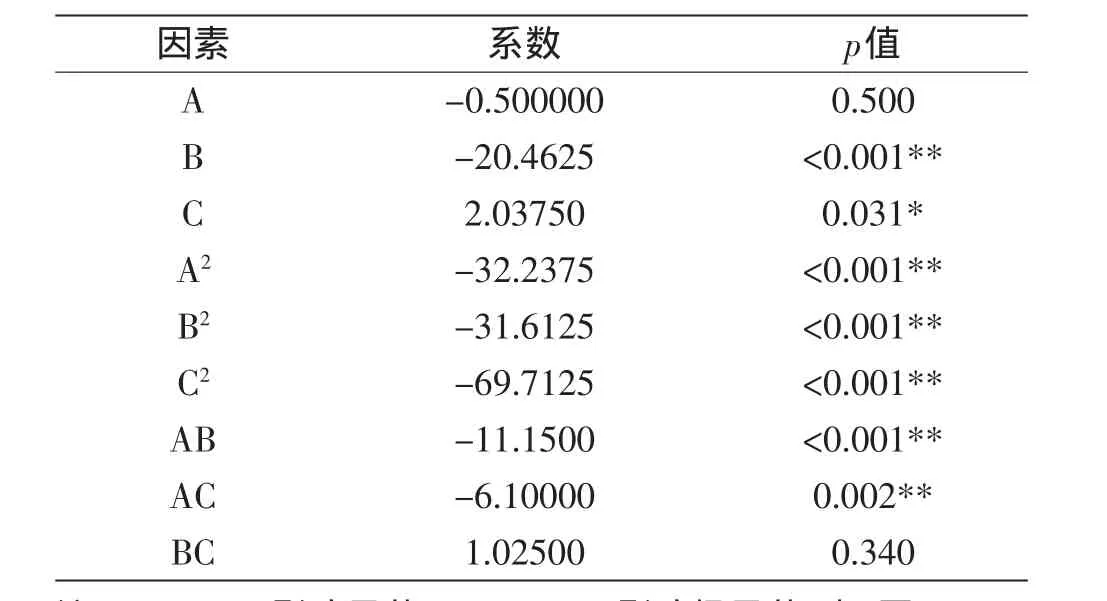
表3 响应面回归方程建立Table 3 Response surface regression for the establishment of equation
从表3可以得到各因素影响程度为:培养时间的影响极显著(p<0.001),发芽温度的影响显著(p=0.031),浸泡时间的影响不显著(p=0.500)。浸泡时间、培养时间、发芽温度的二次项都对γ-氨基丁酸含量的影响极显著,p值都小于0.001;浸泡时间与培养时间的交互作用(p<0.001)、浸泡时间与发芽温度的交互作用(p=0.002)都对γ-氨基丁酸含量的影响极显著。
拟合后得到以γ-氨基丁酸含量为目标函数的二次多项回归模型为:Y=232.1333-0.50000A-20.46250B+2.03750C-32.10417A2-31.47917B2-69.57917C2-11.15000AB-6.10000AC+1.02500BC。
方程中各项系数的绝对值直接反映了各因素对γ-氨基丁酸含量的影响程度,系数的正负反映了影响的方向。

表4 回归模型方差分析Table 4 Analysis of variance for second-order polynomial model fitted to the response variable
表4可知,用上述回归方程描述各因素与响应值之间的关系时,此模型的p<0.01,表明响应回归方程达到了极显著水平,相关系数R2=0.9892,表明98.92%的数据可以用此方程来解释,因而该模型拟合程度良好。实验误差小,适合发芽糙米中γ-氨基丁酸含量进行分析和预测。从模型的失拟性方差分析可以看出,失拟项不显著(p=0.067>0.05),表明该模型稳定,能很好的预测γ-氨基丁酸含量的变化,使用该方程模拟真实的3因素3水平分析可行。
2.3.2 响应面图分析 利用Design Expert 7.0软件对二次回归模型进行规范分析,浸泡时间、培养时间、发芽温度之间交互作用对灭菌率的影响见图5~图7。
响应曲面图可以反映出因素之间交互效应的强弱[11],由图5~图7可以看出,浸泡时间与培养时间、发芽温度之间的交互作用极显著,而培养时间与发芽温度之间的交互作用不显著。由图5可见,根据回归分析方程在考察的区域内绘制的响应面图发生弯曲,说明了因素A、C对Y是非线性的,存在二次项。随着浸泡时间和培养时间的提高,Y值也在增大,当浸泡时间和培养时间升高到一定程度时,Y值达到最大;当浸泡时间和培养时间继续升高时,Y值又会随之下降,说明它们取某个适中值时,可使Y值达到最大。同理,从图5、图6可以看出,A、C,B、C同样对Y的影响是非线性的,存在二次项。可以通过软件优化、模拟得最佳提取条件。
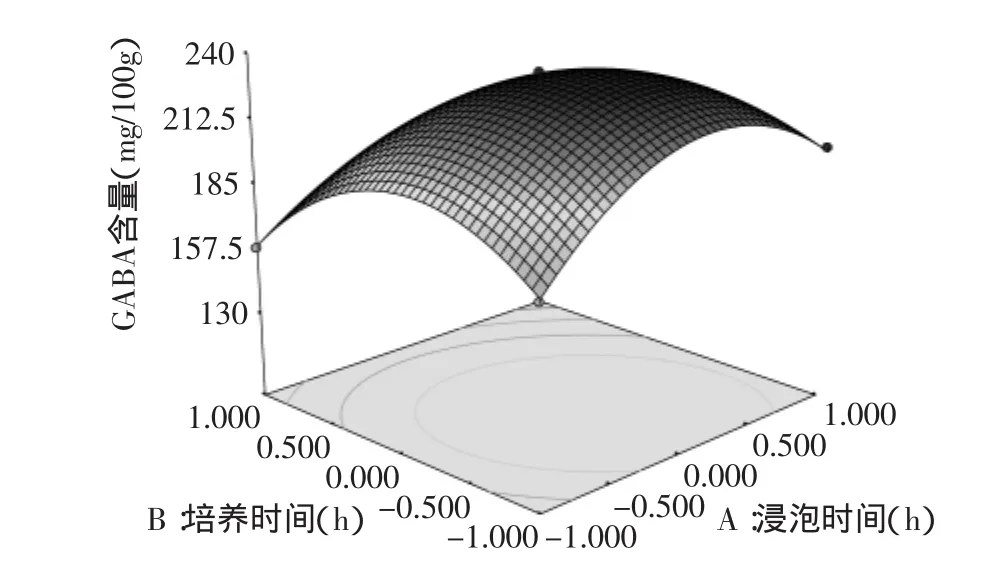
图5 Y=f(A,B)响应面图Fig.5 Response surface of the effects of A and B on the content of γ-aminobutyric acid
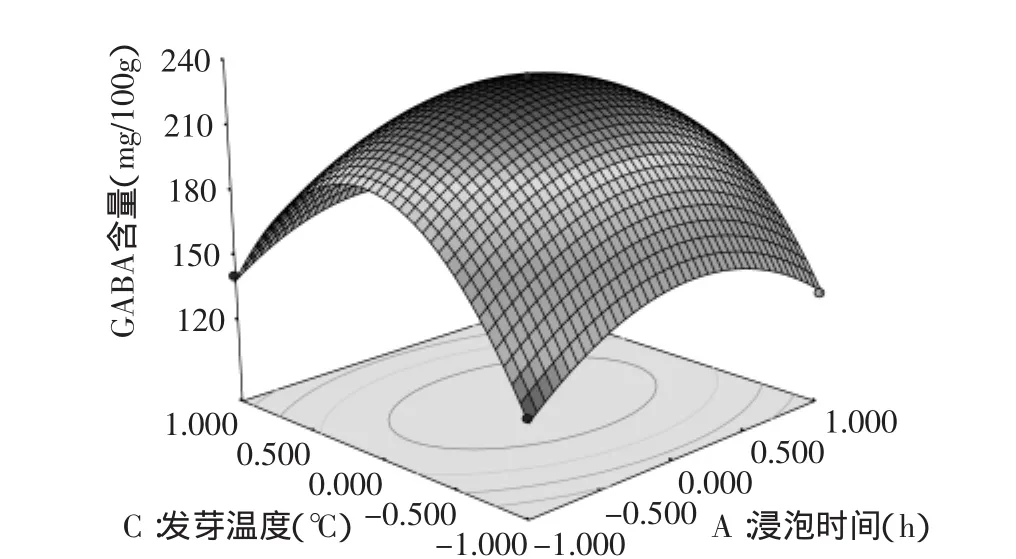
图6 Y=f(A,C)响应面图Fig.6 Response surface of the effects of A and C on the content of γ-aminobutyric acid
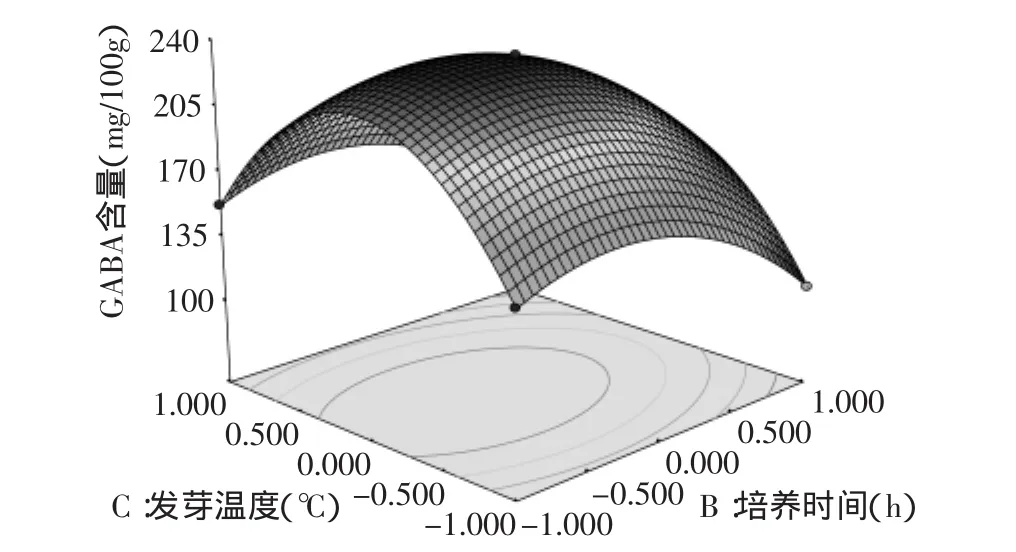
图7 Y=f(B,C)响应面图Fig.7 Response surface of the effects of B and C on the content of γ-aminobutyric acid
2.3.3 最佳条件的确立与检验 为了进一步验证最佳点的值,对回归方程取一阶偏导解得A、B、C的编码值为:A=0.110045、B=-0.430672、C=0.041280。利用编码公式xi=(Xi-X0)/△X对自变量进行求解,其中xi为自变量的编码值,Xi为自变量的真实值,X0为实验中心点处自变量的真实值,△X为自变量的变化步长。因此可以根据编码公式求出自变量A、B、C的预测值为:A=9.330135,B=14.277313,C=27.123841,即浸泡时间为9.330135h,培养时间为14.277313h,发芽温度为27.123841℃;γ-氨基丁酸含量预测值为233.601737mg/100g,近似为233.6mg/100g。为检验响应面的可靠性,在最佳灭菌条件下进行验证实验,考虑到实际操作可行性,将最佳条件修订为:浸泡时间为9.3h、培养时间为14.3h、发芽温度为27℃。此条件下进行平行实验,γ-氨基丁酸平均含量达到232.8mg/100g,表明实际测量值接近预测值,说明该模型是合理有效的具有一定的实际指导意义。
3 结论
根据单因素以及响应面实验,得到了糙米发芽时各因素变量对γ-氨基丁酸含量的回归方程,该模型回归显著,对实验拟合良好,具有一定的应用价值,并得到γ-氨基丁酸含量最佳条件:浸泡时间为9.3h,培养时间为14.3h,发芽温度为27℃,最佳的γ-氨基丁酸含量为232.8mg/100g。因此,通过响应面发对糙米发芽过程中含量进行优化,可获得最佳γ-氨基丁酸发芽工艺条件,从而为进一步实验提供基础。
[1]张群,单杨,吴越辉.糙米在浸泡过程中其主要营养含量变化的研究[J].粮油加工,2006(1):69-70.
[2]黄迪芳,陈正行.发芽糙米[J].粮食与油脂,2004(4):17-18.
[3]孙向东.发芽糙米最新研究进展[J].中国稻米,2005(3):5-7.
[4]王珩,王传梁,陈坤杰.滚筒式发芽糙米研究[J].粮油机械,2007(1):63-65.
[5]陈恩成,张名位,彭超英.比色法快速测定糙米中γ-氨基丁酸含量研究[J].中国粮油学报,2006(1):125-128.
[6]李艳华,梁金钟,范洪臣.响应面法优化γ-聚谷氨酸发酵培养基的研究[J].食品科技,2008(3):45-48.
[7]左爱连,张伟国.利用Design-Expert软件优化丝氨酸羟甲基转移酶产酶培养基[J].生物技术,2008,18(3):45-49.
[8]平芮巾,孙谧,刘均忠,等.响应面法优化海洋细菌MP-2酯酶发酵条件[J].应用与环境生物学报,2008,14(4):548-552.
[9]薛治蒲,李欣,朱文学.响应面法优化丹参叶酚酸超声波辅助提取工艺[J].食品科学,2011,32(12):34-38.
[10]葛菁萍,刘国明,孙红兵,等.响应面法优化玉米芯半纤维素水解条件[J].中国农学通报,2011,27(18):64-68.
[11]谢丽源,谭伟,郭勇,等.响应面法优化桑黄产胞内多糖液体发酵培养基[J].食品科学,2011,32(7):224-228.
