产细菌素弯曲乳杆菌的分离鉴定及细菌素特性初步研究
2013-05-18刘国荣王成涛孙宝国
任 丽,刘国荣,王成涛,孙宝国
(北京工商大学食品添加剂与配料北京高校工程研究中心,食品风味化学北京重点实验室,北京100048)
食品在加工和保藏过程中,极易受到微生物污染而导致腐败变质,采用防腐剂抑制微生物,延缓腐败是当今食品保鲜的重要技术之一。然而,食品中使用的最多是化学防腐剂,影响人体健康,应用越来越受到众多国家的限制。天然生物防腐剂具有安全、无毒、适用性广、性能稳定等优点,因此,开发天然食品生物防腐剂,以替代目前广泛使用的化学防腐剂已成为现代食品工业的重要任务[1-2]。乳酸菌细菌素是乳酸菌在代谢过程中通过核糖体机制合成并分泌到环境中的一类具有抑菌活性的多肽或蛋白类物质,在人体内可降解,具有高效、无抗药性、无毒、无残留等优点,已成为天然食品生物防腐剂研究与开发的热点[3-4]。本实验从西班牙传统色拉米香肠中分离到一株产细菌素的乳酸菌菌株RX-6,为了确定该菌株在分类学上的地位,对其进行了生理生化指标和16S rRNA序列鉴定;并对菌株RX-6所产细菌素的部分特性,包括热敏感性、酸碱耐受性、蛋白酶敏感性及抑菌谱进行了研究。
1 材料与方法
1.1 材料与仪器
菌株RX-6 分离自西班牙传统色拉米香肠;单核细胞增生李斯特菌(Listeria monocytogenes)ATCC 35152 作为指示菌用于细菌素抑菌活性测定实验,加拿大食品安全研究所Mansel W.Griffiths教授提供;大肠杆菌E.coli DH5α 购自Novagen公司;MRS固、液体培养基、TS固、液体培养基、TSYE固、液体培养基、LB培养基 均购自北京陆桥技术有限公司;碳酸钙、2.5mol/L NaOH、2.5mol/L HCl、0.2mol/L Na2HPO4-NaH2PO4(pH7.0)、过氧化氢酶、硫酸铵固体、1000u透析袋 北京蓝弋化工产品有限公司;乳酸链球菌素nisin(1×106IU/g) 美国Sigma公司;细菌基因组DNA提取试剂盒、PCR扩增试剂盒、通用型DNA纯化回收试剂盒、蛋白酶K、溶菌酶、T4 DNA连接酶、克隆载体pGEM-T Easy、小量质粒抽提纯化试剂盒、氨苄西林(Amp) QIAGEN公司;限制性内切酶Eco RI 上海生工生物工程技术服务有限公司;PCR引物 在以大肠杆菌(E.coli)16S rRNA设计的PCR通用引物27F和1492R的基础上,进行个别碱基的调整,得到引物16SF:5′-GAGAGTTTGATCCTGGCTCAG-3′;16SR:5′-CGGCTACC TTGTTACGACTT-3′,由上海生工生物工程技术服务有限公司合成。
pHS-25型酸度计 上海精密科学仪器有限公司;牛津杯(10mm×7.8mm×6mm) 河南新乡美乐食品机械厂;Micro-17R型小型冷冻离心机 美国赛默飞世尔科技;C1000型PCR仪 伯乐生命医学产品(上海)有限公司;Gene Genius型凝胶成像系统 英国Syngene公司。
1.2 实验方法
1.2.1 产细菌素菌株的筛选 以西班牙传统色拉米香肠为筛选样品,首先采用常规平板稀释法挑有碳酸钙溶解圈的单菌落并镜检。然后以琼脂点扩散交叉拮抗实验法[5-6]测试筛选所得乳酸菌菌株的抑菌活性。最后通过牛津杯琼脂扩散法[7]进一步复筛产细菌素菌株。
1.2.2 菌株产细菌素的鉴定 在筛选产细菌素的菌株时需要排除以下三个干扰因素:a.除细菌素外,乳酸菌在生长和代谢过程中,还可以产生许多具有抑菌活性的物质,如乳酸、过氧化氢(H2O2)等;b.某些乳酸菌菌体细胞对其他细菌的生物拮抗作用;c.指示菌——单增李斯特氏菌的可生长pH范围为4.6~9.6,在低于4.6的偏酸性环境中一般不能生长,以确定是细菌素引起的抑菌作用。具体方法为:pH中和法排除有机酸的干扰;过氧化氢酶处理排除H2O2干扰;细菌滤器去除菌体细胞干扰。在此基础上,通过硫酸铵沉淀、透析以及蛋白酶K处理进一步确定抑菌活性物质为蛋白类物质。
1.2.3 细菌素抑菌活性及效价测定方法 采用牛津杯双层琼脂平板扩散法测定细菌素样品的抑菌活性[7],并以标准曲线法测定细菌素的相对抑菌效价[5,8],具体为:以单核细胞增生李斯特菌ATCC 35152为指示菌,以乳酸链球菌素nisin为阳性对照,首先制作细菌素效价标准曲线,然后将待测发酵上清液的抑菌圈直径代入效价回归方程,计算发酵液中细菌素的相对抑菌效价。
1.2.4 产细菌素菌株的鉴定
1.2.4.1 菌体形态及生理生化特征实验 MRS固体平板上观察菌落形态;革兰氏染色后显微镜下观察菌体形态;做各项生理生化实验,包括:糖醇发酵、精氨酸产氨、运动性、接触酶及厌氧生长等。
1.2.4.2 基于16S rRNA基因序列的分子生物学鉴定以细菌基因组DNA提取试剂盒提取菌株RX-6基因组DNA,采用引物16SF和16SR扩增16S rRNA片段,PCR扩增条件为:94℃预变性5min;95℃变性1min,60℃退火30s,72℃延伸1.5min,35个循环后72℃延伸10min;PCR扩增产物经通用型DNA纯化回收试剂盒回收纯化后,连接到克隆载体pGEM-T easy上,并转化E.coli DH5α;采用Amp筛选阳性转化子,提取质粒进行Eco RI酶切分析,鉴定重组菌株,酶切鉴定正确的重组质粒送上海生物工程技术服务有限公司进行测序;将测定的PCR产物序列用BLAST软件与GenBank+EMBL+DDBJ+PDB基因库中已知的16S rRNA序列进行同源性比较和遗传距离计算。从Genebank中选择了近缘菌株的16S rRNA基因序列,采用Clustalx 1.83和Treedrawing软件进行多序列匹配排列,并用系统发育树软件包MEGA 3.1进行统计和聚类分析,最后以UPGMA法构建系统发育树[9]。
1.2.5 菌株所产细菌素的特性研究 按1%的接种量将菌株RX-6接种于新鲜的MRS培养基中,37℃下静置培养。24h后结束培养,8000r/min下离心10min去除菌体细胞,调上清液pH至7.0左右,并以此为细菌素测试样品,进行特性分析。
1.2.5.1 热敏感性 准备6管细菌素样品,1mL/管,分别水浴热处理60℃ 30min、70℃ 30min,80℃ 30min、90℃ 30min、100℃ 30min、121℃ 20min,以未经热处理的样品为对照,测其抑菌活性,做效价分析,结果与对照相比,计算细菌素效价残留百分比。
1.2.5.2 酸碱耐受性 分别取0.5mL的细菌素样品(pH7.0)于试管中,用1mol/L HCl和1mol/L NaOH调其pH分别为2、3、4、5、6、8、10、11,然后37℃温育4h,调pH回至中性(7.0左右),以未调节pH的细菌素样品(pH=7.0)为对照,检测残留抑菌活性。
1.2.5.3 蛋白酶敏感性 将不同蛋白酶配成5mg/mL的溶液,分别取0.1mL置于离心管中,分别加细菌素样品0.4mL,使酶的终浓度为1mg/mL,并调节pH为各酶的最适pH范围内,同时以0.1mL缓冲液加入0.4mL细菌素作为对照,37℃温育4h,调pH回至中性(7.0左右)后检测细菌素活性。
1.2.5.4 抑菌谱 选取单增李斯特菌、伊氏李斯特菌、无害李斯特菌、金黄色葡萄球菌、大肠杆菌、沙门氏菌等14株菌为指示菌,测试细菌素样品的抑菌活性。
2 结果与分析
2.1 效价回归方程
本实验测得效价回归方程为y=0.2009x+2.8876,y表示效价的对数值;x表示抑菌圈直径(单位为mm),R2=0.9939。
2.2 产细菌素乳酸菌的筛选
从样品中初筛到有抑菌作用的菌株47株,复筛后有6株菌仍有抑菌活性。其中,菌株RX-6的抑菌活性最强(970.42AU/mL),因此,选择该菌株为本研究的实验测试菌。
2.3 菌株RX-6产细菌素的鉴定
表1所示为不同处理对菌株RX-6发酵上清液抑菌活性的影响。由该表可以看出,将菌株RX-6发酵上清液pH中和至7.0左右后,进行抑菌实验发现中和酸前后抑菌圈效价基本没有差别;向发酵上清液中加入过氧化氢酶,使其最终浓度为1mg/mL,37℃水浴1h,做抑菌实验发现其抑菌效价值和发酵上清原液的相差很小;经细菌滤器过滤除去菌体细胞后做抑菌实验发现抑菌圈大小与原发酵上清液相比差异不显著(p>0.05),以上三点说明其抑菌活性并不是由有机酸、过氧化氢及菌体细胞引起的。通过60%硫酸铵沉淀粗提发酵上清液中蛋白质,透析除盐后抑菌活性显著增强(1328.46AU/mL,p<0.05),而且蛋白酶K处理后,抑菌活性消失,这些都说明起抑菌作用的是一种蛋白类物质,进而确定乳酸菌菌株RX-6为细菌素产生菌。

表1 不同处理对菌株RX-6发酵上清液抑菌活性的影响Table 1 Effect of different treatments on the inhibitory activity of culture supernatant from strain RX-6
2.4 菌株RX-6的鉴定

图1 RX-6菌体形态特征(1000×)Fig.1 The morphological characteristics of strain RX-6(1000×)
2.4.1 菌落及菌体细胞形态特征 菌株RX-6在MRS固体培养基上生长良好,菌落形态为黄色、扁平、圆形、边缘光滑整齐;37℃培养24h后,MRS液体培养基变浑浊,在显微镜下观察发现,该菌成对或短链状排列,细胞为长杆形,不生芽孢,革兰氏阳性,不运动(图1)。
2.4.2 培养及生理生化特征 菌株RX-6的培养及生理生化特征见表2。综合这些培养特征及生理生化特性,并根据东秀珠等编著的《常用细菌系统鉴定手册》[10]和凌代文编著的《乳酸细菌分类鉴定及实验方法》[11],初步将菌株RX-6鉴定为弯曲乳杆菌(Lactobacillus curvatus)。

表2 菌株RX-6的培养及生理生化特征Table 2 Physiological and biochemical characteristics of strain RX-6
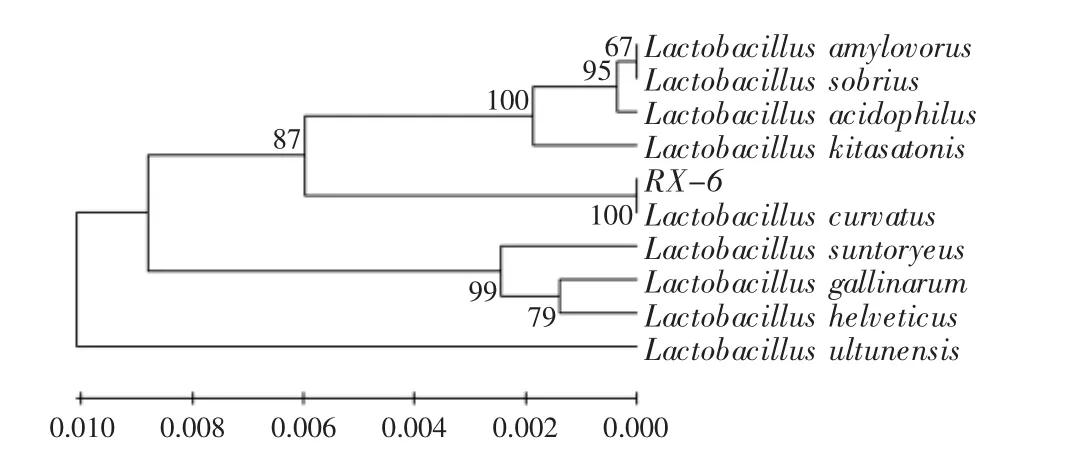
图2 基于16S rRNA序列的系统发育树Fig.2 Phylogenetic tree based on the 16S rRNA sequence of isolate and sepuences of relating species
2.4.3 16S rRNA序列比对及系统发育树的构建 菌株16S rRNA的PCR扩增产物经1%琼脂糖凝胶电泳后,可检测到大约1500bp左右的特异性条带,将其回收纯化后与pGEM-T-easy载体连接,提取阳性质粒进行酶切鉴定,后经上海生物工程技术服务有限公司测序,得到长度为1461bp的16S rRNA序列。通过使用BLAST软件与GenBank+EMBL+DDBJ+PDB中已发表的16S rRNA序列进行同源性比较,结果显示与RX-6菌株的16S rRNA序列同源性较高的均为L.curvatus,选取9个不同种菌株用于多序列比较,应用Clustalx 1.83和MEGA 3.1软件进行多重比较后,采用UPGMA法构建系统发育树(图2)。这些菌株均为乳杆菌属(Lactobacillus spp.)的不同菌种,由系统发育树可知,菌株RX-6与L.curvatus处于同一个小分支,亲缘关系最近,且有高达99.93%的相似度,这同生理生化鉴定得到的结果一致,由此进一步验证了菌株RX-6为L.curvatus。
2.5 菌株RX-6所产细菌素的特性分析
2.5.1 热敏感性 由表3可以看出,菌株RX-6所产细菌素经60~80℃,处理30min,能保持70%以上的活性残留;90℃处理其抑菌活性仅损失约49%;100℃30min、121℃20min的高温处理后仍能保持13%~24%的抑菌活性,说明该细菌素具有很好的热稳定性。食品加工中常用的巴氏杀菌条件为65~80℃15min,而此细菌素在巴氏杀菌的条件下仍保持比较高活性,显示出其在食品加工中的应用前景比较广。
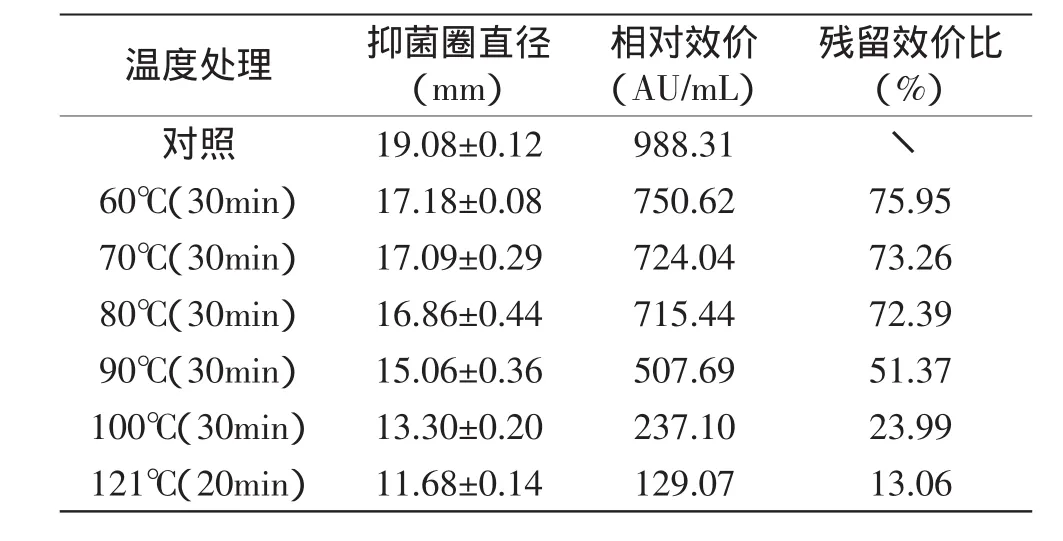
表3 弯曲乳杆菌RX-6所产细菌素的热敏感性Table 3 The heat sensitivity of bacteriocin produced by L.curvatus RX-6
2.5.2 酸碱耐受性 由表4可以看出,菌株RX-6所产细菌素的抑菌活性pH范围为3~10,其中在pH5~8内,活性较高,残留效价比都在84%以上;而pH小于5、大于8时,抑菌活性有所降低,但仍保持约10%~54%的活力。大部分细菌素都是在酸性条件下稳定,有的细菌素在中性或碱性条件下即会失活,但此细菌素在酸性和中性条件下保持稳定,且在碱性条件只会部分失活。这些结果显示该细菌素具有较宽泛的pH活性范围,可在酸性和中性食品中使用。
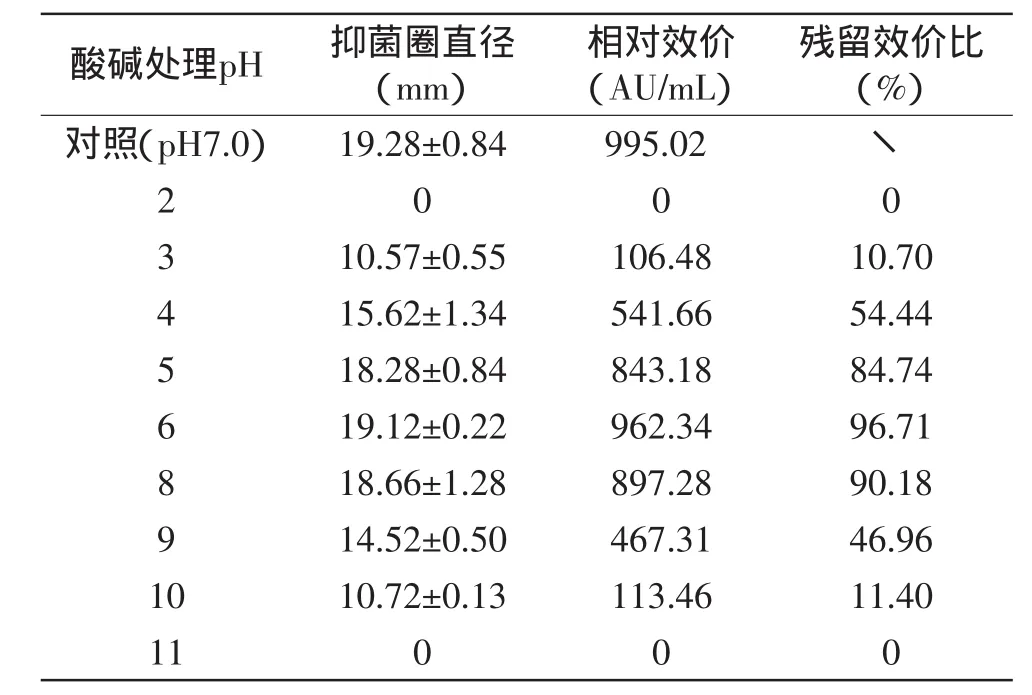
表4 弯曲乳杆菌RX-6所产细菌素的酸碱耐受性Table 4 The acid-base tolerance of bacteriocin produced by L.curvatus RX-6
2.5.3 蛋白酶敏感性 由表5可以看出,菌株RX-6所产细菌素可被胃蛋白酶和胰蛋白酶完全失活,被酸性蛋白酶部分失活,由此可知其为一种蛋白类物质。此外,由于该细菌素可被胃蛋白酶和胰蛋白酶完全失活,而人体肠道内又存在这些酶类,所以其在人体内可被消化而无残留,作为食品防腐剂使用具有很高的安全性。
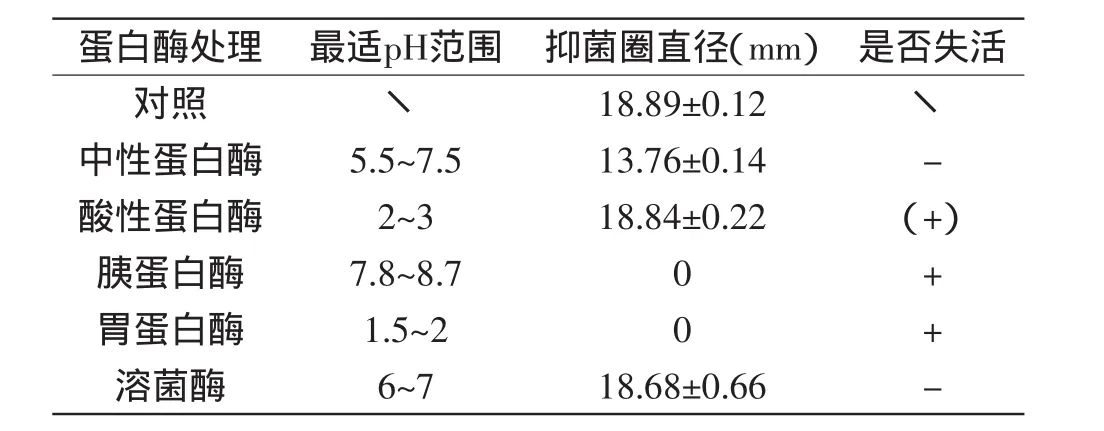
表5 弯曲乳杆菌RX-6所产细菌素的蛋白酶敏感性Table 5 Effect of various protease on bacteriocin produced by L.curvatus RX-6
2.5.4 抑菌谱 由表6可以看出,菌株RX-6所产细菌素对受试的7株李斯特氏菌、3株金黄色葡萄球菌、1株大肠杆菌及1株假单胞菌等都有抑制作用,而对另外2株沙门氏菌无抑制作用。由此结果可以看出,该细菌素有较宽的抑菌范围,不仅对李斯特氏菌、葡萄球菌等革兰氏阳性菌有明显抑制作用,同时对大肠杆菌、假单胞菌等阴性菌也表现抑菌活性,可广泛用于食品的防腐杀菌处理。

表6 弯曲乳杆菌RX-6所产细菌素的抑菌谱Table 6 Antimicrobial spectrum of bacteriocin produced by L.curvatus RX-6
3 结论与讨论
3.1 结论
通过菌体和菌落的形态学观察、生理生化实验以及16S rRNA的分子生物学等方法,对产细菌素菌株RX-6进行了分类学鉴定,最终确定该菌株为弯曲乳杆菌(L.curvatus)。
细菌素特性研究结果显示:菌株RX-6所产细菌素具有很好的热稳定性,可在121℃20min的高温处理后仍保持13%的抑菌活性;具有较好的酸碱耐受性,活性pH范围为3~10;使用安全性高,可被胃蛋白酶和胰蛋白酶完全失活,被酸性蛋白酶部分失活;抑菌谱较广,对受试的7株李斯特菌、3株金黄色葡萄球菌、1株大肠杆菌及1株假单胞菌等都有明显抑制作用。
总之,弯曲乳杆菌RX-6所产细菌素具有很好的食品加工特性,有作为天然食品防腐剂的巨大应用前景,而且该菌株的发现对于丰富乳酸菌细菌素家族和实际生产应用,也具有重要的价值和意义。
3.2 讨论
弯曲乳杆菌(L.curvatus)是人和动物肠道中的正常菌群,也是食品中正常菌群的组成部分,广泛存在于肉制品和发酵食品中。它不仅能影响食品的风味、香气和质地,还能产生乳酸、有机酸、乙醇、过氧化氢、双乙酰和细菌素等许多物质。其中,该菌所产的细菌素,称弯曲乳杆菌素(curvacin),能抑制食品有害菌生长,有望作为新型生物防腐剂用于食品的防腐保鲜,而产生菌株则可以作为益生菌和发酵剂应用于微生态制剂、保健食品以及发酵食品的工业化生产[12-14]。
国外已经发现很多弯曲乳杆菌菌株能产生细菌素,如L.curvatus CRL705、L.curvatus CWBI-B28、L.curvatus LTH1174、L.curvatus IFPL105、L.curvatus FS47、L.curvatus 32Y等[15-20],这些产生菌株主要分离自乳制品、发酵肉制品、发酵蔬菜、青贮饲料、水及其动物肠道等环境中。国外对弯曲乳杆菌素及其产生菌株的研究较多,已对部分curvacin的分离纯化、理化性质、抑菌谱和抑菌机理、遗传特性以及产生菌株的生物学特性都进行了系统研究,其中研究最多、最深入的就是curvacin A,而国内目前还没有相关研究报道,菌株RX-6是国内首次报道的产细菌素弯曲乳杆菌菌株。
与已报道的curvacin A的抑菌谱[17]相比较可以看出,弯曲乳杆菌RX-6所产细菌素的抑菌谱更广,除可以强烈抑制革兰氏阳性菌李斯特菌和金黄色葡萄球菌的生长外,对大肠杆菌和假单胞菌等革兰氏阴性细菌也表现一定抑菌活性,显示出其更广阔的应用前景。
后续工作中,我们将继续对该菌株所产细菌素的提取制备方法、生物学、遗传特性及抑菌作用机理等方面展开研究,以期为该细菌素及产生菌的工业化生产及应用提供更多科学依据。
[1]肖燕清,白卫东,钱敏.我国食品防腐剂的发展现状及对策[J].中国调味品,2011,11(35):43-47.
[2]刘国荣,李平兰,王成涛.乳酸菌细菌素作为天然生物防腐剂在食品工业中的应用进展[J].北京工商大学学报:自然科学版,2012,30(2):64-69.
[3]Cleveland J,Montville T J,Nes I F,et al.Bacteriocins:safe,naturalantimicrobialsforfood preservation[J].International Journal of Food Microbiology,2001,71(1):1-20.
[4]Deegan L H,Cotter P D,Hill C,et al.Bacteriocins:Biological tools for biopreservation and shelf-life extension[J].International Dairy Journal,2006,16(9):1058-1071.
[5]刘国荣,周康,李平兰,等.传统干酪中一株产Ⅱa类细菌素乳酸菌的分离与鉴定[J].食品科学,2007,28(5):185-190.
[6]刘国荣,畅晓渊,吴寒宇,等.长寿老人源产细菌素乳酸菌的筛选与分子生物学鉴定[J].中国微生态学杂志,2009,21(2):100-103.
[7]吕燕妮.戊糖乳杆菌31-1菌株产细菌素研究[D].北京:中国农业大学,2004.
[8]Delgado A,Brito D,Fevereiro P,et al.Bioactivity quantification of crude bacteriocin solutions[J].Microbiological Methods,2005,62(1):121-124.
[9]Holzapfel W H,Haberer P,Geisen R,et al.Taxonomy and important features of probiotic microorganisms in food and nutrition[J].American Journal of Clinical Nutrition,2001,73:365-373.
[10]东秀珠,蔡妙瑛.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[11]凌代文.乳酸细菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1999.
[12]张佩华,谷贵章,张进杰,等.产抗菌素乳酸菌的组合应用对牛肉中李斯特菌污染的抑制作用研究[J].食品工业科技,2011,32(6):118-124.
[13]潘明,汪志君,蒋云升.肉制品发酵剂的研究进展[J].肉类工业,2006(11):31-37.
[14]范素琴,陈鑫炳,王成忠,等.发酵香肠微生物菌种的研究现状[J].肉类工业,2010(3):51-54.
[15]Castellano P,Vignolo G.Inhibition of Listeria innocua and Brochothrix thermosphacta in vacuum-packaged meatby addition of bacteriocinogenic Lactobacillus curvatus CRL705 and its bacteriocins[J].Letters in Applied Microbiology,2006,43(2):194-199.
[16]Ghalfi H,Allaoui A,Destain J,et al.Bacteriocin activity by Lactobacillus curvatus CWBI-B28 to inactivate Listeria monocytogenes in cold-smoked salmon during 4℃storage[J].Journal of Food Protection,2006,69(5):1066-1071.
[17]Vogel R F,Pohle B S,Tichaczek P S,et al.The competitive advantage of Lactobacillus curvatus LTH 1174 in sausage fermentations is caused by formation of curvacin A[J].Systematic and Applied Microbiology,1993,16(3):457-462.
[18]Casla D,Requena T,Gomez R.Antimicrobial activity of lactic acid bacteria isolated from goat’s milk and artisanal cheeses:characteristics of a bacteriocin produced by Lactobacillus curvatus IFPL 105[J].Journal of Applied Bacteriology,1996,81(1):35-41.
[19]Garver K I,Muriana P M.Purification and partial amino acid sequence of curvaticin FS47,a heat stable bacteriocin produced by LactobacilluscurvatusFS47[J].Applied and Environmental Microbiology,1994,60(6):2191-2195.
[20]Gianluigi M,Maria A,Rosamaria A,et al.Francesco spraydrying of bacteriocin-producing Lactic Acid Bacteria[J].Journal of Food Protection,1999,62(7):773-777.
