条斑紫菜提取物的抗氧化性和稳定性研究
2013-05-18姚兴存舒留泉丁群文
姚兴存,舒留泉,丁群文
(淮海工学院海洋学院,江苏连云港222005)
条斑紫菜(Porphyra yezoensis)是东亚地区人工养殖的重要经济海藻,干基中含有25%~50%的蛋白质和25%~40%的碳水化合物[1]。上世纪90年代以来,我国北方沿海条斑紫菜的人工养殖和加工得到了快速发展,不仅满足了国内市场需要,而且出口国外,展现了良好的发展前景。紫菜的加工品主要为淡干紫菜饼等干制品,近几年随着紫菜产量的提高,紫菜加工也逐步向精深加工方向发展,紫菜饮料[2-6]是其中研究热点之一。研究者大多使用浸提法提取紫菜中的有效成分,再辅以其他配料制成不同风味的紫菜保健饮料。紫菜提取物是生产紫菜饮料不可缺少的部分,不仅赋予了紫菜饮料丰富的营养成分和特有风味,而且还具有降血脂、抗凝血、抗肿瘤、抗辐射等生理活性[7-10],但其抗氧化活性的研究尚未见报道。本研究以条斑紫菜为原料,选择合理的提取方法提取紫菜中的有效成分并研究其抗氧化活性,探讨紫菜提取物在通常条件下抗氧化活性的稳定性,为进一步提高紫菜的利用价值提供科学的参考依据。
1 材料与方法
1.1 材料与设备
条斑紫菜 购于本地超市的淡干产品,实验室中将干紫菜50℃烘干至质量恒定,高速粉碎机粉碎,100目过筛后超临界CO2流体萃取脱除脂肪,储于广口瓶中干燥保存;二苯代苦味酰基(DPPH)自由基 美国Sigma公司;硫酸亚铁、蒽酮、铁氰化钾、硫代巴比妥酸(TBA)、抗坏血酸、牛血清白蛋白 上海生工有限公司;二丁基羟基甲苯(BHT) 为进口分装;其他化学试剂 均为国产分析纯。
T6新世纪紫外可见分光光度计 北京普析通用仪器有限责任公司;Primo R多用途台式高速冷冻离心机 美国热电公司;多功能酶标仪 美国Bio-Tek公司;S20 pH计 梅特勒-托利多仪器(上海)有限公司;KS-300超声波细胞粉碎机 宁波科生仪器厂。
1.2 实验方法
1.2.1 紫菜提取物的制备 紫菜提取物的制备采用浸提法[11]。称取适量紫菜干粉5份,分别加入30倍的0.5mol/L盐酸、5%柠檬酸、0.5mol/L醋酸、0.5mol/L碳酸钠溶液和水,超声波破碎10min,50℃恒温水浴浸提2h,4800r/min离心15min,取上清液定容后即得上述5种不同提取剂的紫菜提取物溶液。
1.2.2 二苯代苦味酰基自由基(DPPH自由基)清除能力测定 采用DPPH自由基清除率的体外实验法[12-13]。取紫菜提取物或BHT溶液2mL,加入0.1mmol/L DPPH自由基无水乙醇溶液2mL,混匀后在室温下避光反应30min,在517nm下测定吸光度,空白组以等体积无水乙醇溶液代替DPPH溶液,对照组以等体积蒸馏水代替样品溶液,并以等体积蒸馏水和无水乙醇混合液空白调零。紫菜提取物或BHT对DPPH自由基的清除效果用DPPH自由基清除率表示,按下式计算:
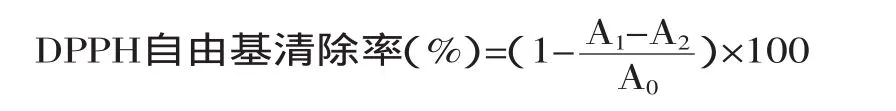
式中:A0为对照组吸光度;A1为样品组吸光度;A2为空白组吸光度。
1.2.3 还原能力测定 取样品液1.0mL,加入0.2mol/L pH6.6的磷酸缓冲液1mL及1g/100mL铁氰化钾溶液1.0mL,于50℃水浴反应20min后急速冷却,再加入10g/100mL三氯乙酸溶液1.0mL,振荡均匀后,3000r/min离心10min,取上清液2.5mL,加入蒸馏水2.0mL和0.1g/100mL FeCl3溶液0.5mL,混合均匀,静置10min后于700nm处测定其吸光度[14]。
1.2.4 紫菜提取物主要成分的测定 总糖含量测定:蒽酮比色法[15];蛋白质含量测定:Bradford法[16];无机盐含量参照国家标准GB 5009.4-2010食品中灰分的测定。
1.2.5 响应面实验设计 采用单因素实验考察料液比、盐酸浓度、提取温度、时间对DPPH自由基清除率的影响,响应面分析法优化关键因素,以获得条斑紫菜提取物的最佳提取工艺条件。
依据Design Expert 8.0软件,采用中心组合设计(Central Composite Design)建立数学模型。以料液比(A)、盐酸浓度(B)、温度(C)三个关键因素为自变量,以1、0、-1分别代表自变量的高、中、低水平,共设立15个处理组。因子编码和水平的取值如表1所示。
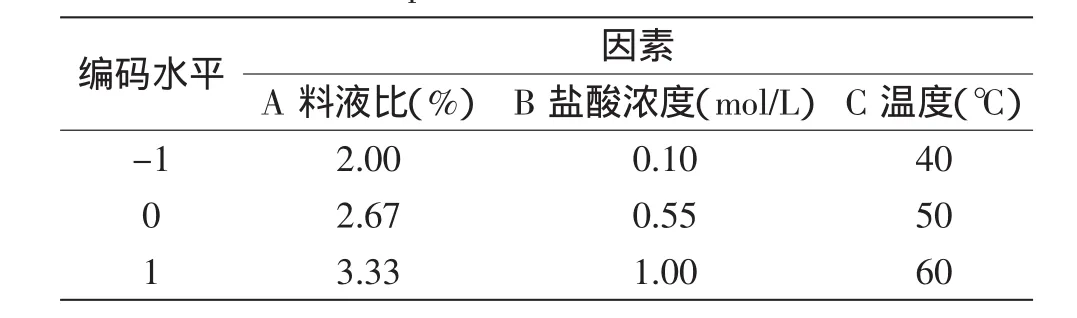
表1 响应面三因素三水平实验设计Table 1 The three-factor and three-level design of the response surface method
1.2.6 数据统计与分析 使用SPSS 13.0软件对数据进行统计分析,所有数据均用平均值±标准差表示,n=3。
将表示紫菜提取物生物活性大小的IC50定义为自由基清除率50%时的有效物质质量浓度(mg/mL),数值越小,活性越大。测定方法:将1.2.1制备的紫菜提取物稀释成不同浓度梯度溶液,分别测定对DPPH自由基的清除率,以质量浓度(mg/mL)为横坐标,自由基清除率(%)为纵坐标绘制曲线,计算出清除率50%时的质量浓度,即为IC50值。
1.2.7 紫菜提取物抗氧化稳定性的测定 按照参考文献[17]的方法。将紫菜提取物放置于不同温度的水浴中2h,测定DPPH自由基的清除率,研究温度对稳定性的影响。加入金属离子Na+、K+、Ca2+后使溶液达到不同的金属离子浓度并常温放置2h,测定DPPH自由基的清除率,研究金属离子对稳定性的影响。将紫菜提取物用NaOH调至不同pH,测定DPPH自由基的清除率,研究pH对稳定性的影响。将紫菜提取物放置在自然光下常温保存,每间隔3d取样测定DPPH自由基的清除率,研究光照时间对稳定性的影响。
2 结果与讨论
2.1 最佳提取介质的确定
使用0.5mol/L盐酸、5%柠檬酸、0.5mol/L醋酸、水、0.5mol/L碳酸钠溶液等不同提取介质提取紫菜的抗氧化活性成分,稀释16倍后测定不同紫菜提取物的DPPH自由基的清除率,同时将其放入烘箱中恒温烘干,所得残留物减去所添加的提取剂后计算紫菜提取物中固形物的含量,结果见图1。

图1 不同提取介质DPPH自由基清除率和固形物含量Fig.1 The DPPH free radical scavenging rate and solid content from different extraction media
由图1可以看出,0.5mol/L盐酸提取物清除DPPH自由基的清除率最高,纯水提取物清除DPPH自由基的清除率最低,5%柠檬酸、0.5mol/L醋酸、0.5mol/L碳酸钠提取物清除DPPH自由基的清除率介于二者之间。而紫菜提取物中的固形物含量同样是这样的大小顺序。因此从清除DPPH自由基的清除率、提取物固形物含量2个方面选择提取介质,0.5mol/L盐酸皆为最佳选择。
2.2 盐酸提取法提取工艺条件的响应面优化
采用单因素试验考察料液比、盐酸浓度、提取温度、提取时间、颗粒细度等5个因素的影响,得到的最佳提取条件为料液比1:40、盐酸浓度0.5mol/L、温度50℃、时间90min、颗粒细度150目。通过SPSS 13.0软件分析,选取料液比、盐酸浓度、提取温度等3个相对重要因素,经Design Expert8.0软件设计三因素三水平实验优化提取条件,实验结果见表2,方差分析见表3。

表2 响应面实验方案与结果Table 2 Design and results of the response surface method
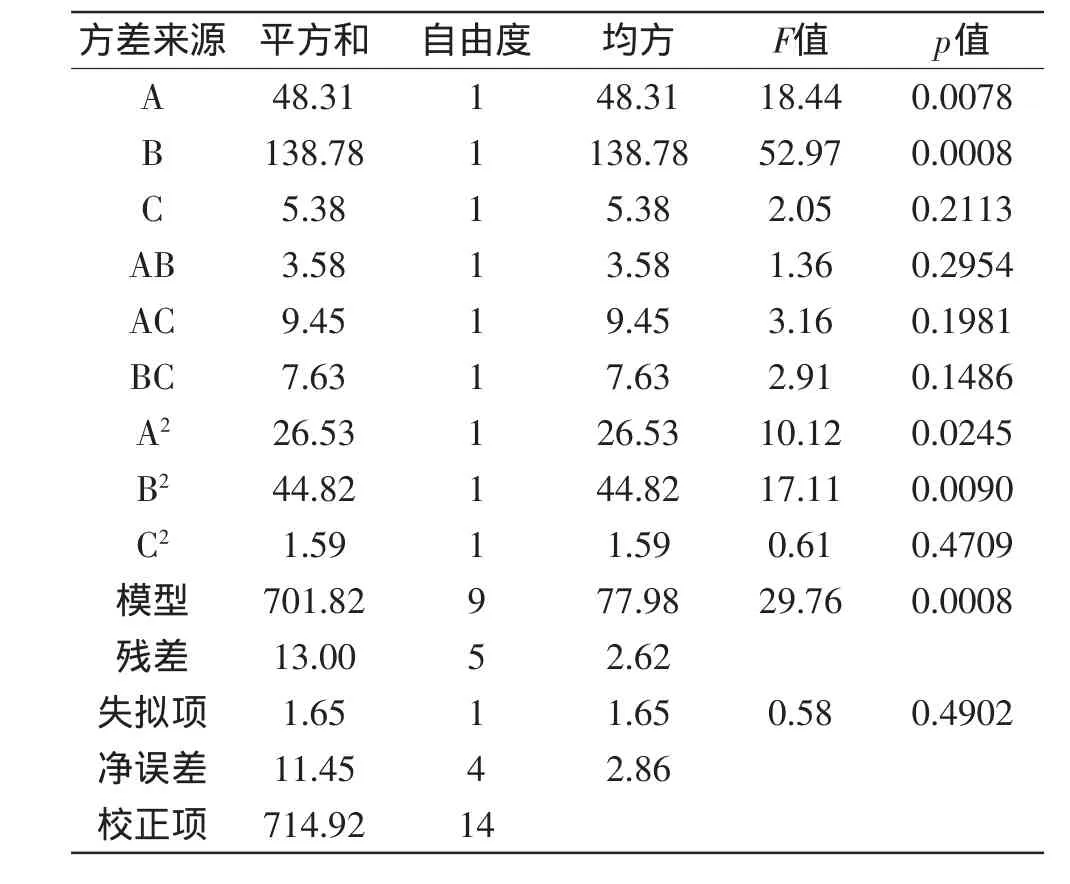
表3 方差分析结果Table 3 Analysis of variance
表3方差分析结果可以看出模型显著(p<0.05)、失拟项不显著(p>0.05),说明实验结果可靠。回归方程可以表示为Y=76.83+4.92A+8.33B+1.64C-1.64AB+2.66AC-2.39BC-3.18A2-4.14B2+0.78C2,相关系数R2=0.9680。响应面实验结果优化的提取条件是:盐酸浓度0.78mol/L,料液比3.33%(1∶30),提取温度60℃,提取时间1.5h,理论预测清除率为84.17%。为了验证响应面法的可行性,采用上述提取条件做验证实验,3次平行实验的平均提取率为82.56%±0.78%,相对误差为1.91%,说明响应面法优化后的工艺条件重复性好,具有实际应用价值。
2.3 紫菜提取物中主要成分分析
对盐酸提取法得到的紫菜提取物进行主要成分分析,测定结果以各成分的含量占总固形物的比例表示,结果见表4。

表4 紫菜提取物中主要成分含量Table 4 The content of main components in the Porphyra yezoensis extract
紫菜中含有丰富的碳水化合物、蛋白质和无机盐等,当使用稀盐酸做提取介质时,这些水溶性成分能被提取出来。由表4可知,紫菜提取物中以上3种主要成分占全部固形物总量的96.08%,余下部分应为游离氨基酸、水溶性维生素、色素等,含量较少。
2.4 紫菜提取物的还原能力
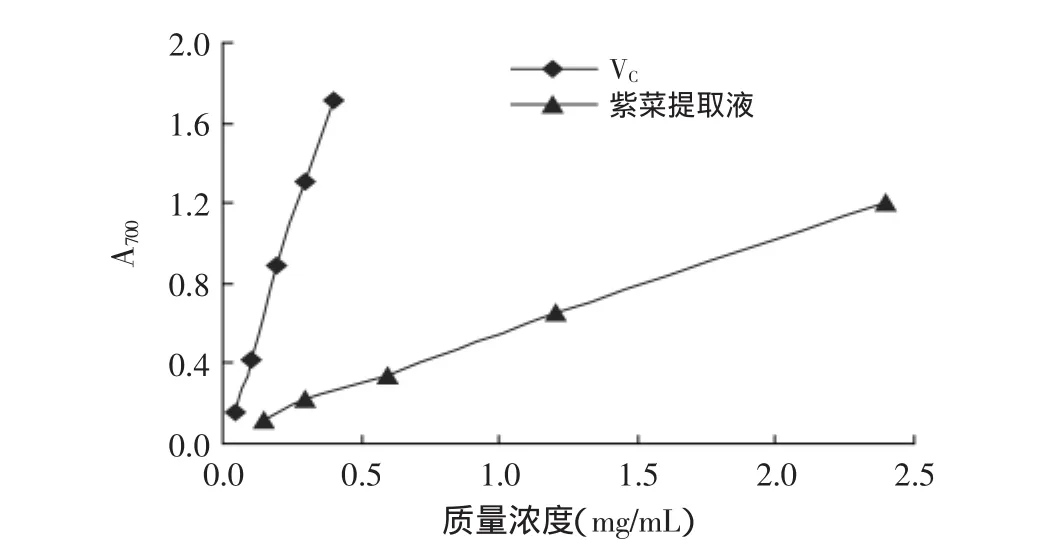
图2 紫菜提取物与抗坏血酸的还原能力Fig.2 The reduction ability of the Porphyra yezoensis extract and ascorbic acid
由图2可见,在研究的质量浓度范围内,表示还原能力的指标—吸光度随着紫菜提取物质量浓度的增加而增大,即还原能力逐渐增强。紫菜提取物具有较强的还原能力,但低于同质量浓度的抗坏血酸(VC)。紫菜提取物还原力小于VC,可能是紫菜提取物中有效成分的-OH数量少于VC。
2.5 紫菜提取物清除DPPH自由基能力
表5是将紫菜提取物稀释成不同浓度,分别测定DPPH自由基清除率的实验结果,得到标准回归方程为y=27.516ln(x)+67.095,R2=0.9891。经计算紫菜提取物清除DPPH自由基IC50为0.537mg/mL,同样方法可测得阳性对照物BHT清除DPPH自由基IC50为0.209mg/mL。由此可见,紫菜提取物清除DPPH自由基IC50大于BHT,说明紫菜提取物清除DPPH自由基能力弱于BHT,但仍显示出较强的抗氧化活性。

表5 紫菜提取物清除DPPH自由基能力Table 5 DPPH free radical scavenging capacity of the Porphyra yezoensis extract
2.6 紫菜提取物抗氧化活性的稳定性
2.6.1 温度对紫菜提取物活性稳定性的影响 由图3可以看出,温度对紫菜提取物抗氧化活性有一定的影响,清除率的变化显著(p<0.05),而且随着温度的升高,在50~90℃之间,紫菜提取物的抗氧化性有一定程度的上升,90℃左右趋于稳定。出现这种现象,是紫菜提取物中碳水化合物(琼胶)和水溶性蛋白质在较高的温度和盐酸的共同作用下发生了一定程度的水解而产生的,因为他们的水解产物—单双糖或寡肽等物质的生物活性更强。但是,并非紫菜提取物保存温度越高越好,相反,保持紫菜提取物生物活性的相对稳定更有利于产品品质的稳定,因此,紫菜提取物仍以低温环境保存为宜。

图3 温度对紫菜提取物抗氧化活性稳定性的影响Fig.3 Effect of temperature on antioxidant stability of the Porphyra yezoensis extract
2.6.2 金属离子对紫菜提取物活性稳定性的影响
由图4可以得出,用不同浓度的Na+、K+、Ca2+处理后的紫菜提取物对DPPH自由基清除作用的影响并不明显,金属离子浓度的增加使得清除率的下降也是不显著(p>0.05)。从金属离子的种类来看,Na+对DPPH自由基的清除率影响最大,K+最小。由此可见,紫菜提取物对金属离子比较稳定。

图4 金属离子对紫菜提取物抗氧化活性稳定性的影响Fig.4 Effect of metal ions on antioxidant stability of the Porphyra yezoensis extract
2.6.3 pH对紫菜提取物活性稳定性的影响 由图5可见,随着pH升高,DPPH清除率缓慢增大,pH6时清除率最大,但pH<6范围内,清除率的变化不显著(p>0.05)。当pH>6后清除率迅速下降,且清除率变化显著(p<0.05),由此可见,紫菜提取物在酸性环境下比较稳定,碱性环境不稳定。因此,紫菜提取物应保存在酸性环境中,避免受到强碱的破坏。

图5 pH对紫菜提取物抗氧化活性稳定性的影响Fig.5 Effect of pH on antioxidant stability of the Porphyra yezoensis extract
2.6.4 光照时间对紫菜提取物活性稳定性的影响由图6可以看出,在紫菜提取物常温放置的18d内,DPPH自由基清除率随光照时间的延长而产生一定的波动,但波动幅度较小,差异不显著(p>0.05)。因此,光照对紫菜提取物的生物活性并无影响,从这个意义上来说,制成产品后无须避光保存。

图6 光照时间对紫菜提取物活性稳定性的影响Fig.6 Effect of lighting time on antioxidant stability of the Porphyra yezoensis extract
3 结论
考虑到制备紫菜提取物的主要用途为食用,选择的提取剂应无毒无害,本研究仅在盐酸溶液等5种提取介质中进行比较优选。盐酸作为提取介质得到的紫菜提取物,其DPPH自由基清除率及固形物含量都是最大。通过单因素实验和响应面法优化后的提取条件是:盐酸浓度0.78mol/L,料液比1∶30,提取温度60℃,提取时间1.5h。紫菜提取物的主要成分是糖类、蛋白质和无机盐,3者占到全部固形物总量的96.08%。
紫菜提取物具有显著的抗氧化活性。还原能力较强但低于同质量浓度的VC,清除DPPH自由基IC50为0.537mg/mL。在影响紫菜提取物稳定性因素中,pH的影响最大,保存温度次之,而金属离子和光照时间对清除率的影响最不明显,因此紫菜提取物应保存于酸性环境中,对光照和金属离子则无特别要求。
[1]Lahaye M,Jegou D.Chemical and physical-chemical characteristics of dietary fibres from Ulva lactuca,Thuret and Enteromorpha compressa[J].Journal of Applied Phycology,1993,5(2):195-200.
[2]伍宏,王茵,吴成业.一种保健型紫菜复合饮料的研制[J].食品研究与开发,2012,33(3):78-82.
[3]沈照鹏,刘蓓,高笑,等.紫菜精素饮料的研制[J].食品科技,2011,36(12):103-107.
[4]张付云,张海,胡渊.风味紫菜饮料的研制[J].食品研究与开发.2009,30(8):51-53.
[5]姚兴存,舒留泉,张瑛.紫菜苹果汁复合饮料工艺技术研究[J].饮料工业,2009,12(6):21-24.
[6]钟细娥,雷晓凌,王宇辉.紫菜复合饮料的研制[J].食品研究与开发,2004,25(6):46-47.
[7]吕钟钟,罗建光,管华诗.紫菜的生物活性研究进展[J].中国海洋大学学报,2009,39(5):47-51.
[8]叶翠芳.紫菜提取物及其抗紫外辐射活性的研究[D].广州:暨南大学,2012.
[9]Yoshizawa Y,Enomoto A,Todoh H,et al.Activity of marine macrophages by polysaccharides fractions from marine algae(Porphyra yezoensis)[J].Biosci,Biotech Biochem,1993,57(11):1862-1866.
[10]Yoshizawa Y,Ametani A,Tsunehiro J,et al.Macrophage stimulation activity of the polysaccharide fraction from a marine alga(Porphyra yezoensis):Structure-function relationships and improvedsolubility[J].Bioscience,BiotechnologyandBiochemistry,1995,59(10):1933-1937.
[11]颜栋美,于兰.脱腥海带饮料的研制[J].食品科学,1994,15(8):37-39.
[12]CHENG Zhihong,MOORE J,YU Liangli.High-throughput relative DPPH radical cavenging capacity[J].Journal of Agricultural and Food Chemistry,2006,54(20):7429-7436.
[13]KAUR G,JABBAR Z,ALAMMS,et al.Punica granatum(pomegranate)flower extract possesses potent antioxidant activity and abrogates Fe-NTAinduced hepatotoxicity in mice[J].Food and Chemical Toxicology,2006,44(7):984-993.
[14]YEN G C,CHEN H Y.Antioxidant activity of various tea extracts in relation totheirantimutagenicity[J].Journalof Agricultural and Food Chemistry,1995,43(1):27-32.
[15]张水华.食品分析实验[M].北京:化学工业出版社,2009:43.
[16]陆健.蛋白质纯化技术及应用 [M].北京:化学工业出版社,2005:278-281.
[17]孟良玉,卢佳琨,兰桃芳,等.蜂胶提取物抗氧化稳定性研究[J].食品科学,2012,33(7):127-130.
