产α-葡萄糖苷酶抑制剂乳酸菌的筛选及发酵条件优化
2013-05-17周方方吴正钧
韩 瑨,季 红,周方方,吴正钧
乳业生物技术国家重点实验室光明乳业股份有限公司,上海200436
Ⅱ型糖尿病,又称非胰岛素依赖型糖尿病,占糖尿病总数的85%以上,主要由胰岛素抵抗和胰岛素分泌缺陷造成,相比Ⅰ型糖尿病(胰岛素依赖型)只能依赖注射胰岛素来完成糖代谢的单一治疗方法,Ⅱ型糖尿病可选择胰岛素增敏剂、促胰岛素分泌剂、α-葡萄糖苷酶抑制剂(α-GI)等多种方式来对餐后血糖进行调控。由于促胰岛素分泌剂往往伴有低血糖[1]、体重增加[2]等副作用,而胰岛素增敏剂又会加大患者的心血管疾病的风险[3],因此,调控作用温和持久、毒副作用小甚至无毒的α-GI成为目前治疗Ⅱ型糖尿病的首选药物。
麦芽糖酶(maltase,EC 3.2.1.20)是一类典型的α-葡萄糖苷酶,它可从低聚糖类底物(麦芽糖)的非还原性末端切开α-1,4糖苷键,释放出葡萄糖(如图1)。人体小肠中的麦芽糖经麦芽糖酶作用生成葡萄糖,再经主动运输被肠上部粘膜细胞吸收入血液,因此,借助α-GI抑制小肠体内的麦芽糖酶活性的方式来降低淀粉质食物在肠道消化吸收的效率,是调节餐后血糖水平的有效方法。
到目前为止,经过体外模型筛选,已经有120多种药用植物被证明含有α-GI,并且其中三分之一药用植物所含的活性单体已经被确认[4]。Dong-Sun Lee等从大豆中获得一种异黄酮Genistein(金雀异黄酮,4,5,7-三羟异黄酮)对 α-糖苷酶有抑制活性[5]。此外,海洋无脊椎动物(如海筒螅、海燕、刺参和毛蚶)的粗提物也表现出对(-葡萄糖苷酶较强的抑制活性。与上述植物和动物来源的α-GI相比,微生物来源的α-GI的研究报导较少,大部分研究工作集中于放线菌(阿卡波糖、伏格列波糖的产生菌)、芽孢杆菌(米格列醇的产生菌)以及链霉菌(脱氧野尻霉素的产生菌),而关于乳酸菌产物降血糖的报道数量相当有限。因此,本研究从筛选高产乳酸菌、优化发酵条件、提高产量入手,对乳酸菌来源的α-GI进行了初步研究。

图1 麦芽糖酶催化麦芽糖水解为葡萄糖Fig.1 Hydrolysis ofmaltose to glucose catalyzed by maltase
1 材料与方法
1.1 菌种与试验材料
菌种:植物乳杆菌ST-III(L.plantarumCGMCC 0847,由光明乳业股份有限公司提供),L.plantarumATCC14917、L.caseiATCC393、L.caseiATCC334(从ATCC 购买),L.plantarumWCFS1(从 TI Food and Nutrition,Wageningen,Netherlands购买),L.bulgaricusLB-340(由丹尼斯克公司提供),S.thermophilusST-BODY-3(由科·汉森有限公司提供)。
试验材料:MRS培养基(Merck,德国),M17液体培养基(Merck,德国),大豆(Glycine max Merrill),1 mol/L氢氧化钠溶液,麦芽糖(Sigma,美国)、麦芽糖酶(EC 3.2.1.20,Sigma,美国)、葡萄糖测定试剂盒(普利莱基因技术有限公司,中国)。
1.2 试验方法
1.2.1 发酵种子液的制备
分 别 将L.plantarumST-III、L.plantarumATCC14917、L.plantarumWCFS1、L.bulgaricusLB-340、L.caseiATCC334、L.caseiATCC393 接种于 MRS液体培养基,S.thermophilusST-BODY-3接种于M17液体培养基,37℃静置培养24 h后,培养物9,000 rpm离心10 min,弃去上清,菌体用无菌蒸馏水洗涤2次后,用原培养体积相同的无菌蒸馏水悬浮,混匀后即得发酵种子液。
1.2.2 活菌计数方法
采用MRS平板计数法
1.2.3 豆浆的制备
将大豆与水按1∶9(w/v)的比例配置,于37℃浸泡8 h,弃去水,补充与弃去水相同体积的蒸馏水,用豆浆机制得固形物含量为10%(w/v)的豆浆,经蒸馏水稀释至指定固形物浓度,118℃、15 min灭菌,得到指定固形物浓度的无菌大豆豆浆。
1.2.4 发酵样品预处理
发酵豆浆样品沸水浴5 min灭活后,冷却至室温,用1 mol/L NaOH 调至 pH 6.80,15,000 rpm 离心10 min,取上清,即得预处理样品,置于-85℃深冷冰箱保存以备检测。
1.2.5 对麦芽糖酶抑制活性的测定
采用葡萄糖测定试剂盒-氧化酶法(GOD法)[6],如表1所示,按从上而下的顺序依次加入各试剂,摇匀,置于37℃水浴保温30 min,沸水浴5 min反应终止后,15,000 rpm离心2 min,取上清按1∶39(v/v)与葡萄糖测定试剂盒工作溶液混合,摇匀,37℃水浴20 min,测定在λ =550 nm(Specord 205,Jena,德国)的吸光度,根据葡萄糖标准曲线计算各管中葡萄糖的含量。发酵豆浆样品对麦芽糖酶的抑制活性按下列公式计算:
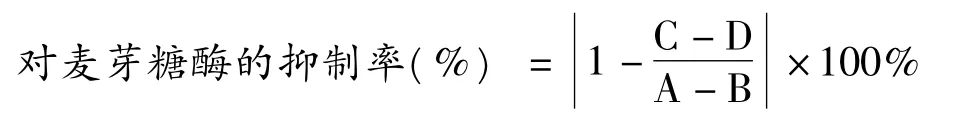
其中A:加入空白样品后麦芽糖酶反应体系中葡萄糖的含量;
B:空白样品原有的葡萄糖含量;
C:加入待测样品的麦芽糖酶反应体系中葡萄糖的含量;
D:待测样品原有的葡萄糖含量。
1.2.6 乳酸菌的筛选
根据1.2.3所述方法,制备固形物含量为5%(w/v)的无菌豆浆。然后按2%(v/v)接种量接入1.2.1中所述各菌株的发酵种子液,37℃培养24 h,分别在16 h和24 h取样获得发酵豆浆样品。上述发酵豆浆样品经1.2.4所述方法预处理后,测定其对麦芽糖酶的抑制效果。
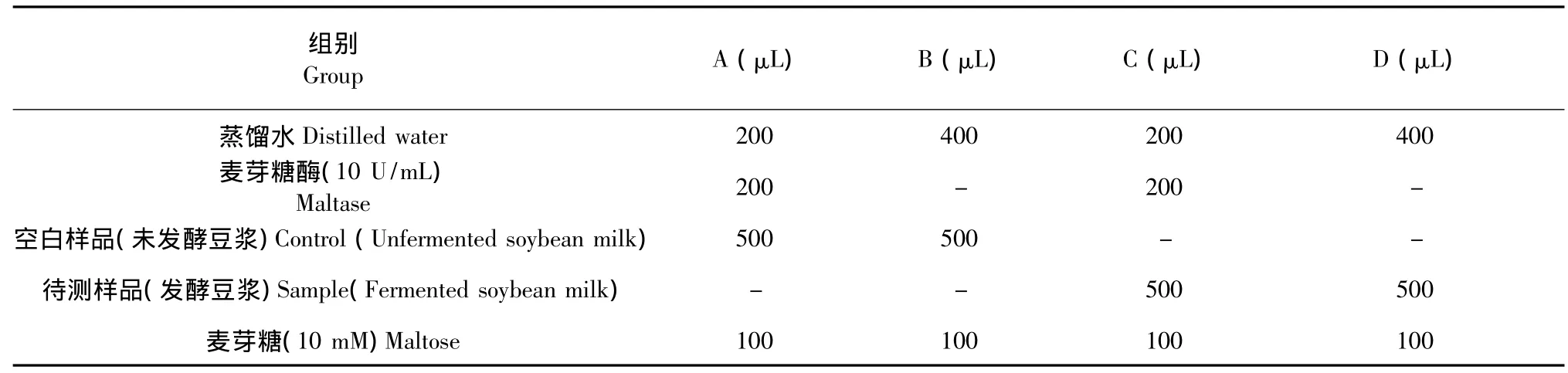
表1 样品对麦芽糖酶抑制作用的测定Table 1 The inhibitory effects of samples on maltase activity
1.2.7 不同接种量对发酵大豆豆浆产物抑制麦芽糖酶活性的影响
分别将植物乳杆菌ST-III的发酵种子液(活菌总数为 1.0 ×109cfu/mL)按 0.5%、1%、2%、4%(v/v)的接种量接入固形物含量为5%(w/v)的灭菌大豆豆浆中,接种后植物乳杆菌的活菌数为5.0×106至4.0×107cfu/mL,37 ℃静置培养 48 h,间隔取样,样品经预处理后,测定其对麦芽糖酶的抑制效果。
1.2.8 发酵不同浓度大豆豆浆的产物对麦芽糖酶抑制活性的影响
将植物乳杆菌ST-III的发酵种子液以2%(v/v)接种量无菌操作分别接入固形物含量为3%、5%、7%、9%(w/v)的灭菌大豆豆浆中,37℃静置48 h,间隔取样,样品经预处理后,测定其对麦芽糖酶的抑制效果。
1.2.9 不同温度下发酵大豆豆浆的产物对麦芽糖酶抑制活性的影响
将植物乳杆菌ST-III的发酵种子液以2%(v/v)接种量无菌操作接入固形物含量为5%(w/v)的灭菌大豆豆浆中,分别在25、30、37、40℃静置培养48 h,发酵终点的豆浆样品经预处理后,测定其对麦芽糖酶的抑制效果。
1.2.10 优化条件下获得的大豆豆浆发酵产物对麦芽糖酶抑制活性的影响
在固形物含量5%(w/v)的灭菌大豆豆浆中,以2%(v/v)接种植物乳杆菌ST-III的发酵种子液,37℃静置培养24 h,测定不同时间的发酵豆浆经预处理后的样品对麦芽糖酶的抑制作用。
2 结果与讨论
2.1 乳酸菌的筛选
不同乳酸菌的发酵种子液以2%(v/v)接种量接入固形物含量为5%(w/v)的无菌大豆豆浆中,37℃培养24 h,测定在16 h和24 h获得的发酵豆浆经预处理后的样品对麦芽糖酶的抑制效果,结果如图2所示。
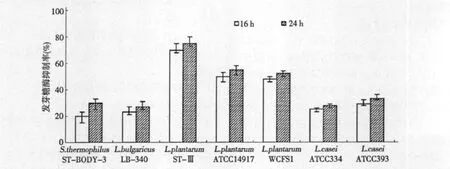
图2 不同乳酸菌的豆浆发酵产物对麦芽糖酶的抑制效果Fig.2 Maltase inhibition activities of fermented soybeanmilk by different Lactic acid bacteria
三株植物乳杆菌的对麦芽糖酶抑制效果显著,为50% ~75%,其中,植物乳杆菌ST-III发酵大豆豆浆后的产物对麦芽糖酶抑制能力最强,达到75%,L.plantarumATCC14917与L.plantarumWCFS1抑制麦芽糖酶的效果仅次于ST-III,分别为50%和55%,其他2株干酪乳杆菌、1株保加利亚乳杆菌、1株嗜热链球菌发酵产物的抑酶效果为20~30%,与3株植物乳杆菌发酵产物的抑制能力差异较明显。表明植物乳杆菌ST-III是一株适合于通过发酵豆浆制备α-GI的优良菌株,同时,上述结果也表明植物乳杆菌发酵豆浆对麦芽糖酶普遍具有较高的抑制效果。
2.2 不同接种量对发酵大豆豆浆产物抑制麦芽糖酶活性的影响
将植物乳杆菌ST-III的发酵种子液以不同接种量接入固形物含量为5%(w/v)的灭菌大豆豆浆,37℃静置培养48 h,测定在不同时间获得的发酵豆浆经预处理后的样品对麦芽糖酶的抑制作用,结果如图3所示。
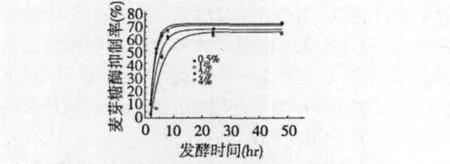
图3 不同接种量的豆浆发酵产物对麦芽糖酶抑制率的影响Fig.3 Impact of inoculum ratios on maltase inhibitory rates of fermented soybeanmilk
从图3可以看出,在发酵前10 h,接种量越高,植物乳杆菌ST-III的发酵豆浆产物对麦芽糖酶的抑制作用越强,抑制物的生成速率与接种量大小呈正相关的关系。
在发酵终点处,不同接种量获得的发酵产物对麦芽糖酶的抑制效果处于同一水平(66% ~72%),无显著差异(P>0.05),这说明具有抑酶能力的代谢产物生成量与豆浆中的营养物质含量有关,与ST-III接种量无关,但接种量的大小与抑制率峰值出现时间有关,从图中可以看出,接种量越大,抑制率达到峰值所需时间越短,如4.0%(v/v)接种量的豆浆发酵产物在9 h就达到最强抑制效果72%,而0.5%(v/v)接种量的豆浆发酵产物出现抑制率峰值的时间为20 h,与前者相比延后11 h。此外,比对2.0%(v/v)和4.0%(v/v)接种量终点处的发酵产物对麦芽糖酶的抑制效果,结果表明两种接种量对抑制率的影响无显著差异(P>0.05)。因此,后续实验均采用2.0%(v/v)接种量作为最适接种量。
2.3 发酵不同浓度大豆豆浆的产物对麦芽糖酶抑制活性的影响
将植物乳杆菌ST-III的发酵种子液以2%(v/v)接种量分别接入不同固形物含量的无菌豆浆中,37℃静置培养2 d,测定在不同时间获得的发酵豆浆经预处理后的样品对麦芽糖酶的抑制效果,结果见图4。
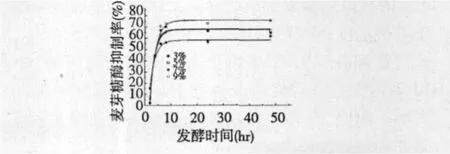
图4 豆浆浓度对麦芽糖酶抑制率的影响Fig.4 Impact of solid contents of soybean milk on maltase inhibitory rates
在发酵前10 h,随着发酵时间的延长,相同接种量、不同固形物含量的发酵产物对麦芽糖酶的抑制率效果均呈现上升趋势,豆浆浓度越高,发酵相同时间获得的发酵产物对麦芽糖酶抑制作用越显著。
在发酵10 h后,不同固形物含量的发酵产物对麦芽糖酶的抑制率达到峰值后,维持至发酵终点,来自3%(w/v)、5%(w/v)、7%(w/v)、9%(w/v)的各样品对麦芽糖酶抑制率峰值分别为55%、66%、68%、74%。这可能是因为固形物含量高的豆浆中,可被植物乳杆菌ST-III用于合成麦芽糖酶抑制物的成分越多,其发酵产物抑制作用越强。
固形物含量9%(w/v)的豆浆容易在加热或灭菌时发生暴沸,对后续试验产生不利影响。因此,弃用9%(w/v)的豆浆。对比固形物含量为5%(w/v)和7%(w/v)的豆浆终点处样品对麦芽糖酶的抑制率差异不显著(P>0.05),因此,选用5%(w/v)为最适的豆浆浓度。
2.4 不同温度下发酵大豆豆浆的产物对α-葡萄糖苷酶抑制活性的影响
在固形物含量5%(w/v)的灭菌大豆豆浆中,以2%(v/v)接种量接种植物乳杆菌ST-III的发酵种子液,分别在不同温度静置培养48 h,测定在终点处发酵豆浆经预处理后的样品对麦芽糖酶的抑制作用,结果见图5。
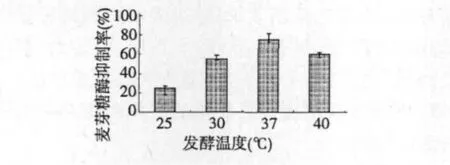
图5 发酵温度对麦芽糖酶抑制率的影响Fig.5 Impacts of fermentation temperature on maltase inhibitory rates of fermented soybean milk
如图所示,植物乳杆菌ST-III在37℃时培养24 h后的大豆豆浆发酵产物对麦芽糖酶的抑制效果高于其他温度下获得的发酵产物,其抑制率为82%。这可能是由于37℃发酵更有利于植物乳杆菌STIII利用大豆豆浆代谢产生相关(-葡萄糖苷酶抑制产物。因此,37℃是植物乳杆菌ST-III发酵大豆豆浆产的最适发酵温度。
2.5 优化条件下获得的大豆豆浆发酵产物对麦芽糖酶抑制活性的影响
在固形物含量5%(w/v)的灭菌大豆豆浆中,以2%(v/v)接种量接种植物乳杆菌ST-III的发酵种子液,37℃静置培养24 h,测定不同时间的发酵豆浆经预处理后的样品对麦芽糖酶的抑制作用,结果见图6。
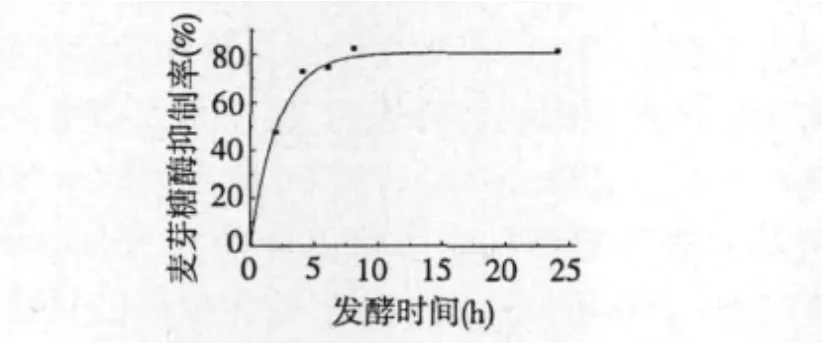
图6 优化条件下的豆浆发酵产物对麦芽糖酶的抑制率Fig.6 Maltase inhibitory rates of soybeanmilk fermented by L.plantarum ST-III at optimized condition
如图所示,在优化的发酵条件下,植物乳杆菌ST-III发酵8 h后的发酵产物对麦芽糖酶抑制率达到峰值,为81.5%,并且这种高抑制效果可以稳定维持到发酵终点。
3 讨论
尽管乳酸菌的免疫调控[7]、促进吸收[8]、疾病预防[9]等益生作用都已被深入的研究过,但到目前为止,关于乳酸菌或其代谢产物对α-葡萄糖苷酶抑制作用的报道非常少[10,11],而且,鉴于大部分植物乳杆菌在乳制品中快速增殖能力差的特点,有关植物乳杆菌对α-葡萄糖苷酶抑制活性的研究更是凤毛麟角。
本实验从多株乳酸菌出发,以大豆豆浆为发酵基料,研究其代谢产物对α-葡萄糖苷酶的抑制能力。结果发现,被测乳酸菌在大豆豆浆中的发酵产物对麦芽糖酶均有一定的抑制效果,其中,由植物乳杆菌ST-III发酵获得的大豆豆浆样品对麦芽糖酶的抑制率最高,该菌株可以作为利用大豆豆浆制备α-GI的优良菌株。Haiping Li等研究了干酪乳杆菌、嗜酸乳杆菌、动物双歧杆菌等六株益生菌在豆浆中的发酵特性,发现异黄酮(isoflavone)的含量在发酵过程中有显著增加[12]。Chun Whan Choi等比较了多种大豆异黄酮的α-葡萄糖苷酶抑制活性,结果表明异黄酮类物质对酵母来源的α-糖苷酶均有明显的体外抑制效果[13]。Haiping Li和 Chun whan Choi的研究成果,为本实验豆浆发酵产物中具有α-糖苷酶抑制活性的主要成分提供了思路。
通过对发酵条件进一步优化,植物乳杆菌STIII发酵大豆豆浆8 h获得的产物对麦芽糖酶的抑制效果即可达到80%左右,由此可见,微生物的这种快速、高效合成活性抑制物的能力是植物所无法企及的,鉴于微生物的这一特点,植物乳杆菌ST-III大豆豆浆发酵物中所含有的潜在抗高血糖或抗糖尿病作用值得进一步的研究。
4 结论
植物乳杆菌ST-III发酵大豆豆浆具有显著的α-糖苷酶有抑制活性,其发酵大豆豆浆产生麦芽糖抑制产物的最适发酵条件为接种量2%(v/v)、基料固形物含量5%(w/v)、发酵温度37℃,在上述优化条件下,8 h的豆浆发酵产物对麦芽糖酶的抑制效果可达80%左右。
1 ADVANDCE Collaborative Group,Patel A,MacMahon S,et al.Intensive blood glucose control and vascular outcomes in patientswith type2 diabetes.N Engl JMed,2008,358(24):2560-2572.
2 Turner RC,Holman RR,Cull CA,et al.Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes(UKPDS 33).Lancet,1998,352:837-853.
3 Wagstaff AJ,Goa KL.Rosiglitazone:a review of its use in the management of type 2 diabetes mellitus.Drugs,2002,62:1805-1837.
4 Ji F(季芳),Xiao GC(肖国春),Dong L(董莉),et al.Development ofα-glucosidase inhibitor from medicinal herbs.Zhongguo Zhong Yao Za Zhi(中国中药杂志),2010,35:1633-1640.
5 Lee DS,Lee SH.Genistein,a soy isoflavone,is a potentαglucosidase inhibitor.FEBS Lett,2001,501:84-86.
6 Trinder P.Determination of blood glucose using an oxidaseperoxidase system with a noncarcinogenic chromogen.JClin Pathol,1969,22:158-161.
7 Kimoto H,Mizumachi K,Okamoto T,et al.New lactococcus strain with immunomodulatory activity:enhancement of Th1-type immune response.Microbiol Immunol,2004,48(2):75-82.
8 Jasna M,Tatjana P,Lidija B,et al.Zinc binding by lactic acid bacteria.Food Technol Biotechnol,2009,47:381-388.
9 Caramia G.Gastroenteric pathology and probiotics:from myth to scientific evidence.Current aspects.Minerva Gastroenterol Dietol,2009,55:237-272.
10 Apostolidis E,Kwon YI,Ghaedian R,et al.Fermentation of milk and soymilk byLactobacillus bulgaricusandLactobacillus acidophilusenhances functionality for potential dietary management of hyperglycemia and hypertension.Food Biotechnol,2007,21:217-236.
11 Ramchandran L,Shah NP.Proteolytic profiles and angiotensin-I converting enzyme and alpha-glucosidase inhibitory activities of selected lactic acid bacteria.J Food Sci,2008,73(2):75-81.
12 Li HP,Yan LY,Wang JC,et al.Fermentation characteristics of six probiotic strains in soymilk.Ann Microbiol,2012,Accepted.
13 Choi CW,Choi YH,Cha M,etal.Yeastα-glucosidase inhibition by isoflavones from plants of leguminosae as anin vitroalternative to acarbose.J Agric Food Chem,2010,58:9988-9993.
