大鼠急性肠缺血模型中血清肠脂肪酸结合蛋白和D-乳酸浓度与缺血时间和肠组织损伤的相关性
2013-05-15吴本俨王昌正王卫华刘文徽
石 卉, 吴本俨, 王昌正, 王卫华, 刘文徽
(解放军总医院南楼临床部消化内科, 北京 100853)
急性肠缺血(acute mesenteric ischemia,AMI)时由于急性的肠壁动脉血供不足或静脉回流障碍,从而引起肠壁的营养障碍或运动障碍,其主要并发症为肠管节段性坏死[1]。该病起病急骤,早期症状、体征不典型,误诊率及病死率较高,尚缺少特异性生物标志物[2],当出现明显的腹膜炎体征以及特异性影像学表现时,病情往往已经进入晚期,其临床表现为肠管坏死、中毒性休克、多器官功能衰竭等,严重危及患者生命。尽管其在诊断技术和治疗方法已有一些进展,但急性肠缺血的死亡率仍高达60%~80%[2],误诊率达80%~95%[3]。本研究旨在探索大鼠急性肠缺血模型血清肠脂肪酸结合蛋白(intestinal fatty acid binding protein,I-FABP)和D-乳酸(D-lactate,D-Lac)浓度与缺血时间、肠黏膜损伤的相关性,以期为急性肠缺血早期血清标志物提供科学依据。
1 材料与方法
1.1 主要试剂和仪器
抗I-FABP单克隆抗体(Sigma公司,美国),D-Lac测定试剂盒(嘉美生物,中国),ELISA免疫试剂盒(Cayman chemical,美国),酶标仪(DENLEY DRAGON Wellscan MK 3,芬兰),分析软件(Ascent software for Multiskan),离心机(TGL-168)。
1.2 实验动物和分组
健康成年雄性Wistar大鼠60只(250~300g),购于解放军总医院动物实验中心。标准饲料饲养,大鼠自由摄食和饮水。在进行实验前,大鼠最少饲养1周以适应实验室环境。采用随机数字表法,将大鼠随机分为6组:假手术组(空白对照)、缺血30min组、缺血60min组、缺血90min组、缺血120min组、缺血150min组,每组10只。
1.3 动物造模
手术前实验动物禁食24h,自由饮水。手术当日,大鼠称重后,10%水合氯醛(5mg/kg)腹腔注射麻醉。麻醉成功后,大鼠取背卧位固定于解剖垫,腹部手术区备皮,碘伏消毒。取腹部正中切口,长3~4cm,逐层剪开腹壁各层进入腹腔。将小肠向左侧外置于温生理盐水浸湿的无菌纱布垫上,显露肠系膜前动脉,在其主动脉起源处向远端钝性分离出1~2cm,靠近其根部用一个无创性微血管夹夹闭肠系膜前动脉,阻断血流,观察肠系膜区无血管搏动,肠色泽变苍白,肠蠕动消失从而确认肠缺血诱导完成。假手术组仅开腹,显露肠系膜前动脉,不进行缺血处理。之后,将外置的小肠还纳腹腔,用两把小血管钳夹闭腹膜暂时关腹。同时右侧股静脉插管至下腔静脉,用于持续输液[生理盐水5ml/(kg·h)]。根据分组既定时间,打开腹腔,经腹主动脉抽血7~10ml,截取自幽门向下小肠组织约15cm,按上、中、下各5cm分瓶放入10%中性缓冲福尔马林溶液固定,大鼠开放性气胸致死,手术完毕。实验期间,用加热灯照射手术区以维持大鼠体温恒定,所有大鼠肠系膜前动脉阻断后给予生理盐水50ml/kg皮下注射以扩容抗休克,手术操作遵循无菌术原则。
1.4 实验标本预处理
1.4.1 血清标本制备及测定 各组动物实验终点,通过腹主动脉穿刺采集全血样本7~10ml,采血时注意防止溶血。37℃静置20min使血液凝固,低温离心机4℃ 2000转/min离心20min分离血清,取上清液3~5ml于-80℃保存备用。依据ELISA试剂盒说明书测定标本中I-FABP和D-Lac的浓度。
1.4.2 肠组织标本损伤评分 各组实验终点,动物处死前,截取自幽门向下小肠组织约15cm,按上、中、下各5cm分段,迅速用冷生理盐水溶液冲洗,清除黏液、污物等肠腔内容物后,立即分瓶置入10%中性缓冲福尔马林溶液,固定后石蜡包埋。依据Park/Chiu肠组织损伤评级系统,进行半定量的肠组织病理学评级。采用Kurt等[4]的评分系统:0级,正常组织黏膜;1级,上皮表面受损,肠绒毛尖端上皮下间隙轻度增大;2级,黏膜局灶溃疡,上皮层从固有层消失或上皮下间隙增大程度中等以上;3级,局灶透壁性溃疡,部分绒毛消失或大量上皮层消失;4级,大面积透壁性溃疡,大量绒毛消失,毛细血管暴露扩张;5级,大面积透壁性溃疡、出血,固有层中断。
1.5 统计学处理
所用统计学描述和分析均在SPSS17.0统计包上进行。计量资料以±s表示。生化指标分析采用单因素方差分析(one-way analysis of variance,ANOVA)及Student-Newman-Keuls post-hoc analysis评价各分组之间的差异。对于组织病理学评级,组间差异的比较采用Kruscal-Wallis检验及Mann-Whitney U检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各缺血时间组血清I-FABP和D-Lac浓度测定
各组血清I-FABP和D-Lac浓度的变化如表1所示。缺血30min时血清I-FABP浓度即开始升高,缺血90min血清I-FABP浓度达到峰值(P<0.05),其后随着缺血时间的延长,I-FABP浓度逐渐下降。缺血60min时D-Lac开始升高,随缺血时间延长,D-Lac浓度升高越明显(P<0.05)。
表1 各组血清I-FABP和D-Lac浓度的变化Table 1 Serum I-FABP and D-Lac concentration in rats of each group (n=10,±s)
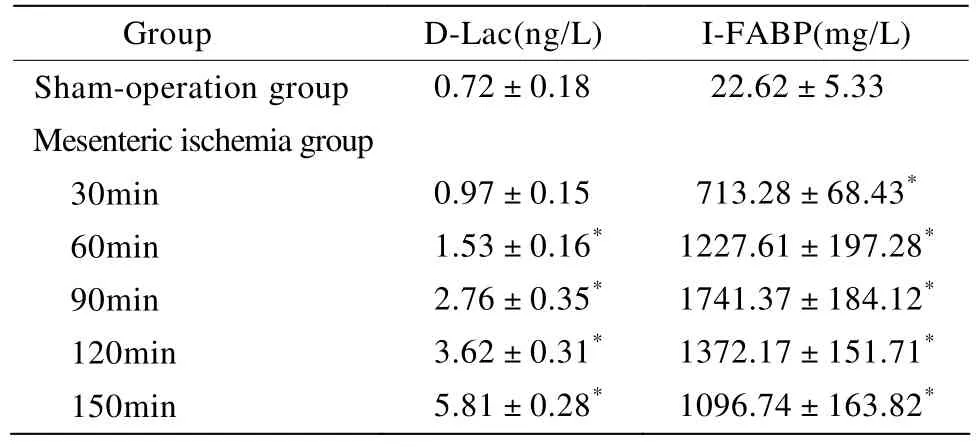
表1 各组血清I-FABP和D-Lac浓度的变化Table 1 Serum I-FABP and D-Lac concentration in rats of each group (n=10,±s)
I-FABP: intestinal fatty acid binding protein; D-Lac: D-lactate.Compared with sham-operation group, *P<0.05
Group D-Lac(ng/L) I-FABP(mg/L)Sham-operation group 0.72±0.18 22.62±5.33 Mesenteric ischemia group 30min 0.97±0.15 713.28±68.43*60min 1.53±0.16* 1227.61±197.28*90min 2.76±0.35* 1741.37±184.12*120min 3.62±0.31* 1372.17±151.71*150min 5.81±0.28* 1096.74±163.82*
2.2 I-FABP 免疫组化结果
经I-FABP抗体以及DAB染色后,正常小鼠肠黏膜镜下染色阳性率为9.2%,缺血90min组,镜下染色阳性总个数、阳性总面积以及阳性率均为最高(平均72.5%;图1),缺血120min组镜下阳性率平均61.2%,缺血150min组镜下阳性率平均值为44.8%。

图1 缺血90min时I-FABP染色结果(阳性率最高达72.5%)Figure 1 Immunohistochemical staining of I-FABP at 90min with positivity rate of 72.5% (DAB ×400)
2.3 小肠黏膜损伤评分统计
假手术组小肠壁柔软温暖,系膜动脉搏动有力,色泽正常,蠕动均匀,约8次/min。其余各组缺血早期,可观察到小肠、盲肠和部分结肠色泽苍白,肠管痉挛变细,蠕动明显增快,约12次/min。随着缺血时间延长,缺血150min时,肠管无蠕动,肠壁颜色发黑,温度明显降低,但未见肠管穿孔。具体评分如表2所示。结果提示缺血时间越长,组织损伤评分越高。
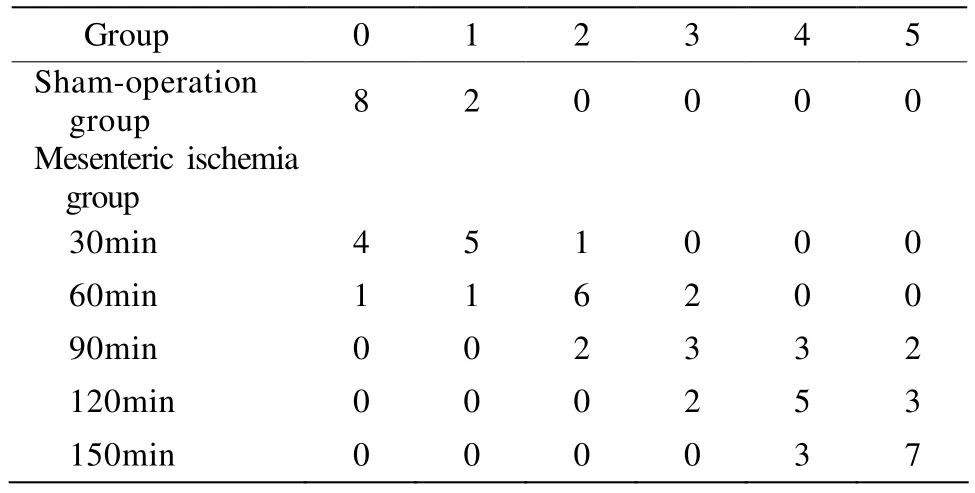
表2 各组小肠黏膜损伤评分Table 2 Histopathological scores of intestinal mucosa in different groups (n)
2.4 I-FABP和D-Lac与小肠黏膜组织损伤相关性分析
Spearman等级相关非参数检验结果表明,血清D-Lac浓度与组织损伤正相关(r=1);血清I-FABP浓度与组织损伤评分无相关性(r=0.6)。
3 讨 论
I-FABP属于细胞质脂肪酸结合蛋白家族成员,富含于肠黏膜上皮绒毛中,正常情况下,周围血管中I-FABP含量很低,但当遭受炎症、缺氧、缺血及再灌注损害时,肠上皮细胞通透性增加,I-FABP释出,通过毛细血管及毛细淋巴管进入血循环,可在周围血中检测出[5]。I-FABP具有如下特点[6]:(1)是存在于胞质中的可溶性蛋白;(2)具有较高组织特异性;(3)组织含量丰富;(4)分子量低,易于检测。有研究表明:由于I-FABP更多的位于绒毛的顶端,在缺血早期能比肝脂肪酸结合蛋白(liver fatty acid banding protein,L-FABP)更早释放入血达到有效浓度[7]。赵海东等[8]用大鼠制作肠缺血模型,测定血清中的I-FABP含量,并与乳酸脱氢酶和肌酸激酶同工酶含量进行比较,发现肠缺血45min后血清I-FABP含量最高。刘牧林等[9]应用大鼠缺血再灌注模型,分别于肠缺血15min、肠缺血45min、肠缺血45min再灌注2h、肠缺血45min再灌注6h测定I-FABP浓度,发现缺血45min时I-FABP达峰值,而且I-FABP浓度与肠组织损伤程度正相关。
本研究发现,I-FABP在肠缺血30min即明显升高,90min达到峰值,而后随着缺血时间的延长,其水平下降。I-FABP浓度与组织损伤程度无相关性,但是在缺血早期,即缺血90min内,I-FABP与组织损伤程度正相关。病变肠组织免疫组化也显示:缺血90min组镜下染色阳性总个数、阳性总面积以及阳性率均为最高(68.3%~76.4%),进一步验证了此时被破坏的肠黏膜组织释放的I-FABP总量最高。本研究采用结扎大鼠肠系膜前动脉的方式造模,发现在持续肠缺血的情况下,血清I-FABP的浓度与肠组织损伤无相关性。考虑血清I-FABP浓度下降系由于缺血中后期富含I-FABP的肠黏膜绒毛组织破坏殆尽所致,提示当I-FABP水平下降时,缺血损害已侵及肠黏膜肌层。
D-Lac是肠道内细菌的主要酵解产物之一,肠道菌群中多种细菌都可以产生,发生肠缺血时,正常肠黏膜屏障被破坏,导致其通透性增加,致使血清D-Lac浓度升高[10]。D-Lac具有以下特点[11]:(1)肠道通透性发生改变时即可引起血中D-Lac的浓度变化;(2)人体内自身不产生D-Lac,且无D-Lac的代谢酶类,浓度相对稳定;(3)D-Lac为肠道内细菌代谢产物,其浓度改变具有较强的特异性。在本研究中,D-Lac水平在肠缺血早期升高不明显,自缺血60min开始明显升高,随着肠缺血时间的延长而持续明显升高,D-Lac与组织损伤具有明显相关性,提示D-Lac可作为判定肠黏膜损伤的指标。但在肠缺血早期,D-Lac浓度变化不明显。
综上所述,I-FABP在缺血90min内与肠组织损伤正相关,诊断敏感性较高,血清D-Lac在缺血60min后与肠组织损伤正相关。两种指标均能准确反应肠黏膜损伤,如果I-FABP升高,而D-Lac正常,说明肠黏膜受到损伤,但肠黏膜屏障尚完整;如果I-FABP和D-Lac同时升高,说明肠黏膜屏障可能已经受到破坏。因此,可考虑联合采用这两种指标,建立诊断模型用于急性肠缺血的早期诊断。
[1]中华医学会老年医学分会.老年人缺血性肠病诊治中国专家建议[J].中华老年医学杂志, 2011, 30(1): 1−6.
[2]Oldenburg WA, Lau LL, Rodenberg TJ,et al.Acute mesenteric ischaemia: a clinical review[J].Arch Intern Med, 2004, 164(10): 1054−1062.
[3]Brandt LJ, Boley SJ.AGA technical review on intestinal ischemia[J].Gastroenterology, 2000, 118(9): 954−968.
[4]Kurt Y, Akin ML, Demirbas S,et al.D-dimer in the early diagnosis of acute mesenteric ischemia secondary to arterial occlusion in rats[J].Eur Surg Res, 2005, 37(4):216−219.
[5]Pelsers MM, Hermens WT, Glatz JF.Fatty acid binding proteins as plasma markers of tissue injury[J].Clin Chim Acta, 2005, 352(1−2): 15−35.
[6]石 卉, 吴本俨.肠脂肪酸结合蛋白在缺血性肠病中的研究进展[J].中华老年多器官疾病杂志, 2011, 10(6):556−559.
[7]Kanda T, Tsukahara A, Ueki K,et al.Diagnosis of ischemic small bowel disease by measurement of serum intestinal fatty acid-binding protein in patients with acute abdomen: a multicenter, observer-blinded validation study[J].J Gastroenterol, 2011, 46(4): 492−500.
[8]赵海东, 田晓峰, 郭 健, 等.肠型脂肪酸结合蛋白对肠缺血早期诊断的意义[J].中国普通外科杂志, 2004,13 (7): 513−516.
[9]刘牧林, 张 嘉.肠脂肪酸结合蛋白和D-乳酸早期诊断肠缺血-再灌注损害的实验研究[J].中华创伤杂志,2006, 22(10): 767−770.
[10]Evennett NJ, Petrov MS, Mittal A,et al.Systematic review and pooled estimates for the diagnostic accuracy of serological markers for intestinal ischemia[J].World J Surg, 2009, 33(7): 1374−1383.
[11]Block T, Nilsson TK, Bjorck M,et al.Diagnostic accuracy of plasma biomarkers for intestinal ischaemia[J].Scand J Clin Lab Invest, 2008, 68(3): 242−248.
