BAPTA-AM对OGD-再灌致Hep G-2细胞损伤的保护作用研究
2013-05-11宋必卫骆钱芬
宋必卫,骆钱芬
(浙江工业大学药学院,浙江杭州310032)
BAPTA-AM对OGD-再灌致Hep G-2细胞损伤的保护作用研究
宋必卫,骆钱芬
(浙江工业大学药学院,浙江杭州310032)
观察BAPTA-AM抗OGD-再灌对Hep G-2细胞的损伤作用及其机制.在氧/糖剥夺环境中培养细胞12 h后复糖复氧,检测培养液中乳酸脱氢酶(LDH)、谷丙转氨酶(ALT)及谷草转氨酶(AST)的活性,MTT法检测细胞活力,Annexin V-EGFP/PI荧光染色检测细胞死亡率,A23187拮抗实验及Fura-2/AM测定细胞内游离钙浓度等方法,评价BAPTA-AM抗氧/糖剥夺-再灌注致Hep G-2细胞损伤的作用.BAPTA-AM能明显抑制OGD-再灌引起的Hep G-2细胞培养液中的LDH、ALT、AST水平的升高,抑制Hep G-2细胞的坏死和细胞内游离钙浓度的升高,明显提高Hep G-2细胞活力,A23187减弱BAPTA-AM保肝作用.BAPTA-AM通过降低细胞内游离钙浓度,明显减轻OGD-再灌对HepG-2细胞的损伤.
BAPTA-AM;Hep G-2细胞;OGD-再灌
原发性肝癌是我国最常见且恶性程度最高的肿瘤之-,每年约有14万例患者死于肝癌,占我国癌症死亡率的第二位.肝切除和肝移植是肝脏肿瘤的惟一有效手段.肝移植必然要经历缺血-再灌注过程,导致肝缺血-再灌注损伤(Hepatic ischemiareperfusion injury,HIRI),引起细胞膜脂质过氧化、细胞器结构损伤和代谢障碍,直接导致术后肝功能不全等致命并发症形成.肝移植病人中5%~30%出现原发性供肝无功能或功能不良,是仅次于免疫排斥的第二位再移植失败原因,其发生与供肝的切取、保存和再灌注所致的损伤密切相关[1-2].此外,其它肝手术、肝脏严重炎症,肝血栓、肝外伤等疾病也能导致肝缺血缺氧损伤.尽管现代医学对肝损伤的研究比较深入,已从多方面探讨了肝损伤的发生机制,但保肝药物疗效仍难尽人意,寻找能有效防治肝缺血缺氧-再灌损伤药物,具有重要临床意义.
钙超载是公认的细胞损伤、死亡的共同环节[3]. BAPTA-AM[1,2-bis(2-aminophenoxy)ethane-N,N,N′N′-tetraacetic acid]是一种具有高选择性的高效钙络合剂,用于控制细胞内钙水平以研究钙离子对各种细胞功能调节[4-5],能有效地降低细胞内游离钙离子浓度,因此推测其能减轻HIRI所致的细胞损伤,挽救濒危细胞.本研究以OGD-再灌损伤Hep G-2细胞,通过测定细胞活力、凋亡率以及酶学指标来论证BAPTA-AM对肝细胞的保护作用.
1 材料与方法
1.1 材 料
1.1.1 细胞株
Hep G-2细胞株,购自南京凯基生物科技发展有限公司.
1.1.2 药品与试剂
BAPTA-AM脂质体(合肥恒星科技公司提供);盐酸维拉帕米注射液(上海禾丰制药有限公司,批号110421);RPMI.1640培养液、小牛血清、0.25%胰蛋白酶、PBS、DMSO(上海吉诺医药生物技术有限公司);MTT(Sigma);乳酸脱氢酶(LDH)、谷丙转氨酶(ALT)、谷草转氨酶(AST)试剂盒(南京建成生物工程研究所);Annexin V-EGFP检测试剂盒(南京凯基生物技术有限公司);A23187(Sigma)、Fura-2/AM钙离子荧光探针(海门市碧云天生物技术研究所).
1.1.3 仪 器
垂直流超净台(ESCO,SCV-4A1);CO2培养箱(Thermo Electron Corporation,Fonma 3111);倒置光学显微镜(Nikon Eclipse,型号TS100-F DH1);荧光显微镜(Leica Devices);酶标仪(Molecular Devices,M2e);离心机(Heraeus,LDZ5-2).
1.2 方 法
1.2.1 OGD-再灌致细胞损伤模型的建立
将Hep G-2细胞以104个/孔接种于96孔培养板,RPMI 1640培养液培养24 h后换无糖1640培养液,置于密闭缺氧盒中,37℃下持续通入N240 min后同时关闭进、出气口,置于37℃恒温孵箱中培养,缺氧时间设置为4,8,12,16 h.打开缺氧盒以复氧,加入常规培养浓度葡萄糖,5%CO2孵箱中正常培养6 h,建立OGD-再灌模型[6-7].正常对照组不作任何处理.每组设8个复孔.MTT法检测不同氧/糖剥夺时间对Hep G-2细胞活力的影响以确定合适损伤时间制备细胞损伤模型.
1.2.2 BAPTA-AM对OGD-再灌诱导HepG-2细胞损伤的影响
细胞培养同1.2.1.分组及处理见图1,每组设8个复孔.氧/糖剥夺条件下培养12 h后,复氧复糖,继续培养6 h.正常对照组不作特殊处理.MTT法检测细胞活力,收集培养上清液检测AST,ALT,LDH活性.细胞活力为


图1 BAPTA-AM抗OGD-再灌所致HepG-2细胞损伤(MTT法)±s,n=8)Fig.1 The effects of BAPTA-AM on HepG-2 cells against the injuries induced by deprivation of O2and glucose±s,n=8)
1.2.3 Annexin V-EGFP/PI荧光染色观察BAPTA-AM对细胞死亡的影响
分组及处理同1.2.2.复氧、糖6 h后,弃上部培养液并用PBS清洗两次,加500μL Binding Buffer后再加入Annexin V-EGFP和Propidium Iodide(PI)各5μL,室温避光反应5 min,荧光显微镜观察结果,计数凋亡早期、凋亡中晚期及坏死细胞数[8-9].
1.2.4 A23187拮抗BAPTA-AM抗Hep G-2细胞OGD-再灌损伤的作用
细胞处理同1.2.2,分组见图2.保护组和A23187组分别加入相应浓度的药物.正常对照组不作特殊处理,其余各组均置于氧/糖剥夺环境中培养12 h,再复氧复糖培养6 h,MTT法检测细胞活力[10].

图2 A23187对模型组和保护组的细胞活力的影响±s,n=8)Fig.2 Effects of A23187 to model group and protectivegroups on viabilities of HepG-2 cells±s,n=8)
1.2.5 细胞内游离钙浓度的测定
分组及处理同1.2.2.同前法清洗细胞3次,加入终浓度为5μmol/L的Fura-2/AM.37℃避光温育30 min,同法清洗3次以去除多余的Fura-2/ AM.设定激发波长为340 nm,发射波长为510 nm,测定荧光强度.再加入0.4%的Triton X-100及5 mmol/L的CaCl2后测定最大荧光强度值Fmax,在Fmax的基础上加入10 mmol/L的EGTA后的测定值为最小荧光强度值Fmin.按以下公式计算细胞内游离钙浓度:Kd(F-Fmin)/(Fmax-F);Kd=224 nmol/L,为Fura-2与Ca2+的解离常数[11-12](每个样本测定后均需减去自发荧光再进行计算).
1.2.6 统计处理
采用Graph Pad Prism软件(One-way ANOVA)处理,数据用±s表示,以p<0.05为差异有显著性意义.
2 结 果
2.1 OGD-再灌致细胞损伤模型的建立
如图3所示,固定复氧/糖时间为6 h.细胞活力随着氧/糖剥夺时间延长而逐渐减小.氧/糖剥夺12 h时,细胞的活力降低至正常对照组的59%,二者间差异极显著性(P<0.001).因此选用氧/糖剥夺12 h来制作HepG-2细胞损伤模型.
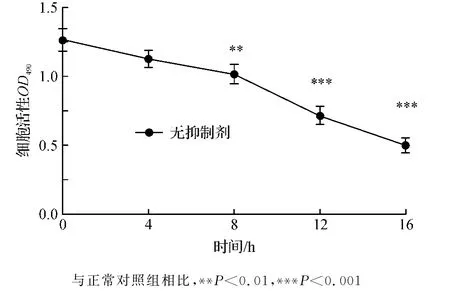
图3 OGD时间对HepG-2细胞活性的影响±s,n=8)Fig.3 Effect of deprivation of O2&glucose on viabilities of Hep G-2 cells(±s,n=8)
2.2 BAPTA-AM抗OGD-再灌所致HepG-2细胞损伤
从图1可看出:Hep G-2细胞缺糖缺氧12 h后,细胞活性严重受损,与正常对照组相比,差异极明显(P<0.001).无论是预防性(缺糖缺氧前)给药(图1a),还是治疗性给药(图1b),BAPTA-AM均可呈剂量依赖性地减轻细胞损伤,在3 nmol/L时,作用达峰值(活力分别由模型组的52.9%和55.9%上升到73.9%和73%).预防性给予维拉帕米对Hep G-2细胞有保护作用但需要更高浓度(100 nmol/L),但治疗性用药则无明显作用.该结果证明:BAPTAAM对肝细胞的保护好,且明显优于维拉帕米.
2.3 BAPTA-AM改善HepG-2细胞损伤所致的酶学指标改变
Hep G-2细胞经OGD-再灌损伤后,细胞内酶释放,导致培养上清液中的ALT、AST和LDH水平明显升高.预防性给予BAPTA-AM,可浓度依赖性抑制ALT,AST和LDH活性的升高,当BAPTAAM为3 nmol/L时效果最佳(图4).
2.4 AnnexinV-EGFP荧光染色观察BAPTA-AM抗细胞死亡作用
凋亡和坏死是细胞的两种死亡方式.细胞经OGD-再灌损伤后,在荧光显微镜下观察,可看见大部分细胞被染色.部分细胞固缩变小,发出绿色荧光,为凋亡早期状态;部分细胞裂解成碎块,并同时发出绿色荧光和红色荧光,表明细胞已进入凋亡晚期;细胞膨大,只发出红色荧光的,为坏死细胞.模型组细胞总死亡率高达(39.2±2.4)%.加入3 nmol/L BAPTA-AM后,出现红色荧光标记的细胞明显减少,被染的细胞基本处于凋亡早期(绿染)(图5),细胞的总死亡率显著性下降(25.2± 4.3)%,尤其是坏死率,由模型组的(63.8± 4.2)%下降了到(32.0±2.3)%.该结果表明OGD-再灌导致HepG-2细胞坏死与凋亡,且以坏死为主.BAPTA-AM能极显著抑制OGD-再灌所致的细胞坏死与凋亡(表1).
2.5 A23187拮抗BAPTA-AM对HepG-2细胞的保护作用
由图2可知:A23187(1μg/m L)显著加重OGD-再灌所致的细胞损伤,拮抗BAPTA-AM的细胞保护作用,提示BAPTA-AM通过减轻钙超载机制保护细胞.
2.6 BAPTA-AM对细胞内游离钙浓度的影响
经OGD-再灌损伤后,HepG-2细胞内的游离钙浓度较正常对照组有明显升高,从(124.90±27.17)nmol/L上升到(237.36±38.49)nmol/L,约升高了1倍.BAPTA-AM浓度依赖性降低剂细胞内游离钙浓度.当BAPTA-AM为3 nmol/L时,游离钙浓度达到(146.78±24.31)nmol/L,与正常对照组接近.该结果进一步表明BAPTA-AM通过减轻钙超载机制保护细胞(图6).
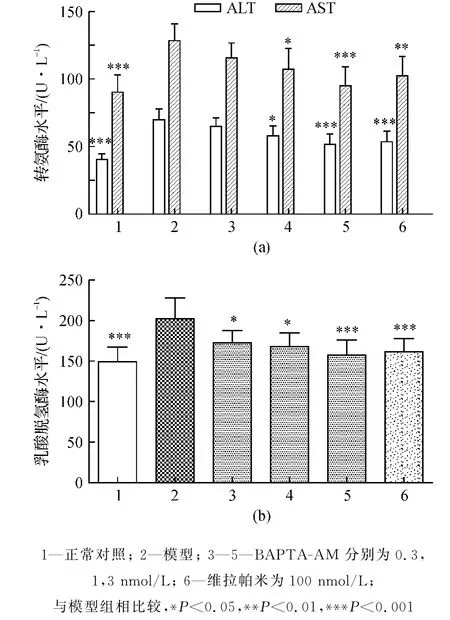
图4 BAPTA-AM改善Hep G-2细胞损伤所致的酶学指标变化±s,n=8)Fig.4 Effects of BAPTA-AM on AST、ALT和LDH levels in supernatant±s,n=8)
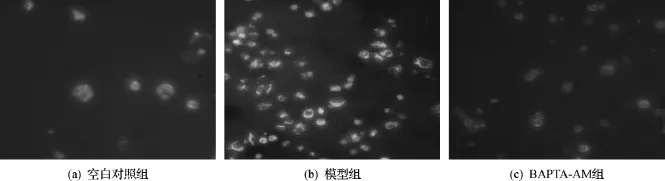
图5 Annexin V-EGFP荧光染色后的HepG-2细胞Fig.5 The morphology of HepG-2 cells labeled by AnnexinV-EGFP/PI
表1 BAPTA-AM对HepG-2细胞凋亡和坏死的影响1)±s,n=8)Table 1 Effects of BAPTA-AM on death rate of HepG-2 cells±s,n=8)

表1 BAPTA-AM对HepG-2细胞凋亡和坏死的影响1)±s,n=8)Table 1 Effects of BAPTA-AM on death rate of HepG-2 cells±s,n=8)
注:1)与模型组相比较,*P<0.05,**P<0.01,***P<0.001;2)凋亡早期细胞为可逆性损伤,不纳入死亡细胞统计.
58.3±22.0 4 41.6±22.0模型 14.9±0.3 39.2±2.4 36.2±4.2 6 63.8±4.2 BAPTA-AM 0.3 14.2±2.5 38.0±2.9 42.9±1.3 57.1±1.3 1 15.3±3.0 29.1±5.5*57.1±3.0 42.9±3.0 3 20.1±3.4 25.2±4.3**68.0±2.3*32.0±2.3*维拉帕米晚期凋亡 坏死空白对照 3.8±0.6***2.8±0.6***组别 剂量/(nmol·L-1) 早期凋亡率/% 总死亡率/% 死亡构成比2)/% 100 20.4±1.5 30.5±3.1 53.0±3.4 47.0±3.4
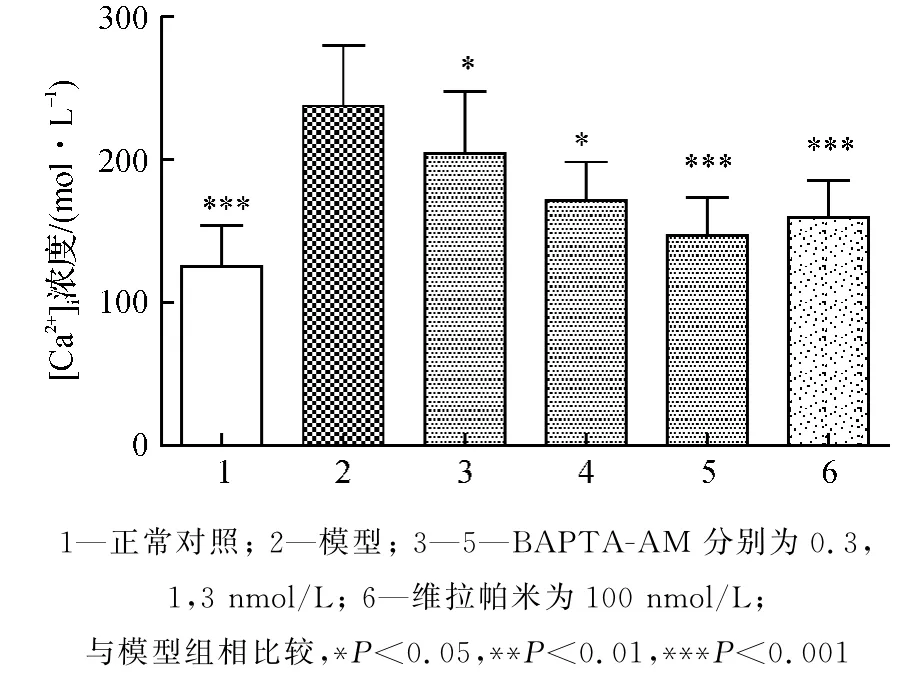
图6 BAPTA-AM对HepG-2细胞内游离钙浓度的影响±s,n=8)Fig.6 Effects of BAPTA-AM on cytoplasmic free Ca2+concentrations±s,n=8)
3 结 论
HIRI是指由于各种原因导致肝脏血流中断、不足等造成肝脏缺血,当再进行灌注,肝脏血供恢复后,不仅不能使肝脏功能恢复,反而使肝细胞功能障碍及结构破坏加重的现象,多发生于肝移植、肝叶切除等复杂肝脏外科手术中.目前,各种预防及治疗措施已逐渐被运用,主要有:1)缺血预处理和缺血后处理:增加肝脏对缺血的耐受性;2)减轻HIR的药物:如抗氧化剂(川芎嗪、丹参、银杏叶)、钙通道阻滞剂(维拉帕米、三七总皂甙)、PAF拮抗剂(山莨菪碱、海风藤酮)、细胞因子活性抑制剂(赖氨匹林)、蛋白酶体抑制剂(乌司他丁)等等,但这些措施效果并不显著.因此,研究开发针对HIRI的有效药物,降低病死率,是急需解决的重大课题.
本实验采用OGD-再灌损伤建立肝缺血再灌注损伤模型,发现OGD-再灌损伤HepG-2细胞后,细胞活力显著下降,培养上清液中AST、ALT、LDH水平明显升高,细胞内Ca2+大大升高,BAPTA-AM能显著减轻上述损伤性变化.Annexin V-EGFP荧光染色表明OGD-再灌能诱导Hep G-2细胞出现典型的细胞凋亡与坏死且以后者为主,BAPTA-AM则极明显减少细胞坏死.本结果在细胞水平证BAPTA-AM对肝缺血-再灌损伤有上佳的防治作用,其最佳浓度为3 nmol/L,其作用机制是直接降低细胞内钙,减轻或消除钙超载,与蔡雁[13]、付再林[14]等报道的BAPTA-AM抗肝细胞凋亡作用基本一致.大量研究证明,钙超载和自由基形成二者互为因果,是缺血-再灌损伤的主要机制.BAPTA-AM能通过减轻钙超载,大大降低自由基形成[15].
本实验还发现:经典的钙通道阻断剂维拉帕米在高浓度时100 nmol/L,对OGD-再灌诱导的Hep G-2细胞损伤有预防作用但治疗效果差.BAPTA-AM作用的效能和效价强度均高于维拉帕米.因此,一旦将BAPTA-AM用于临床,疗效会大大优于维拉帕米.究其原因,可能在于二者作用不同:维拉帕米阻断钙通道,故能预防钙超载的发生,但其不能直接降低细胞内钙,对已存在的钙超载无效,自然临床治疗效果差.BAPTA-AM直接降低细胞内钙,减轻或消除钙超载,故既可预防也能治疗钙超载损伤.BAPTA-AM有可能成为治疗HIRI的有效治疗药,开发前景极好.
[1] PLOEG R J,ALESSANDRO A M,KNECHTLE S J,et al. Risk factors for primary dyfunct ion after 1iver transplantation a multivariate analysis[J].Transplantation,1993,55:807-813.
[2] FERDINAND,SERRACINO-INGLOTT M D,NAGY A,et al.Hepatic ischemia-reperfusion injury[J].The American Journal of Surgery,2001,181(2):160-166.
[3] 高利平,方海立.钙超载与细胞损伤[J].四川医学,2004,25(9):1039-1041.
[4] SERGEEV I N.Calcium signaling in cancer and vitamin D[J]. J Steroid Biochem Mol Biol,2005,97(1/2):145-151.
[5] GALLD,ROUSSEL C,NIEUS T,et al.Role of calcium binding proteins in the control of cerebellar granule cell neuronal excitability:experimental and modeling studies[J].Prog Brain Res,2005,148:321.
[6] HAMACHER-BRADY A,BRADY NR,GOTTLIEB RA. Enhancing macroautophagy protects against ischemia/reperfusion injury in cardiac myocytes[J].J Biol Chem,2006,281(40):29776-29787.
[7] BOSSENMEYER C,CHIHAB R,MULLER S,et al.Hypoxia/reoxygenation induces apoptosis through biphasic induction of protein synthesis in cultured rat brain neurons[J]. BrainRes,1998,787(1):107-116.
[8] 马毅,何晓顺,陈规划.肝脏缺血再灌注损伤与细胞凋亡[J].中国病理生理杂志,2003,19(07):1005-1008.
[9] NAGAI S,ASOH S,KOBYYASHI Y,et al.Protection of hepatic cells from apoptosis induced by ischemia-reperfusion injury by protein therapeutics[J].Hepatology research:the official journal of the Japan Society of Hepatology,2007,37(2):133-142.
[10] 张孝文,孔维佳.钙离子载体A23187对喉癌细胞株胞内游离钙浓度及凋亡的影响[J].临床耳鼻咽喉科杂志,2005,19(11):507-509.
[11] FINKE E.The mitochondrion:is it central to apoptosis[J]. Science,2001,292:624-626.
[12] 黄昌州,张宗明,裘法祖.缺血/再灌注损伤对大鼠肝细胞钙池操纵的钙通道电流的影响及药物拮抗[J].世界华人消化杂志,2005,13:739-742.
[13] 蔡雁,付再林,顾喜燕,等.BAPTA-AM抗D-Gal N致LO-2细胞损伤作用[J].浙江工业大学学报,2010,38(3):326-331.
[14] 付再林,施水娟,杨毅,等.BAPTA-AM对HepG-2细胞MT的保护作用及其机制[J].中国药理学通报,2011,27(6):859-863.
[15] 张均田.现代药理实验方法:下册[M].北京:北京医科大学、中国协和医科大学联合出版,1998:1397-1407.
(责任编辑:陈石平)
Protection of Hep G-2 cell of BAPTA-AM against deprivation of O2and glucose/reperfusion-induced injury
SONG Bi-wei,LUO Qian-fen
(College of Pharmaceutical Science,Zhejiang University of Technology,Hangzhou 310032,China)
To study the protective effects and mechanism of BAPTA-AM on Hep G-2 cells against deprivation of O2and glucose/reperfusion-induced injury,oxygen-glucose deprivation followed by 12 h of reoxygenation-glucose reperfusion was applied to induce Hep G-2 cells injure at various concentrations of BAPTA-AM.The viabilities of Hep G-2 cells,the levels of ALT,AST,LDH were measured.Cell death was evaluated by Annexin V-EGFP/PI labeling method.Effects of A23187 against BAPTA-AM on viabilities of Hep G-2 cells was also measured.Cytoplasmic free Ca2+concentrations were tested by a Ca2+labeling indicator,Fura-2/AM.BAPTA-AM could significantly inhibit deprivation of O2and glucose/reperfusion-induced hepatocyte injury,prevent Hep G-2 cells from cytoplasm Ca2+concentrations increase and suppress necrosis.BAPTA-AM could effectively protect Hep G-2 cells against deprivation of O2and glucose/reperfusion induced injury.
BAPTA-AM;Hep G-2 cells;deprivation of O2and glucose/reperfusion
R965
A
1006-4303(2013)02-0133-05
2012-03-09
宋必卫(1956-),男,安徽岳西人,教授,研究方向为细胞和分子药理学,E-mail:bwsong@zjut.edu.cn.
