水分调控对杨梅容器苗光合特性的影响
2013-05-10赵彩芳张乃华方建华陈友吾宋其岩
赵彩芳,张乃华,方建华,陈友吾,宋其岩,项 缨
(1. 浙江省林业科学研究院,浙江 杭州 310023;2. 浙江省森林食品研究重点实验室,浙江 杭州 310023;3. 浙江省淳安县林业局,浙江 淳安 311700;4. 台州科技职业学院,浙江 台州 318020)
水分调控对杨梅容器苗光合特性的影响
赵彩芳1,2,张乃华3,方建华3,陈友吾1,2,宋其岩1,2,项 缨4*
(1. 浙江省林业科学研究院,浙江 杭州 310023;2. 浙江省森林食品研究重点实验室,浙江 杭州 310023;3. 浙江省淳安县林业局,浙江 淳安 311700;4. 台州科技职业学院,浙江 台州 318020)
以杨梅(Myrica rubra)1年生嫁接容器苗为试验材料,进行不同水分梯度对其的光合特性的影响试验。结果表明:杨梅的光合作用在不同水分梯度下存在显著差异,其最大净光合速率、光能利用范围与水分含量呈正相关,但水分含量过高反而会使其下降;不同水分梯度下其光合日进程均为双峰型,夏季净光合速率峰值出现在10∶00左右,各处理的峰值差异显著;其叶绿素含量在适宜水分含量下最高,且与光合能力呈正相关。综合各项指标,为最大程度满足其水分需求,并达到合理用水的目的,夏季杨梅容器苗培育基质相对含水量以65%~ 75%较为适宜。
杨梅;水分调控;光合作用
杨梅(Myrica rubra)为杨梅科常绿树种,中国特有果树,栽培利用历史悠久。杨梅经济栽培主要集中在浙江、江苏、福建、广东等省[1],具有较高的经济价值,同时能与放线菌共生形成根瘤具有天然固氮能力,是经济价值与生态价值兼有的树种[2~3]。
水分在植物的整个生命活动中起着重要作用,合理供水是植物快速生长的基本保障。研究表明,在一定范围内植物生长与土壤含水量呈线性关系,但随着灌水量达到一定峰值后则出现对植物的胁迫趋势[4]。光合作用是植物生长的物质基础,光合速率是衡量植物生物产量和经济产量的重要指标,而水分对植物光合作用影响很大。本试验在控制其他培育条件的前提下,研究不同水分梯度下杨梅容器苗的光合作用,比较分析不同的水分梯度对杨梅容器苗光合特性的影响。
1 材料与方法
1.1 试验材料与设计
2009年7月选取健康无病虫害、长势较一致的1年生东魁杨梅嫁接苗120株,随机分成4组,采用容器培育于浙江省林业科学研究院苗圃内。
测得盆栽基质的毛管持水量(WHC)为50.59%,并以此为饱和持水量来控制基质水分梯度。公式如下:
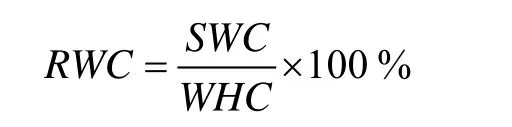
式中,RWC为基质相对含水量(%);SWC为基质含水量(%)。
2009年7月至10月分别控制基质相对含水量进行水分调控试验(表1)。不同水分梯度采用土壤水分测定仪进行控制,当含水量低于下限时补水至该水分梯度的上限。

表1 水分梯度Table 1 Design of moisture gradient
1.2 测定指标及方法
1.2.1 叶绿素含量的测定 采用混合采样法,取中上部的功能叶,浸提法测定叶绿素含量[5]。
1.2.2 光合指标测定 选择晴朗天气,采用美国基因公司生产的Li-6400光合仪,7∶00-17∶00每间隔1 h随机测定各处理的净光合速率;8∶00-11∶00随机测定各处理的光合作用—光响应曲线。每个处理选择固定的5棵苗进行测定,重复测量2片叶。
2 结果分析
2.1 不同水分梯度对杨梅光响应的影响
光合作用是植物生长和干物质积累的主要途径,通过光合作用的强弱可以判断植物生长势的强弱以及其外界环境是否适宜。水分状况可以影响其自身的生理代谢,进而对其光合能力起到增强或减弱的作用[6]。前人有研究证明根据植物的光响应曲线可以有效判定植物的光合能力[7]。
由图1可以看出,不同水分梯度下杨梅的光响应曲线趋势基本一致,当光照强度为零时,各处理的净光合速率(Pn,μmolCO2·m-2·s-1)均为负值。随光照强度升高,在0 ~ 200 μmol·m-2·s-1的范围内,各处理的净光合速率均呈近似直线上升,说明苗木在弱光条件下对光强的反应敏感。光强升高到一定值后,苗木光合速率趋于稳定出现光饱和现象。

图1 不同水分梯度下杨梅的光响应曲线Fig ure 1 Photosy nthetic responses curve ofM.rubra under different moisturegradient
不同水分梯度的杨梅光响应参数见表2。由表2可知,4个水分梯度下杨梅的光饱和点(LSP)和光补偿点(LCP)间有明显的差异;T1处理对光合有效辐射的利用范围是140.55 μmol·m-2·s-1,T2、T3、T4处理的光能利用范围分别是274.56、263.15、222.05 μmol·m-2·s-1,对光合有效辐射的利用范围呈现T2>T3>T4>T1的趋势,T2约为T1的两倍,说明T2处理杨梅对光能的利用范围最宽;量子产额(AQY)越大,其光响应曲线的初始斜率越大,其对弱光能的利用效率也越高,T2处理的量子产额为0.11,为4个处理中最大,与其他3处理间存在较为显著的差异;4个处理的最大光合速率(Amax)与光合有效辐射利用范围相同,呈现T2>T3>T4>T1的趋势,T2的最大光合速率值约为最小的T1处理的两倍。表明4个处理的光能利用情况与基质水分含量有密切关系,过高或者过低的水分含量都降低其光合能力。

表2 不同水分梯度下杨梅的光合响应参数Table 2 Photosynthetic response parameter of different moisture gradient
2.2 不同水分梯度对杨梅光合速率日变化的影响
图2为杨梅叶片在各水分梯度下的净光合速率日变化。由图2可见,4个处理都呈“双峰”型,且下午的光合速率次高峰均小于上午的光合速率高峰值,其净光合速率最高峰均出现在10∶00。随着光合有效辐射的逐渐增强,净光合速率则均逐渐下降。13∶00-14∶00出现“光合午休”现象,15∶00出现光合速率次高峰。

图2 各水分梯度杨梅的光合日进程Figure 2 Diurnal course of photosynthetic response of M. rubra under different moisture gradient
T1的Pn峰值为3.52 μmol·m-2·s-1,次高峰为最大值的23.86%,日均值为1.19 μmol·m-2·s-1;T2的Pn日最大值为4.51 μmol·m-2·s-1,次高峰为最大值的26.61%,日均值为1.8 μmol·m-2·s-1;T3的Pn日最大值为5.16 μmol·m-2·s-1,次高峰为最大值的32.17%,日均值为2.17μmol·m-2·s-1;T4的Pn日最大值为6.05 μmol·m-2·s-1,次高峰为最大值的30.58%,日均值为2.59 μmol·m-2·s-1。4个水分梯度下杨梅植株的Pn呈现随基质水分含量增加而升高的趋势,日均值也呈现相似的趋势。同时,不同水分梯度对杨梅夏季光合日进程有较大影响,总体呈现水分含量愈低,光合速率愈小,“午休现象”也愈明显的趋势,其原因可能是夏季温度较高导致水分过度蒸腾,基质含水率成为植物光合作用的主影响因子。

图3 各处理不同月份的叶绿素含量Figure 3 The chlorophyll content of each treatment in different months
2.3 不同水分梯度对杨梅叶绿素含量的影响
叶绿素是植物体内最重要的色素之一,在光合作用中起着至关重要的作用,主要参与光能的吸收、传递和转化。叶绿素含量的多少可以直接影响植物的光合能力,进而在一定程度上反映植物的生长状况。
图3为不同处理叶绿素含量的变化趋势。由图3可知,不同处理其叶绿素含量间存在较显著的差异。7月T2处理的叶绿素含量最高为1.51 mg/g;8月和9月T3处理的叶绿素含量最高,分别为2.36、4.16 mg/g;10月T4处理的叶绿素含量最高,为3.25 mg/g。
总体上9月各处理杨梅的叶绿素含量最高,较其他月份均有一定程度的升高,这一变化趋势与其在光合作用上的表现相同,说明杨梅叶绿素含量与其光合作用有较显著的正相关关系。8、9和10月杨梅的叶绿素含量大体上呈现随水分含量提高而增加的趋势,这一变化也与其光合作用的变化相符。其叶绿素含量的变化与在牡丹[8]、番茄[4]等植物上的研究结果相同。
3 结论与讨论
不同水分梯度对杨梅光合能力有显著影响,其光合日进程在不同水分梯度下均为双峰型,说明植物光合日进程有其自身的遗传规律;不同水分梯度杨梅的净光合速率有显著的差异,说明植物的光合能力在一定程度上受外界环境的影响。本研究中杨梅夏季光合速率日最高峰与基质的含水量呈正相关。
不同水分梯度下杨梅叶绿素含量总体上与基质水分含量呈正相关,水分含量过低其叶绿素含量显著降低,可能与其性喜湿润的生活习性有关,导致其对水分不足的反应较为敏感。9月叶绿素含量在4个月中最高,可能是由其自身生长规律决定的。
不同的水分梯度会影响植物的生长发育,使植株的光合特性等指标产生不同程度变化。光合作用是植物体内极为重要的代谢过程,它的强弱对于植物生长、产量及其抗逆性都具有十分重要的影响,因而可用光合作用作为判断植物生长强弱的指标[9]。叶片中光合色素是叶片光合作用的物质基础,较高的叶片相对含水量可以有效的保持叶绿体的结构和光系统的功能,保证植物正常地进行光合作用,水分含量过低不仅影响叶绿素的生物合成,而且促进已形成的叶绿素加速分解,进而将影响苗木的正常光合作用[10]。本研究表明,杨梅夏季光合作用受水分含量的影响较大,其原因可能是夏季水分蒸腾较快,水分的过量散失一方面容易使杨梅受到气孔因素的限制,另一方面容易对杨梅光合器官造成损伤,使其光合能力下降。综合各项指标,夏季杨梅容器苗生产过程中基质相对含水量以65% ~ 75%较为适宜。
[1] L Zai-long,Z Shang-long,C Da-ming. Red Bayberry, A valuable evergreen fruit for tropical and subtropic areas [J]. Acta Horticul,1992(321):112-121.
[2] 李兴军,吕均良,李三玉. 中国杨梅研究进展[J]. 四川农业大学学报,1999,17(6):224-229.
[3] 宋其岩,杜国坚,陈友吾,等. 杨梅控根容器苗的光合及生理特性研究[J]. 浙江林业科技,2010,30(1):32-34.
[4] 夏秀波. 水分对有机基质栽培番茄生长、生理特性、产量品质及水分利用率的影响[D] .泰安:山东农业大学,2007.
[5] 高俊凤. 植物生理学实验指导[M]. 北京:高等教育出版社,2006.
[6] 张涛,段大娟,左卫华,等. 水分胁迫对扶芳藤生长及光合特性的影响[J]. 西北林学院学报,2007,22(3):71-73.
[7] 伍维模,李志军,罗青红,等. 土壤水分胁迫对胡杨、灰叶胡杨光合作用—光响应特性的影响[J]. 林业科学,2007,43(5):30-36.
[8] 张琪,张秀新,徐迎春,等. 土壤含水量对凤丹幼苗根颈加粗和生理特性影响[J]. 林业科技开发,2008,43(4):30-36.
[9] 惠红霞,许兴,李守明. 盐胁迫抑制枸杞光合作用的可能机理[J]. 生态学杂志,2004,23(1):5-9.
[10] Farquhar G D. Stomatal conductance and photosynthesis[J]. Ann Rev Plant Physiol, 1982(33):317-345.
Effect of Water Treatments on Photosynthesis of Container Seedlings of Myrica rubra
ZHAO Cai-fang1,2,ZHANG Nai-hua3,FANG Jian-hua3,CHEN You-wu1,2,SONG Qi-yan1,2,XIANG Ying4*
(1. Zhejiang Forestry Academy, Hangzhou 310023, China; 2. Key Laboratory of Forest Food of Zhejiang, Hangzhou 310023, China; 3. Chun’an Forestry Bureau of Zhejiang, Chun’an 311700, China; 4. Taizhou Vocational College of Science & Technology, Taizhou 318020, China)
∶Determination was implemented on photosynthesis indicators of 1-year grafting container Myrica rubra seedlings under different water treatments. The results showed significant difference. The net photosynthetic rate (Pn) and the range of light utilization of treated seedlings had positive correlation with moisture content, but too high moisture content had negative relation. The diurnal changes of Pn were two peaks curve. The maximum Pn (Pmax) in the summer occurred at about 10∶00 am, and the peaks of each treatment were different. Chlorophyll content had positive correlation with water content, similar with photosynthetic capacity. Integrated analysis demonstrated that relative moisture content in the media for container M. rubra seedling cultivation maintained 65% to 75% in the summer.
∶Myrica rubra; water controlled; photosynthesis
S723.6
A
1001-3776(2013)02-0052-04
2012-11-21;
2013-02-25
浙江省林木遗传育种创新团队项目(2010F20014);浙江省森林食品研究创新团队建设与人才培养项目(2012F20012)
赵彩芳(1963-),女,浙江东阳人,助理研究员,从事森林培育研究;*通讯作者。
