不同根际促生菌肥复合载体对燕麦产量的影响
2013-05-09韩华雯王国基赵桂琴张玉霞马文文马文彬
韩华雯,姚 拓,王国基,赵桂琴,张玉霞,马文文,马文彬
(甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
微生物肥料作为2l世纪的新型肥料,近年来发展速度极快,已在农资市场上占有一定份额,某些企业的年产量已达到5万t以上。随着人们对微生物肥料研究的不断加深,微生物肥料质量控制一直是最突出的问题。研究表明,微生物载体是影响菌剂质量的关键性因素。载体是指为微生物生存和释放提供适当环境的材料,对微生物肥料的质量有着直接的影响作用[1]。理想的载体应具有大量有序排列的微孔、比表面积大、吸附性强等特征,同时载体必须有利于菌种的生存和功能的发挥,可重复稳定生产,对作物和土壤无毒无害[2]。Ben等[3]认为接种剂载体应当具有较高的有机质含量、适宜的N含量、pH接近中性、良好的持水能力、无毒、廉价易得的特性,同时可确保微生物在载体正常存活。泥炭是应用最广泛的载体,它可以保证细菌数量大于108cfu/g[4,5],但作为一种天然矿产资源具有短期不可再生性,长期开采将造成生态环境的极大破坏,并且成本较高。因此,寻找其他的材料替代泥炭显得十分重要。
国内外常见的替代泥炭作为微生物载体的材料有土壤、蛭石、珍珠岩、硅藻土、高岭土、淤泥、聚丙烯酰胺凝胶、海藻酸钠、分解锯末、煤炭、菌糠、蔗渣、锯屑、植物堆肥、农家肥料、火山浮石[6,7]。目前,有关载体研究较少且主要集中在单一载体的筛选上,缺乏有关复合生物菌肥载体配方的研究。试验研究利用前期从植物根际分离的优良PGPR菌株,以泥炭、木炭、花土、有机堆肥为材料,分析不同基质作为微生物肥料载体的可行性,通过混合基质对菌剂活菌数的影响和对燕麦的促生效果,以期筛选出优质、廉价的微生物菌肥载体配方。
1 材料和方法
1.1 试验材料
供试基质 将木炭、泥炭、花土、有机肥、菌糠不同基质室温风干、粉碎过2mm筛,按照不同的质量比配比为6种混合配方,即配方1、配方2、配方3、配方4、配方5(正在申报国内发明专利)、配方6(表1),备用。
供试菌株 菌株由甘肃农业大学草业学院草地生物多样性实验室提供的3株优良溶磷菌(Jm170Ba-cillussp.,Jm92Pseudomonassp.,Lx191Azotobactersp.)和1株联合固氮菌(G),具有较强的固氮、溶磷、分泌IAA的能力,同时具有生长快、竞争力强及利用碳源谱广等特点[8,9]。采用广谱性的LB培养基(牛肉膏5g/L,蛋白胨10g/L,NaCI 5g/L,琼脂20g/L,pH 7.0),各供试菌株均能生长良好,且菌落形态明显。
供试材料 燕麦陇燕3号(Acena sativacv.Longyan No.3),由甘肃农业大学草业学院提供。
1.2 试验方法
1.2.1 菌悬液制作 将LB斜面培养基上生长72h的1株联合固氮菌与3株溶磷菌分别接种于100mL LB液体培养基中,置于28℃,125r/min的摇床培养3~5d,测定D660nm值,确保D660nm>0.5,并用无菌水调节D660nm值一致(使菌数量处同一水平),将各种菌悬液按1∶1∶1∶1体积比混合均匀,保存备用。
1.2.2 不同基质配比对菌株吸附效果的影响测定方法 分别称取不同基质混合配方风干样150g,置于灭菌锅121℃、25min连续灭菌2次。将灭菌的载体置于无菌操作台降至室温,倒入聚乙烯袋补加混合菌液约80mL充分混匀,封口。置于28℃的培养箱中培养7~10d,待用。分别在30、60、90、120及150d测定1次有效活菌数;采用肉眼直接观察法和显微镜观察法,检查制作的接种剂保存一段时间后是否有霉变(如青霉、曲霉污染)、是否有异味产生、是否出现变色等。
1.2.3 菌肥对燕麦生长的影响测定方法 试验在甘肃农业大学兰州牧草试验站进行,地理位置N 36.03°,E 103.53°,位于兰州市西北部,地处黄土高原西端,平均海拔1 525m,年降水量200~320mm,降水主要集中在夏季。供试土壤肥力均匀,土壤类型为黄绵土,黄土层较薄,土壤有机质含量0.84%,pH 7.28,土壤含盐量0.247%,有效氮95.05mg/kg,有效磷7.32mg/kg,有效钾182.80mg/kg。
试验采用随机区组设计,共设7个处理,3次重复(表1)。条播,小区面积12m2,种子用量为12kg/667m2,行距30cm。接种剂用量为1kg/667m2。化肥用量为美国二铵用量为3kg/667m2。
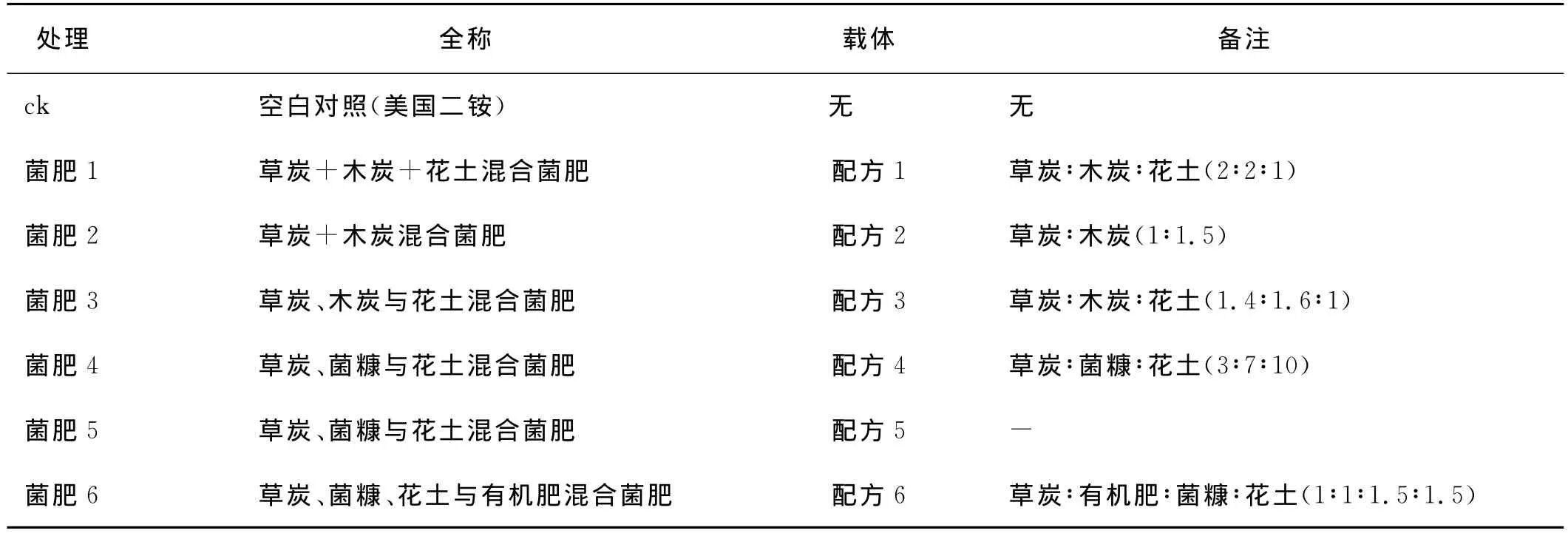
表1 试验设计Table 1 Design of experiments
播种及田间管理 将制作好的接种剂与种子混合拌种,于2011年4月12日进行播种。播深3~4cm,常规田间管理。
于次年分别测定不同菌肥处理下植株的自然高度,每样地随机取15株,取其平均值,干草产量的测定分别在灌浆期和成熟期进行,每区每处理随机取1m2样段齐地刈割。刈割后晒干称重,并换算成每公顷的干草产量和籽粒产量。
1.2.5 数据处理 试验数据采用Excel与SPSS13.0进行统计分析,多重比较为Duncan法。
2 结果与分析
2.1 不同基质配比对菌株吸附效果的影响
载体的吸附效果是表征菌肥载体的一项重要指标,通过稀释平板法统计各基质配方对菌株的吸附效果(表2)。
混合基质配方的吸附效果试验结果表明,储存于室温,经30、60、90、120、150d,其有效活菌数均在108cfu/g以上,无污染,符合《微生物肥料》NY227-94标准;存30d时,菌肥1、2之间差异不显著(P>0.05),但与其余菌剂之间差异显著(P<0.05),其中,菌肥1的有效活菌数最高,为2.0×1011cfu/g,而菌肥6的活菌数最低为3.34×109cfu/g。储存60d时,各菌肥之间的差异均不显著,菌肥4的有效活菌数最多。

表2 不同基质配比下菌株的吸附效果Table 2 The effects of different substrates on absorption capacity of strains cfu/g
储存90d时,以菌肥2的活菌数最高(5.00×108cfu/g),与菌肥1和5差异不显著,菌肥4的活菌数最低,为0.67×108cfu/g。储存120d时,菌肥1活菌数显著优于其余处理,其活菌数高达232×108cfu/g,其余处理差异不显著。储存150d时,不同菌剂的活菌数高低为菌肥5>菌肥4>菌肥1>菌肥2>菌肥6>菌肥3,其中,菌肥5与其余处理之间存在显著性差异。

图1 不同菌剂活菌数的动态变化Fig.1 The dynamic change of viable bacteria for different microbial inoculum
从图1可以看出,不同基质配比的菌肥有效活菌数均随贮存时间的延长整体呈现“下降—上升—下降”的趋势,且90d有效活菌数均达到最低值,110d有效活菌数再次出现峰值。菌肥1、2、3的生长模型相似,菌肥4、5相似。但从总体趋势分析,各菌肥的活菌数随贮存时间延长呈现减少的趋势,这是由各菌肥中营养物的含量,产生有效菌对其的消耗及有效菌的产生及死亡最终达到平衡而决定。
2.2 菌肥对燕麦生长的影响
2.2.1 菌肥对燕麦株高的影响 株高是植物的形态指标,植株高大,有利于形成较高植物产量,而成熟期的株高直接决定作物地上植物量。结果表明,不同的施肥处理对燕麦株高影响显著(图2),菌肥处理燕麦株高较ck提高1.06%~15.21%,其中,菌肥1的株高最高(119.9cm),而ck仅为104.0cm。除菌肥1外,其余各处理均与ck差异不显著(P>0.05),菌肥1效果最佳,菌肥4次之,菌肥2效果最差。
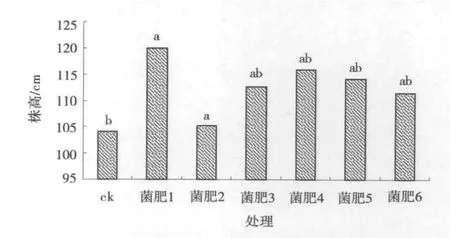
图2 不同菌肥成熟期燕麦株高Fig.2 Height in maturing period of oat of different bio-fertilizers
2.2.2 菌肥对燕麦干草产量的影响 不同菌肥由于其配比方式不同导致其有效菌数量各异,进而影响接种作物的干草产量。不同菌剂的施肥效果因燕麦物候期不同而存在明显差异。灌浆期,除菌肥3和菌肥6以外,其余各菌肥草产量均高于ck,前者草产量为2 409.85~2 735.35kg/hm2,而ck仅为2 392.26 kg/hm2,前者为后者的1.0~1.1倍。其中,菌肥1干草产量最高,菌肥3干草产量最低。ck的干草产量与菌肥1燕麦干草产量差异显著(P<0.05),与其余各菌肥处理差异不显著(P>0.05);成熟期燕麦干草产量较ck提高4.71%~24.05%,平均增产12.6%(表3),其中,菌肥5干草产量2842.88kg/hm2,为最高,菌肥1次之,菌肥2最低。ck的干草产量与菌肥1、菌肥5差异显著(P<0.05),与其余各处理差异不显著(P>0.05)。

表3 不同菌肥下燕麦干草产量Table 3 Hay yield of oat of different bio-fertilizers
针对燕麦生长不同的物候期(灌浆期和成熟期),菌肥1和菌肥5的促生效果明显。菌肥1相对ck的草产量平均增长17.36%,菌肥5平均增长14.47%。
2.2.3 菌肥对燕麦籽粒产量的影响 随施用菌肥类型的不同,燕麦籽粒产量存在较大差异(图3)。除菌肥2,4和6外,其余处理籽粒产量显著高于对照,分别较ck提高1.7%~10.8%,其中,以菌肥1的籽粒产量最高,为5 277.5kg/hm2,菌肥5次之,为4 850kg/hm2,而菌肥6最低,为4 232kg/hm2。菌肥1与各处理差异均显著(P<0.05),菌肥3和5与ck的大田施用效果相似(P>0.05),其余处理燕麦籽粒产量不及ck,说明菌肥1对燕麦经济产量促产效果显著。
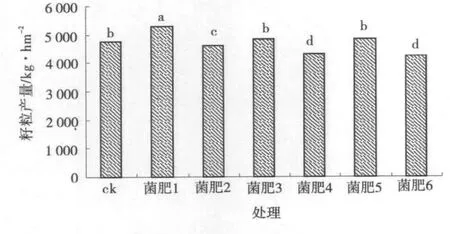
图3 不同菌肥下燕麦籽粒产量Fig.3 Oat grain yield of bio-fertilizers
3 讨论与结论
研究表明,以不同混合基质作为PGPR菌剂载体,随着贮存时间的延长,活菌数呈“下降—上升—下降”的趋势,90d活菌数降低至最低值,其中,120d活菌数略微回升,但始终低于30d活菌数,可能由于养分和空间的不足导致大量菌株在90d死亡,而其又能被部分存活的菌株再次吸收利用使得活菌数出现二次峰值。贮存期内以配方1为载体的菌肥的活菌数最优,而菌肥2的活菌数次之,可能由于该载体配方的pH接近中性,适宜于菌株的生长繁殖。综上所述,除90d菌肥4活菌数过低0.67×108cfu/g,其余处理贮存0~150d活菌数符合《微生物肥料》NY227-94质量标准[11],且未出现污染和霉变现象。因此,为了保证菌肥的肥效,建议贮存4个月使用为宜,或可尝试在其中加入一定比例的真菌抑菌剂以延长各菌肥的贮存时间[12]。
此次研究施用PGPR菌肥对燕麦的地上部的影响与叶喜文等[13]PGPR促生菌肥在水稻上应用效果的影响一致。我国自1994年已有4 000hm2小麦使用了彭于发等[14]开发的“荧光93”。中国科学院沈阳应用生态研究所应用海洋放线菌MB-97的PGPR始于1997年,研制的PGPR于2000年获得农业部产品认证并开始商品化生产与销售,在重茬大豆上应用已达2.0×104hm2,增产15%。孙淑荣等[15]报道,通过2年4点玉米接种PGPR复合制剂田间试验结果,不但增产效果显著,而且十分稳定。可使玉米平均增产11.01%,增产幅度为7.35%~15.26%,并可替代10%~20%的化肥。可减少投入750~1 050元/hm2。韩文星等[16]在PGPR菌肥对燕麦根系性状影响的研究中报道,PGPR菌肥均可明显促进燕麦各生育期主根长,与空白对照CK相比,燕麦主根长、根体积和根系干重分别增加16.70%~23.52%,26.87%~35.83%和53.55%~65.30%。张堃等[17]报道,PGPR菌肥对3种禾本科牧草苗期株高均有不同程度的促进作用,但其效果还不能和化肥相比。叶喜文等[13]在PG-PR促生菌肥在水稻上应用效果研究中表明,施用PGPR菌肥能显著的改善水稻的各种经济性状,使株高、穗长、有效分蘖、结实率、千粒质量都明显的增加。
施用PGPR菌肥对燕麦的干草产量和籽粒产量有一定的影响,而其对燕麦的株高影响不大,原因在于在燕麦生长发育的早期施用化肥的效果更加凸显。菌肥的促生效果与植物的根系状况有着密切的关联,而植物根系的发生、生长和生理活性等受到所施用肥料的种类、施用量、施用时期和施用方法的影响。因此,施用PGPR促生菌肥应注意肥料的生产日期,最好当年施用,否则肥效会明显降低,同时,还应注意土壤生态环境如水分、湿度、通气状况、pH等要适宜于有益微生物活动,以提高其肥效。
目前PGPR菌肥只能和化肥同时使用,在保证产量的基础上,发挥其生态效益。PGPR菌肥的应用效果仍然不容忽视,PGPR菌肥与化肥相比,具有成本低、使用安全、持续效果好、增产稳定及对环境、食品安全危害低和经济效益高等优点[18],研究证实PGPR[19]一是植物的联合固氮作用;二是分泌植物激素,可促进植物有效地吸收水分和养分,同时对植物体其他生命活动进行调控[20];三是溶解土壤中的不可利用磷,将其转化为可溶性磷;四是分泌抗生素,增强植物抗逆性[21]。PGPR作为生物肥料用于各种气候和土壤条件下的农作物均有巨大的潜力,既可以提高农作物的产量,亦可降低农业生产的成本,减少化肥的污染,改善生态环境。但是,由于我国微生物肥料生产中还存在着产品活菌数低、品种少、效果不稳定、成本和价格较高等问题,还有待于进一步研究。
以不同混合基质为PGPR菌剂载体,除菌肥4外,其余处理活菌数均符合《微生物肥料》NY227-94质量标准,其中,菌肥1、2的活菌数最优,适宜作为PGPR菌肥载体;施用不同PGPR菌肥对燕麦的株高、干草产量和籽粒产量具有明显的促进作用,其中各处理对株高影响不显著,而燕麦草产量的增产效果与作物所处的生育期有关,灌浆期菌肥1的促生效果良好,成熟期菌肥5的促生效果较佳。菌肥1干草产量和籽粒产量较ck分别提高20.4%和10.8%,说明以配方1具有作为PGPR菌肥的良好潜力。
[1]李永兴,匡柏健,李久蒂.不同载体对微生物菌剂质量的影响[J].土壤肥料,1999(6):30-32.
[2]章淑艳.粉煤灰在硅酸盐菌剂中的应用[J].河北省科学院学报,2006,23(3):30-33.
[3]Ben Rebah F,Tyagi R D,revost D P.Wastewater sludge as a substrate for growth and carrier for rhizobia:the effect of storage conditions on survival of Sinorhizobium meliloti[J].Bioresource Technology,2002,83:145-151.
[4]Burton J C.Monitoring quality in legume inoculants and pre-inoculated seed [J].Proceedings of the IX Reunion Labinoa-mericanasobre Rhizobium,Mexico,1978,308-325.
[5]Peterson H,Loynachan T E.The significance and application of Rhizobium in agriculture[J].Rev Cytol Suppl,1981,13:311-331.
[6]FerreiraE M,CastroI V.Residues of the Cork Industry as Carriers for the Production of Legume Inoculants[J].Silva Lusitana,2005,13(2):159-167.
[7]梅丽娜,姚拓,刘雯雯,等.接种外源微生物对蘑菇渣堆肥的影响[J].草原与草坪,2010,30(4):81-84.
[8]刘青海,姚拓,马从,等.6株溶磷菌和4株固氮菌混合培养条件的研究[J].草原与草坪,2011,31(6):1-6.
[9]荣良燕,姚拓,刘青海,等.复合菌肥代替部分化肥对玉米生长的影响[J].草原与草坪,2012,32(6):65-69.
[10]谭周进,肖罗,谢丙炎,等.假单胞菌的微生态调节作用[J].核农学报,2004,18(1):72-76.
[11]农业部微生物肥料质量监督检验测试中心.Y227-94[S].北京:中国标准出版社,1994.
[12]吴皓琼,沙长青,牛彦波,等.保护剂与抑菌剂对生物肥料保存期的影响[J].生物技术,2004,14(6):55-56.
[13]叶喜文,焦峰,吴金花,等.PGPR促生菌肥在水稻上应用效果研究[J].黑龙江八一农垦学报,2005,17(1):9-11.
[14]王金生,赵立平,冯家勋.重组植物病害防治微生物[C]//黄大,林敏.农业微生物基因工程.北京:科学出版社,2001:316-408.
[15]孙淑荣,吴海燕,刘春光,等.PGPR复合制剂对玉米增产效果的研究[J].吉林农业科学,2004,29(5):22-28.
[16]韩文星,姚拓,梁启鹏,等.PGPR菌肥对燕麦根系性状影响的研究[J].草原与草坪,2008(4):1-4.
[17]张堃,张德罡,姚拓,等.PGPR菌肥制作及其对高寒牧区3种禾本科牧草苗期株高的影响[J].草原与草坪,2006(3):49-52.
[18]姚拓.促进植物生长菌的研究进展[J].草原与草坪,2002(4):3-5.
[19]Schippers B.Interactions of deleterious and beneficial rhiaosphere microorganisms and the effect of cropping practices[J].Ann Rev Phytopathol,1987,25:339-58.
[20]Shafiq Hussain,Mirza M S,Malik K A.Production of Phy-tohormones by the Nitrogen Fixation Bacteria Isolated from Sugarcane[J].Biohorizons,1999,2(1-4):61-76.
[21]林敏,尤崇杓.根际联合固氮作用的研究进展[J].植物生理通讯,1992,28(5):323-329.
