星形细胞瘤MRI扩散加权成像、肿瘤细胞密度与缺氧诱导因子-1α表达水平的相关性
2013-05-06崔永鹏CUIYongpeng
崔永鹏 CUI Yongpeng
舒 畅 SHU Chang
朱雁兵 ZHU Yanbing
王 欢 WANG Huan
郁文芝 YU Wenzhi
星形细胞瘤MRI扩散加权成像、肿瘤细胞密度与缺氧诱导因子-1α表达水平的相关性
崔永鹏 CUI Yongpeng
舒 畅 SHU Chang
朱雁兵 ZHU Yanbing
王 欢 WANG Huan
郁文芝 YU Wenzhi
目的探讨高级别和低级别星形细胞瘤MRI DWI、肿瘤细胞密度与缺氧诱导因子-1α(HIF-1α)表达水平的相关性。资料与方法对术后病理确诊的33例星形细胞瘤患者术前行MRI DWI检查,并计算肿瘤实质部分的ADC值;用Scion Image 4.0.3.2软件计算肿瘤细胞密度;采用免疫组化检测HIF-1α的表达情况。结果低级别星形细胞瘤的平均ADC值高于高级别星形细胞瘤,差异有统计学意义(t=7.300, P<0.001)。高级别星形细胞瘤平均细胞密度值明显大于低级别星形细胞瘤,差异有统计学意义(t=-3.845, P<0.01)。低级别和高级别星形细胞瘤中均有HIF-1α表达,其表达强度分别为(20.08±10.01)%、(47.91±19.03)%。肿瘤ADC值与HIF-1α标记指数、肿瘤细胞密度值呈显著负相关(r=-0.756、-0.617, P<0.001),HIF-1α和肿瘤细胞密度值呈显著正相关(r=0.622, P<0.001)。结论ADC值有助于初步判定星形细胞瘤的性质,对低级别和高级别星形细胞瘤有一定的鉴别价值。HIF-1α在星形细胞瘤中的作用应扩大样本量进一步深入研究。
星形细胞瘤;磁共振成像,弥散;扩散加权成像;表观扩散系数;肿瘤细胞;细胞计数;缺氧诱导因子-1α
恶性肿瘤的发生与细胞过度增殖有关,而细胞增殖需要消耗大量的氧,所以缺氧是实体肿瘤微环境的基本特征之一。缺氧诱导因子-1α(HIF-1α)是广泛存在于人体细胞的转录调节因子,与肿瘤的生长繁殖、侵袭、转移,新生血管的生成、凋亡、耐药等特征密切相关[1]。目前有关DWI在神经系统方面的应用研究较多[2]。本研究探讨不同级别星形细胞瘤患者MRI DWI、肿瘤细胞密度与HIF-1α表达水平的相关性,评价MRI诊断星形细胞瘤在缺氧条件下的生长、侵袭、增殖能力及恶性程度的价值,以提高星形细胞瘤病理级别判断的正确率,更好地指导临床治疗及预后评估。
1 资料与方法
1.1 研究对象 收集2007-04~2011-05开滦总医院收治的经病理证实的33例星形细胞瘤患者,其中低级别星形细胞瘤(WHO Ⅰ~Ⅱ级)18例,高级别星形细胞瘤(WHO Ⅲ~Ⅳ级)15例。低级别星形细胞瘤组男7例,女11例;年龄27~68岁,平均(48.5±7.5)岁;高级别星形细胞瘤组男9例,女6例;年龄22~57岁,平均(43.5±6.5)岁。两组年龄、性别差异均无统计学意义(P>0.05),具有可比性。
1.2 ADC值测量 采用GE 1.5T超导型MR扫描仪,检查顺序为:常规扫描、DWI、增强扫描。常规扫描参数:自旋回波(SE) T1WI:TR/TE 2126/22 ms;快速恢复快速自旋回波(FRFSE) T2WI:TR/TE 4300/102 ms;MRI液体衰减反转恢复(FLAIR)序列:TR/TE 8502/125 ms。采用头颅正交线圈,层厚6 mm,层间隔1 mm,重建视野24 cm×24 cm,距阵 320×224。DWI采用SE序列平面回波成像,TR/TE 6000/76 ms。在读出(Read)、相位(Phase)编码和层面(Slice)选择3个方向上施加扩散梯度,b值取0、1000 s/mm2。轴位扫描层厚6 mm,层间隔1 mm,视野(FOV) 24 cm×24 cm,距阵128×128,成像时间64 s。增强扫描采用钆喷替酸葡甲胺作为造影剂,经肘静脉注入后行T1WI轴位、冠状位、矢状位扫描。采用头颅正交线圈,层厚6 mm,层间隔1 mm,FOV 24 cm×24 cm,距阵 320×224。在图像浏览器中选择“弥散扫描”,点击“Functool 2”图表,点击“ADC”按键,进入弥散图像后处理界面,调节原始图像到合适的窗宽、窗位。调节阈值后,在同一屏幕上同时生成ADC图、eADC图和原始的DWI取样图层。感兴趣区(ROI)放置于肿瘤实质内,并尽量保持同一患者ROI的外形、大小和解剖位置一致。将eADC图替换为T1WI增强扫描、FLAIR或T2WI FRFSE序列的取样图层,可以使ROI更准确地放入肿瘤实质内。ROI为20~40 mm2,测量3次ROI的ADC值取平均值;对照侧ROI选择与肿瘤相对应部位的对侧脑白质,测量3次ADC值取平均值。
1.3 肿瘤细胞密度测定 由2名病理学主任医师采用双盲法在光镜下根据最新WHO分级标准[3]对肿瘤病理进行分级,同时摄取典型病理图片。采用Scion Image 4.0.3.2软件对病理照片进行分析,计算单位面积肿瘤组织中肿瘤细胞面积所占百分比,即肿瘤组织的细胞密度构成。
1.4 免疫组化检查 采用免疫组化法检测与MRI资料相对应的星形细胞瘤标本中的HIF-1α表达状况,按上海长岛生物技术有限公司提供的免疫组化试剂盒说明书进行操作。HIF-1α购自武汉博士德生物工程有限公司,浓度为1∶50。HIF-1α以细胞核有浅黄色、棕色、棕褐色颗粒为阳性细胞,每张切片分别在上、下、左、右和中心区各随机选择一个高倍视野(×400),计算肿瘤细胞密度值。
1.5 统计学方法 采用SPSS 13.0软件,低级别和高级别星形细胞瘤组平均ADC值、平均细胞密度值、HIF-1α标记指数比较采用t检验,ADC值、rADC值、细胞密度值及HIF-1α标记指数的相关性采用Pearson相关分析,P<0.05表示差异有统计学意义。
2 结果
2.1 星形细胞瘤的影像学特点 低级别星形细胞瘤边界清楚,肿块信号均匀,见图1。高级别星形细胞瘤边界不清楚,肿块信号不均匀,见图2。
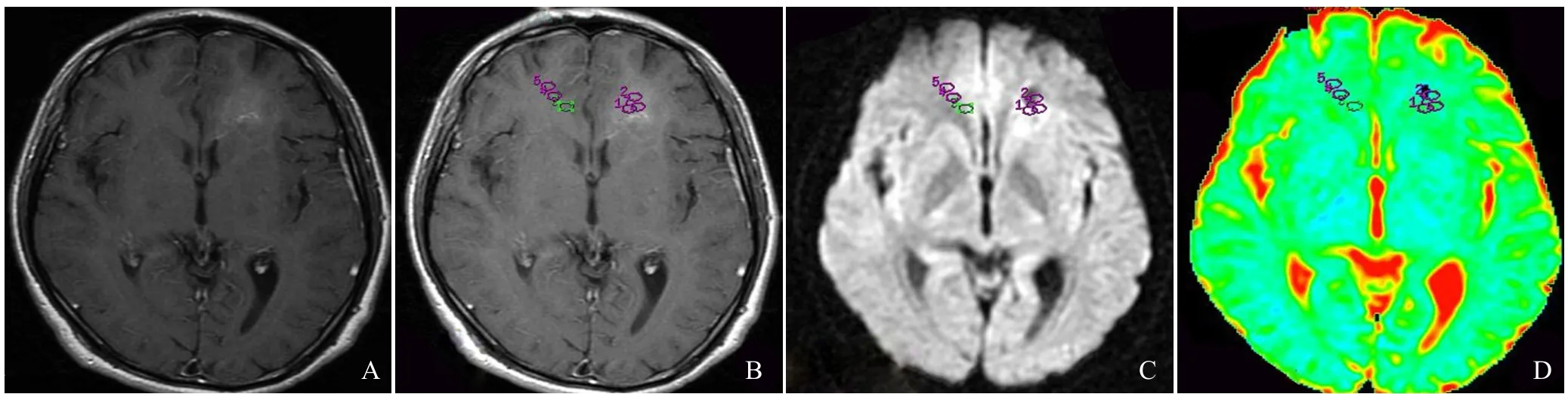
图1 患者男,40岁,低级别星形细胞瘤。肿瘤边界清楚,肿块信号均匀。A为T1WI图像,B为T1WI增强图像,C为DWI图像,D为ADC图像
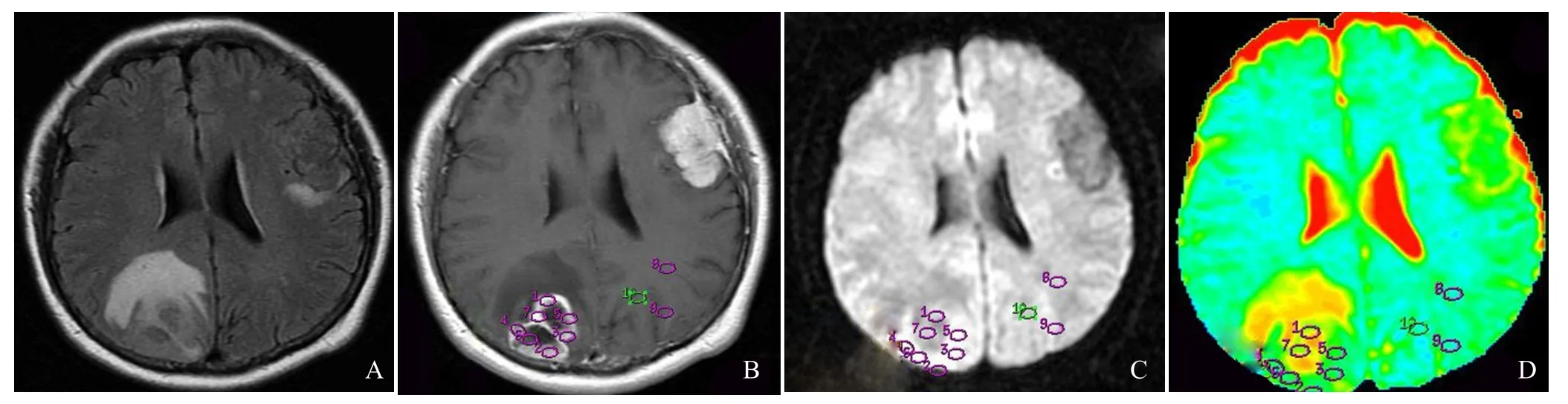
图2 患者女,61岁,高级别星形细胞瘤。肿瘤边界不清楚,肿块信号不均匀。A为T1WI图像,B为T1WI增强图像,C为DWI图像,D为ADC图像
2.2 MRI测量结果与星形细胞瘤病理分级的关系低级别星形细胞瘤肿瘤实质部分的平均ADC值为(1619.24±376.22)×10-3mm2/s,高于高级别星形细胞瘤的(954.29±80.63)×10-3mm2/s,差异有统计学意义(t=7.300, P<0.001)。高级别星形细胞瘤平均细胞密度值为(20.13±0.10)%,明显大于低级别星形细胞瘤的(9.36±5.38)%,差异有统计学意义(t=-3.845, P<0.01)。正常脑组织中未见HIF-1α表达,低级别和高级别星形细胞瘤中均有HIF-1α表达,低级别星形细胞瘤的平均HIF-1α标记指数为(20.08±10.01)%,高级别星形细胞瘤为(47.91±19.03)%,差异有统计学意义(t=-5.104, P<0.001)。
2.3 各测量指标间的相关性 肿瘤ADC值与HIF-1α标记指数、肿瘤细胞密度值呈负相关(r=-0.756、-0.617, P<0.001),HIF-1α与肿瘤细胞密度呈正相关(r=0.622, P<0.001)。
3 讨论
常规CT及MRI检查难以定量反映星形细胞瘤的成分及微结构状态,DWI使MR对人体的研究深入到了更微观的水平。脑组织中水分子的扩散大小和方向取决于扩散屏障的通透性、空间、介质的黏滞度及观察时间,同时受毛细血管血流、组织细胞对水的主动转运过程等因素的影响[4]。星形细胞瘤肿瘤组织取代正常脑组织,肿瘤组织的细胞间隙影响间质水分子扩散,肿瘤细胞密度越高,间质成分越少,则组织中水分子扩散运动越弱,反之亦然。本研究结果表明,高级别和低级别星形细胞瘤的ADC值与组织中的细胞密度值呈显著负相关关系,高级别肿瘤生长活跃,细胞密度高,ADC值小;低级别肿瘤生长缓慢,细胞密度低,ADC值大。虽然肿瘤囊变或坏死可能会使ADC值上升,但是本研究在计算ADC值时,参照既往避开肿瘤囊变或坏死部位的方法[5],通过T1WI强化、T2WI及FLAIR序列成像图像对比,避开了囊变或坏死部位。但经计算得出的星形细胞瘤的肿瘤实质部分ADC值与细胞密度值仅中度相关(r=-0.617),可能是由于除了细胞构成比之外还有其他因素影响肿瘤的ADC值,比如肿瘤基质、纤维成分或胶质成分等[6]。然而,活体肿瘤细胞密度是影响肿瘤内水分子扩散的关键因素,星形细胞瘤中水分子的扩散主要受细胞密度的影响,肿瘤实质部分ADC值越低,DWI上信号越高,DWI可以在一定程度上反映星形细胞瘤的分子生物学相关行为。
缺氧是一种普遍的生理和病理现象,无法调控地增殖是肿瘤细胞的主要特征,其侵袭性生长方式及转移依赖新生血管网的产生,肿瘤因为细胞密度增加,组织增生过快必然导致局部组织低氧、低糖和酸性,为适应缺氧微环境,肿瘤组织形成多血管体系,同时使肿瘤更具侵袭性[7]。HIF-1α是介导细胞对缺氧微环境进行适应性反应的关键性转录调控因子,是肿瘤血管生成的核心调控因子。星形细胞瘤的浸润性生长导致局部缺氧微环境,HIF-1α在低氧应激中发挥抗凋亡蛋白的作用。本研究中,HIF-1α在正常脑组织中不表达,在低级别和高级别星形细胞瘤中均表达,且其表达强度随星形细胞瘤病理级别的升高而增强。本研究中HIF-1α标记指数与肿瘤细胞密度值呈明显正相关,与ADC值呈明显负相关,表明HIF-1α与肿瘤细胞恶性增殖有关。肿瘤区ADC值与HIF-1α标记指数、肿瘤细胞密度值呈显著负相关,表明脑DWI是星形细胞瘤诊断与病理分级的重要方法。肿瘤的无限增殖逐渐加重缺氧状态,HIF-1α表达水平增加,促进促红细胞生成素转录表达,进而促进肿瘤细胞繁殖。细胞繁殖越旺盛、密度越高、生物膜结构对水分子的扩散限制作用越明显,ADC值越低,DWI上信号越强。迄今为止,HIF-1α已确定的靶基因至少有60多种,涉及细胞的能量代谢、血管生成等,为低氧的肿瘤细胞提供能量,从而增强肿瘤细胞的生存能力。糖酵解系统中磷酸果糖激酶、丙酮酸激酶M、乳酸脱氢酶、3-磷酸甘油醛脱氢酶、烯醇化酶-1等基因调控序列上均存在HIF-1α结合位点,HIF-1α通过增强这些基因的表达,提高葡萄糖转运、糖酵解,促进肿瘤细胞分裂增殖和向恶性转化[8]。本研究涉猎神经肿瘤学与神经影像学交叉学科,国内外相关报道较少。
总之,ADC值可以初步判定星形细胞瘤性质,对低级别和高级别星形细胞瘤有一定的鉴别价值,有助于术前诊断,应进一步推广使用。低氧是肿瘤微环境改变的特征,HIF-1α是调节细胞适应低氧的转录激活因子,通过不同途径使肿瘤细胞适应低氧微环境,在肿瘤细胞密度增殖中发挥着重要作用,应进一步深入研究HIF-1α在星形细胞瘤中的作用。
[1] Li Z, Wang J, Gong L, et al. Correlation of delta-like ligand 4 (DLL4) with VEGF and HIF-1α expression in human glioma. Asian Pac J Cancer Prev, 2011, 12(1): 215-218.
[2] Sundin A. Imaging of neuroendocrine tumors. Expert Opin Med Diagn, 2012, 6(5): 473-483.
[3] 杨树源, 只达石. 神经外科学. 北京: 人民卫生出版社, 2008: 500-503.
[4] 胡佳寿, 田洪梓, 孙金凤, 等. 磁共振全身弥散加权成像在体部肿瘤筛查中的应用. 中国医学影像学杂志, 2011, 19(9): 695-699.
[5] Leonard F, Devaux Y, Vausort M, et al. Adenosine modifies the balance between membrane and soluble forms of Flt-1. J Leukoc Biol, 2011, 90(1): 199-204.
[6] Wilde EA, Ayoub KW, Bigler ED, et al. Diffusion tensor imaging in moderate-to-severe pediatric traumatic brain injury: changes within an 18 month post-injury interval. Brain Imaging Behav, 2012, 6(3): 404-416.
[7] 李丽艳, 周顺科, 刘军, 等. 乳腺癌多层螺旋CT灌注成像与微血管生成的相关性研究. 中国医学影像学杂志, 2012, 20(1): 13-18, 21.
[8] Roos TU, Heiss EH, Schwaiberger AV, et al. Caffeic acid phenethyl ester inhibits PDGF-induced proliferation of vascular smooth muscle cells via activation of p38 MAPK, HIF-1α, and heme oxygenase-1. J Nat Prod, 2011, 74(3): 352-356.
(责任编辑 唐 洁)
Correlation Between Diffusion Weighted Imaging, Tumor Cellularity and Expression Level of Hypoxia-inducible Factor-1α in Cerebral Astrocytoma
PurposeTo evaluate the correlation among diffusion weighted imaging (DWI), tumor Cellularity and hypoxia-inducible factor-1α (HIF-1α) for the high and low grade astrocytoma.Materials and MethodsDWI was applied with 33 patients with astrocytoma confirmed by pathology, and ADC value was measured. Tumor Cellularity was measured using Scion Image 4.0.3.2. The expression of HIF-1α was tested using immunohistochemisty.ResultsMean ADC value was higher in the low grade astrocytoma than that in the high grade astrocytoma (t=7.300, P<0.001). The tumor Cellularity was higher in the high grade astrocytoma than that in the low grade astrocytoma (t=-3.845, P<0.01). HIF-1α expression could be demonstrated in the low grade [(20.08±10.01)%] and high grade [(47.91±19.03)%] astrocytoma. The negative correlation was demonstrated between ADC value and HIF-1α and tumor Cellularity (r=-0.756, -0.617; P<0.001). The positive correlation was demonstrated between HIF-1α and tumor Cellularity (r=0.622, P<0.001).ConclusionADC value can be used to discriminate the low and high grade astrocytoma, and the role of HIF-1α should be further to study with enlarged sample.
Astrocytoma; Diffusion magnetic resonance imaging; Diffusion weighted imaging; Apparent diffusion coefficient; Tumor cells; Cell count; Hypoxia-inducible factor-1α
开滦总医院神经外科 河北唐山 063000
崔永鹏
Department of Neurosurgery, Kailuan General Hospital, Tangshan 063000, China
Address Correspondence to: CUI Yongpeng
E-mail: klyyshch@sina.com
R730.264;R445.2
2013-06-03
修回日期:2013-09-23
中国医学影像学杂志
2013年 第21卷 第12期:891-893,898
Chinese Journal of Medical Imaging
2013 Volume 21(12): 891-893, 898
10.3969/j.issn.1005-5185.2013.12.003
