不同微生物脂肪酶对油脂水解特性的比较研究
2013-05-04雷建平冯定远左建军
雷建平,叶 慧,冯定远,左建军*
(1.广东温氏食品集团稔村分公司,广东 云浮 527422;2.华南农业大学动物科学学院,广州 510630)
脂肪酶是一种水解酶,在有水条件下能够作用于甘油三酯的羧基释放脂肪酸和甘油。其天然底物是长链甘油三酯,长链甘油三酯在水中溶解性很低,水解反应在油-水界面催化。脂肪酶是广泛存在于各类动物、植物和微生物中的一种酶,在脂质代谢中发挥重要作用,具有显著的生理意义和生产应用的潜能[1]。微生物源脂肪酶种类丰富,包括细菌、霉菌和酵母等来源,产生的脂肪酶具有比动植物脂肪酶作用更广的反应pH、温度范围以及反应底物。目前,微生物脂肪酶主要应用在洗涤去污、食品加工、造纸工业、有机化学、生物转换、油脂化工等领域[2-3]。
以动物消化道作为酶反应场所,其环境既具有稳定性又有不可控性,特定动物的消化道其特定部位的pH、温度基本是稳定的,但动物生理状态和日粮品种等许多因素不可控。相对于植物和动物源脂肪酶而言,微生物脂肪酶具有更强的适应性,因此更适合作为饲料添加剂作用于动物肠道,促进动物肠道内脂质消化和吸收。
1 材料与方法
1.1 试验材料
脂肪酶:微生物脂肪酶单酶A、B、C、D,由4家不同酶制剂公司提供。其中酶A、B来源于黑曲霉,酶C、D来源于假丝酵母。油脂:猪油、鱼油、棕榈油、豆油、花生油由广州某油厂提供。试验试剂:对硝基苯酚、对硝基苯酚丁酸酯(pNPB,C4)、对硝基苯酚辛酸酯(pNPO,C8)、对硝基苯酚月桂酸酯(pNPL,C12)、对硝基苯酚棕榈酸酯(pNPP,C16)购于Sigma公司,其他均为分析纯。
1.2 主要试验设备
电热恒温水浴锅、台式低温离心机、移液枪、高速匀浆机、pH计、电磁搅拌器、酶标仪、超声波粉碎机、滴定管等。
1.3 试验方法
1.3.1 酶液制备
精确称取一定量酶粉用Tris-Hcl缓冲液溶解,用电磁搅拌器搅拌30min,将全部溶液小心倒入50mL离心管中,沉淀部分再加一定量的缓冲液,如此反复洗3~4次,最后全部溶液移入50mL离心管,3 000 rpm离心10min。吸取上清液至定容瓶,沉淀部分再加一定量的缓冲液离心,反复2~3次,上清液定容至50mL,4℃保存备用。
1.3.2 脂肪酶酶活测定方法
电位滴定法:参考《GB/T 23535-2009脂肪酶制剂》采用电位滴定法,即使用橄榄油为底物,通过检测反应释放的脂肪酸或甘油来检测酶活力。以不同的对硝基苯酯为反应底物,1为以对硝基苯酚的绝对量(μmol)为横坐标,OD405值为纵坐标,绘制的标准曲线见附图。

附图 对硝基苯酚浓度标准曲线
1.3.3 脂肪酶水解专一性的测定
利用比色法,在pH 7.0的条件下,40℃水浴,以具有不同长度碳链的对硝基苯酚酯为底物,即pNPB、pNPO、pNPL、pNPP,并测定不同脂肪酶的相对酶活,重复3次计算平均值。
1.3.4 脂肪酶最适反应pH的测定
利用比色法,酶反应体系中缓冲液的pH分别为 5.0、6.0、7.0、8.0、9.0,以 pNPO 为 底物 ,40℃水浴测定不同脂肪酶相对酶活,重复3次计算平均值。
1.3.5 脂肪酶最适反应温度的测定
利用比色法,在pH 7.0的缓冲液中,以pNPO为底物,测定脂肪酶在30、40、50、60、70℃下的相对酶活,重复3次计算平均值。
1.3.6 脂肪酶对天然油脂水解效果的测定
利用电位点滴法,分别以橄榄油、猪油、鱼油、棕榈油、豆油、花生油作为水解底物,比较不同脂肪酶水解能力,重复3次计算平均值。其中以橄榄油为底物测定的绝对酶活为100%,计算其他底物条件下的相对酶活。
2 结果与分析
2.1 脂肪酶水解专一性测定
4种脂肪酶对不同链长底物的水解结果见表1。

表1 不同底物条件下脂肪酶的相对酶活 %
由表1可知,脂肪酶A最优水解底物为C12,脂肪酶B、C、D最优水解底物均为C8;除脂肪酶A对C16水解效果达到28.74%外,其余3种脂肪酶对C16水解效果均低于10%,可见4种脂肪酶对含长链脂肪酸酯水解效果都没有水解含中短链脂肪酸酯的效果好。
2.2 脂肪酶最适pH的测定
4种脂肪酶最适反应pH的测定结果见表2。
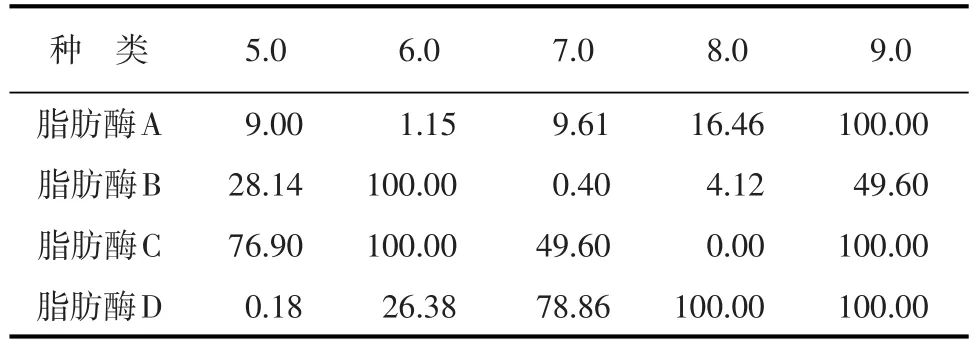
表2 不同pH条件下脂肪酶的相对酶活 %
由表2可知,脂肪酶A、C、D的最适pH均为9.0,脂肪酶B的最适pH为8.0。4种脂肪酶在酸性条件下(pH=5.0或6.0),水解效果均不如最适pH条件,在pH 5.0的条件下,4种脂肪酶相对酶活分别只有最适pH条件下的1.15%、0.40%、0%、1.68%,其中脂肪酶C在酸性条件下相对酶活最低,脂肪酶D在酸性条件下相对酶活最高;但总体而言,4种脂肪酸在酸性条件下水解效果都不理想,均属于弱碱性脂肪酶。
2.3 脂肪酶最适温度的测定
4种脂肪酶最适反应温度的测定结果见表3。

表3 不同温度条件下脂肪酶的相对酶活 %
由表3可知,脂肪酶A、B的最适温度均为40℃,脂肪酶C、D的最适温度为60℃,可见4种脂肪酶中黑曲霉源的脂肪酶最适温度低于假丝酵母源的脂肪酶。脂肪酶A、B、D在70℃条件下只有最适温度条件下的24.01%、29.90%、18.92%相对酶活,而脂肪酶C在70℃条件下仍保持99.52%的相对酶活,表明脂肪酶C具有很好的耐热性。但脂肪酶C、D在接近动物体内温度(40℃)条件下分别只有47.12%、34.86%相对酶活,比黑曲霉源脂肪酶低。
2.4 脂肪酶对天然油脂水解效果的测定
在pH为7.0,温度为40℃条件下,由滴定法以橄榄油为底物测得脂肪酶A为1 193.94U·g-1,脂肪酶B为1 599.84 U·g-1,脂肪酶C为1 178.12 U·g-1,脂肪酶D为1 509.01 U·g-1,脂肪酶B酶活浓度最高。
4种脂肪酶对天然油脂水解效果见表4。

表4 水解不同天然油脂脂肪酶相对酶活 %
由表4可知,脂肪酶A和B对猪油和棕榈油水解效果最差,脂肪酶C对各种天然油脂水解效果都较好,仅对猪油水解效果较差。除猪油外,脂肪酶D对鱼油、棕榈油、花生油水解效果最好。4种脂肪酶对各种天然油脂水解效果各有差异,pH为7.0,温度为40℃条件下,脂肪酶C、D优于脂肪酶A、B。
3 讨论
3.1 脂肪酶酶学特性
微生物脂肪酶属于中性或碱性脂肪酶[4]。但是也有一些酸性脂肪酶,例如Aspergillus niger NCIM 1207脂肪酶的最适pH是2.5[5]。来源于嗜热脂肪芽孢杆菌SB-1,萎缩芽孢杆菌SB-2和地衣芽孢杆菌SB-3的脂肪酶具有较广的pH范围(pH 3~12)[6]。也有研究表明微生物脂肪酶具有最适温度更低或者更高的范围[7-9]。
Gupta等把微生物脂肪酶分为非特异性、特异选择性和底物特异性基础上的脂肪酸特异性[1]。非特异性脂肪酶随机作用于甘油三酯分子,将其完全水解为脂肪酸和甘油。与此相反,特异性脂肪酶是1,3位特异性脂肪酶,只水解甘油三酯C1和C3酯键,从而产生游离脂肪酸、1,2-甘油二脂、2,3-甘油二酯或2-甘油单脂。第3类脂肪酶包含脂肪酸特异性脂肪酶,其表现为显著的脂肪酸优先水解性。不同菌种来源的脂肪酶水解特性不同,本试验选用4种不同的脂肪酶,分别由黑曲霉或假丝酵母发酵而来。黑曲霉源脂肪酶对1,3位脂肪酸具有特异水解性,假丝酵母源脂肪酶是一种非特异性脂肪酶,能够同时水解甘油三酯1,2,3位上的酯键,所以黑曲霉源脂肪酶水解产物更多是游离脂肪酸和2-甘油单酯,而假丝酵母源脂肪酶的水解产物则为更为广泛,包括游离脂肪酸、甘油二酯、甘油单酯和甘油[10]。
3.2 饲用脂肪酶的评价
饲料酶的选用和酶品质的评判涉及很多因素,远比普通的工业用酶复杂。一般的工业用酶反应场所比较固定,且可控性强,有比较稳定的pH、温度、底物和反应时间,而且酶成分也比较单一明确[11]。但是对于饲料酶,由于饲料原料、加工要求和动物消化道环境的多样性,需要考虑的因素众多且复杂,酶反应环境可控性低,因此酶的评判指标和选用标准目前在我国都很难建立。
对不同来源的酶制剂特性及最佳反应条件的认识是外源酶应用的前提条件,外源酶制剂的最佳作用条件应与动物体内消化道内环境一致,才具有重要的实际意义[12]。基于一定的动物品种和日粮类型,根据主要影响脂肪酶反应效果的指标,可以确立主要的饲料酶选用标准,例如酶活力、最适反应pH、最适反应温度、耐热性、耐酸性、抗蛋白酶性、作用底物等。
微生物源脂肪酶来源广泛,但是大部分是由应用于工业领域的脂肪酶转而应用于饲料添加剂领域,由于饲料行业或者动物消化的特殊性,对脂肪酶的选择具有一定的特异性要求。对单胃动物而言,其体温一般为37~40℃,消化道pH存在较宽的范围。根据肉鸡消化道环境和消化道食糜排空速度,本试验认为最适反应pH为5.0~7.0,反应温度约为40℃,耐酸性和抗蛋白酶特性较好的脂肪酶比较适合应用于肉鸡日粮[13-14]。
本试验选用的4种脂肪酶均属于弱碱性脂肪酶,最适pH为8~9,酸性条件下水解效果均不理想。脂肪酶A、B的最适反应温度为40℃,脂肪酶C、D最适反应温度为60℃,相比而言脂肪酶A和B更适合于消化道温度。4种脂肪酶对各种天然油脂水解效果各有差异,针对不同的油脂应选用不同的脂肪酶。
[1]Gupta R,Gupta N,Rathi P.Bacterial lipases:an overview of production,purification and biochemical properties[J].Applied Microbiology and Biotechnology,2004,64(6):763-781.
[2]Sharma R,ChistiY,Banerjee UC.Production,purification,characterization,and applications of lipases[J].Biotechnology Advances,2001,19(8):627-662.
[3]Hasan F,Shah A A,Hameed A.Industrialapplicationsofmicrobial lipases[J].Enzyme and Microbial Technology,2006,39(2):235-251.
[4]舒正玉.黑曲霉脂肪酶的酶学性质、基因克隆与表达及结构预测[D].武汉:华中科技大学,2007.
[5]Mahadik ND,Puntambekar U S,Bastawde K B,etal.Production of acidic lipase by Aspergillusniger in solid state fermentation[J].ProcessBiochemistry,2002,38(5):715-721.
[6]Bradoo S,Saxena R K,Gupta R.Two acidothermotolerant lipases from new variants of Bacillus spp[J].World Journal of Microbiol Biotechnol,1999(15):87-91.
[7]Luo Y,Zheng Y T,Jiang Z B,etal.A novel psychrophilic lipase from Pseudomonas fluorescenswith unique property in chiral resolution and biodiesel production via transesterification[J].Applied Microbiology and Biotechnology,2006,73(2):349-355.
[8]Lee DW,Koh Y S,Kim K J,etal.Isolation and characterization of a thermophilic lipase from Bacillus thermoleovorans ID-1[J].FemsMicrobiology Letters,1999,179:393-400.
[9]Sunna A,Hunter L,Hutton C A,et al.Biochemical characterization ofa recombinant thermoalkalophilic lipase and assessmentof its substrate enantioselectivity[J].Enzyme and Microbial Technology,2002,31(4):472-476.
[10]NamboodiriVM,Chattopadhyaya R.Purification and biochemical characterization ofa novel thermostable lipase from aspergillusniger[J].Lipids,2000,35(5):495-502.
[11]陆文清,李德发.评价饲料酶品质的5种指标[J].饲料研究,2005(3):10-13.
[12]冯定远,左建军.饲料酶制剂技术体系的研究与实践[M].北京:中国农业大学出版社,2011.
[13]张铁鹰.植酸酶体外消化评定技术的研究[D].北京:中国农业科学院,2002.
[14]樊红平,侯水生,刘建华,等.食糜在鸡、鸭消化道排空速度的比较研究[J].中国畜牧兽医,2007,34(4):7-10.
