非酒精性脂肪肝患者检测血清胸腺素β4水平的意义*
2013-05-04董秋艳王磊峰董玉萍
董秋艳 韩 涛 王磊峰 董玉萍 刘 莹 王 博
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是一种与胰岛素抵抗(IR)和遗传易感密切相关的代谢应激性肝脏损伤[1]。NAFLD在世界范围内平均患病率为20%~33%[2]。胸腺素β4(Thymosinβ4,Tβ4)是个高度保守的、由43个氨基酸残基组成的多肽,分子质量约为4 963 u。它参与人体内多种生物学过程,促进创伤愈合和上调炎性因子,在细胞分化和增殖方面起重要作用[3-4]。而NAFLD时血清Tβ4的水平如何尚少见报道。本研究旨在初步探讨血清Tβ4与NAFLD的关系,为临床诊治NAFLD提供新的实验基础和理论依据。
1 资料与方法
1.1 一般资料 选择2010年4月—2011年3月在天津市第三中心医院门诊治疗的NAFLD患者40例,其中男29例,女11例,年龄(43.14±15.19)岁,所有患者均符合中华医学会肝病学分会脂肪肝和酒精性肝病学组2010年制定的非酒精性脂肪性肝病诊疗指南[2]。其中26例参与多中心随机双盲实验研究的患者采用水飞蓟宾或多烯磷脂酰胆碱治疗,疗程均达到6个月,观察非酒精性脂肪性肝病临床疗效并行安全性评价。随机抽取同期健康体检肝脏超声正常者40例作为对照组,其中男33例,女7例,年龄(42.23±10.65)岁。2组性别(χ2=1.147)和年龄(t=1.196)比较差异无统计学意义(均P>0.05)。
1.2 血样采集 入选对象均于清晨采取空腹静脉血3 mL,注入不含抗凝剂带分离胶的生化管中,于2 h内以3 000 r/min离心15 min,分离血清,置于-80℃冰箱保存待测。
1.3 检测方法 ⑴血清Tβ4浓度的测定采用酶联免疫吸附测定试剂盒(K9520,Immunodiagnostik AG,Bensheim,Germa⁃ny)进行检测。⑵采用全自动生化分析仪对患者血清中三酰甘油(TG)、总胆固醇(CHO)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、丙氨酸转氨酶(ALT)、天冬氨酸转氨酶线粒体同工酶(ASTm)、γ-谷氨酰胺转肽酶(GGT)、总胆红素(TBIL)、碱性磷酸酶(ALP)、总蛋白(TP)、白蛋白(ALB)、空腹血糖(FPG)等指标进行检测。
1.4 统计学方法 数据采用SPSS 13.0统计软件进行统计学分析。符合正态分布以均数±标准差(x± s)表示,2组间的比较采用t检验,计数资料采用卡方(χ2)检验。诊断实验的灵敏度、特异度及AUC采用ROC曲线,以P<0.05为差异有统计学意义。
2 结果
2.1 2组生化指标的比较 NAFLD组患者血清中TG、ALT、ASTm、GGT、TBIL、ALP、ALB、FPG与对照组相比差异有统计学意义(P<0.05或P<0.01),其他生化指标2组间的差异无统计学意义(均P>0.05),见表1。
2.2 2组血清Tβ4水平的比较 NAFLD组血清Tβ4为(2.635 4±2.633 1)mg/L,对照组为(9.282 7±4.663 5)mg/L,差异有统计学意义(t=7.241,P<0.01)。
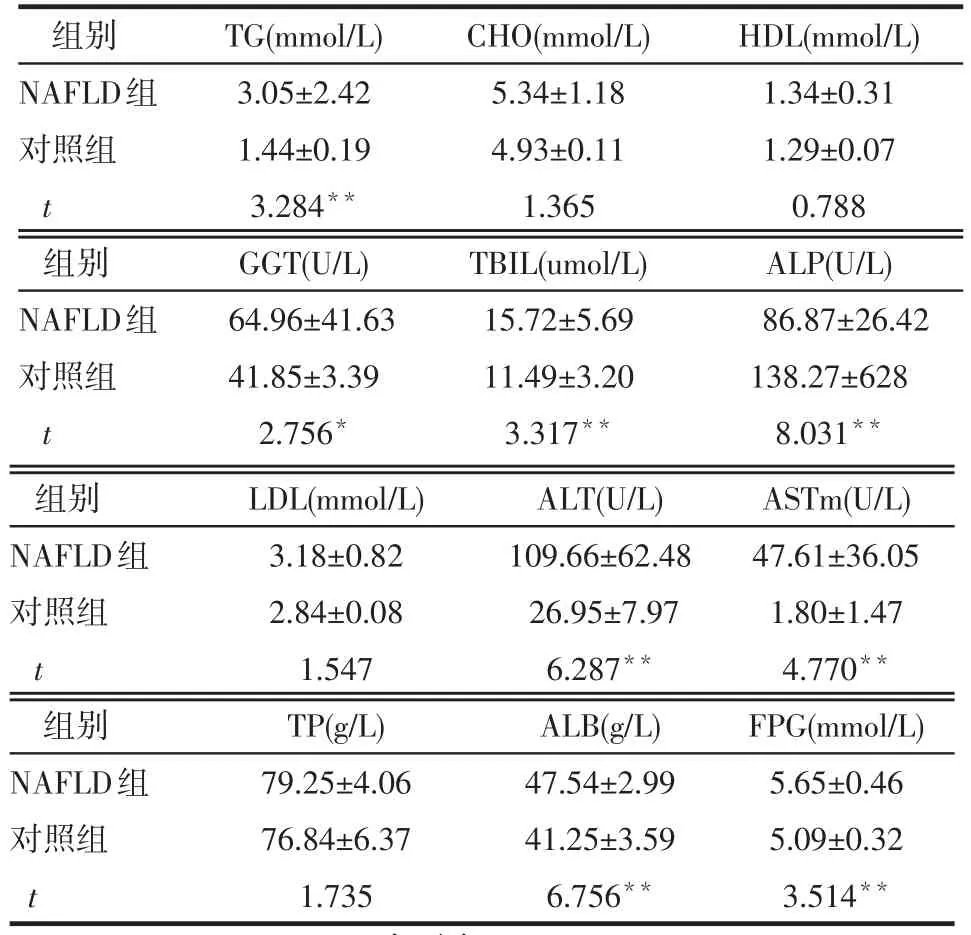
Table 1 Comparison of biochemical parameters between two groups表1 2组生化指标的比较(n=40,x±s)
2.3 治疗前后各项生化指标的比较 NAFLD组患者治疗后血清中 TG、ALT、ASTm、GGT、TBIL、ALP、ALB、FPG与治疗前相比差异有统计学意义(P<0.05或P<0.01),其他生化指标2组间的差异无统计学意义(均P>0.05),见表2。
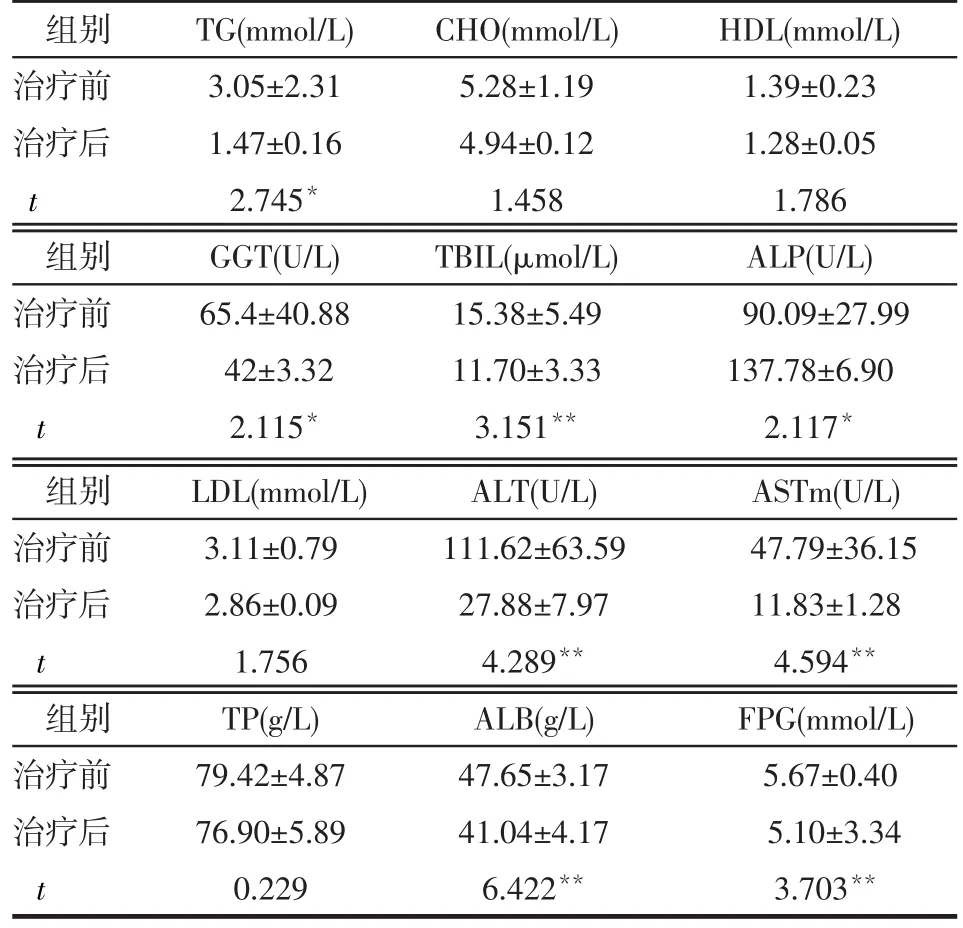
Table 2 Comparison of biochemical parameters before and after treatment in 26 patients with NAFLD表2 26例NAFLD患者治疗前后生化指标的比较(n=26,±s)x
2.4 治疗前后血清Tβ4水平的比较 26例NAFD患者血清Tβ4的水平治疗后(3.7434±1.8871)mg/L,高于治疗前的(2.085 4±1.150 5)mg/L,差异有统计学意义(t=4.486,P<0.01)。
2.5 血清ALT、Tβ4水平的ROC曲线图 以B超作为NAFLD诊断的金标准,分别做出血清ALT、Tβ4水平的ROC曲线图。在血清ALT水平的曲线上取灵敏度+特异度之和最大值点(40.10 U/L)作为预测NAFLD的cut-off值,AUC为0.717(95%CI为0.596~0.838),灵敏度为57.5%,特异度76.7%;以灵敏度+特异度之和最大值点的血清Tβ4值(4.830 5 mg/L)作为预测NAFLD的cut-off值,AUC为0.906(95%CI为0.842~0.969),灵敏度为85%,特异度80%;血清Tβ4的AUC明显大于ALT,血清Tβ4的灵敏度、特异度均显著高于ALT,见图1。
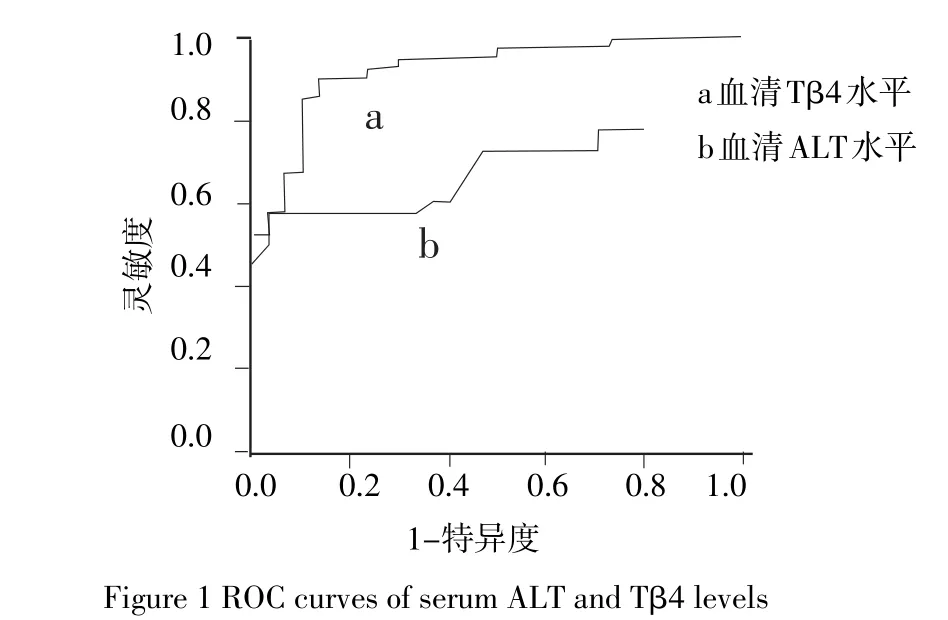
图1 血清ALT、Tβ4水平的ROC曲线图
2.6 NAFLD组患者血清Tβ4水平与肝功能指标的相关性 NAFLD组患者血清Tβ4水平与其血清ALT含量呈负相关(r=-0.330,P<0.05)。
3 讨论
NAFLD是导致肝功能异常的主要原因[5]。疾病谱包括非酒精性单纯性脂肪肝(NAFL),非酒精性单纯性脂肪性肝炎(NASH)及其相关肝硬化、肝细胞癌[5-6]和亚急性肝功能衰竭[7]。Day等[8]提出NAFLD存在二次打击的发病机制,“第一次打击”是脂肪积聚和脂肪变性;而氧化应激和脂质过氧化、炎症性细胞因子的释放、线粒体功能异常等因素形成“二次打击”,诱导了肝脏炎症反应、肝脂肪变性、肝细胞损伤、炎症和纤维化。其发病机制至今尚未完全明确,越来越多的证据表明脂肪酸代谢紊乱是NAFLD发生的基础[9],而内质网应激-线粒体功能障碍在NAFLD“二次打击”的病理生理中起着关键性作用。
本研究发现,与对照组相比,NAFLD患者血清Tβ4的水平明显降低,说明尽管NAFLD患者的ALT、AST升高的水平并不明显,但其肝脏功能的损伤程度是十分严重的。在临床上,当NAFLD患者的肝脏作为供肝来源进行肝移植时,虽然肝功能的各项指标在正常范围内,但最终会导致移植肝受体失功。因此,NAFLD患者血清Tβ4的水平可能会更好地反映肝脏的功能。本研究中血清ALT、Tβ4水平的ROC曲线图显示:血清Tβ4水平的灵敏度与特异度明显高于血清ALT水平。NAFLD患者出现肝功能不良的原因是和其发病机制密切相关的:当发生NAFLD,出现脂肪酸过载且线粒体脂肪酸氧化障碍时,未被氧化的脂肪酸不断酯化生成三酰甘油,沉积于肝细胞内,导致肝细胞脂肪变性。肝脏脂肪的异常积聚和脂肪变性,会导致内质网和线粒体功能的异常,进一步加重氧化应激和脂质过氧化,引起恶性循环,使NAFLD患者的肝细胞功能严重受损。
有研究表明,Tβ4能降低氧自由基水平,减缓脂质过氧化,抑制炎性细胞因子的生成[10],并促进细胞再生[4],与创伤愈合[3]、细胞凋亡[4]、炎症反应[11]、血管生成[12]等均有密切关系。本研究对接受水飞蓟宾或多烯磷脂酰胆碱治疗的26例NAFLD患者血清Tβ4水平进行比较发现:治疗后随着临床症状的缓解和各项实验室指标的改善,血清Tβ4水平明显升高。考虑其原因可能是在NAFLD疾病的进程中,持续的氧化应激导致了肝细胞的损伤,使血清Tβ4水平降低。水飞蓟宾或多烯磷脂酰胆碱具有稳定细胞膜、保护肝细胞酶系统、清除肝细胞内的活性氧自由基的作用;同时还可改善肝细胞脂肪变性,阻止或减轻在肝脏内的沉积和浸润,并具有抗炎免疫调节及降血脂的作用,使NAFLD患者症状、肝功能及肝组织学明显改善,从而降低NAFLD患者ALT水平,最终致使血清Tβ4的水平升高。此外,本研究还发现,26例NAFLD患者接受水飞蓟宾或多烯磷脂酰胆碱治疗后的血清ALB比治疗前降低,推测其原因可能是NAFLD患者在治疗过程中,经过控制饮食、有效锻炼,以及考虑到血清白蛋白半衰期相对较长等原因,最终使患者治疗后的血清ALB下降。
本研究通过ELISA法检测了NAFLD患者血清Tβ4的水平,发现NAFLD患者血清Tβ4浓度低于健康人,且经过有效治疗后明显升高,血清Tβ4的水平比ALT更灵敏地反映NAFLD患者的肝脏功能。其具体作用机制尚需进一步探讨,同时需要增加治疗随访例数,延长观察时间及结合组织学资料进一步评价其价值。
[1]Fan JG,Farrell GC.Epidemiology of non-alcoholic fatty liver dis⁃ease in China[J].J Hepatol,2009,50(1):204-210.
[2]中华医学会肝脏病学分会脂肪肝和酒精肝病组.非酒精性肝病诊疗指南[J].中华肝脏病杂志,2010,18(3):163-166.
[3]Philp D,Badamchian M,Scheremeta B,et al.Thymosin beta 4 and a synthetic peptide containing its actin-binding domain promote dermal wound repaire in db/db diabetic mice and in aged mice[J].Wound Repair Regen,2003,11(1):19-24.
[4]Bock-Marqutte I,Saxena A,White MD,et al.Thy mosin beta 4 acti⁃vates integrin-linked kinase and promotes cardiac cell migration,survival and cardiac repair[J].Nature,2004,432(7016):466-472.
[5]Farrell GC,Larter CZ.Nonalcoholic fatty liver disease:from steato⁃sis to cirrhosis[J].Hepatology,2006,43(2 Suppl 1):S99-S112.
[6]de Alwis NM,Day CP.Non-alcoholic fatty liver disease:the mist gradually clears[J].J Hepatol,2008,48(Suppl 1):S104-S112.
[7]Patrick-Melin AJ,Kalinski MI,Kelly KR,et al.Nonalcoholic fatty liver disease:biochemical and therapeutic considerations[J].Ukr Biokhim Zh,2009,81(5):16-25.
[8]Day CP,James OF.Steatohepatitis:a tale of two“ hits”[J]?Gastro enterology,1998,114(4):842-845.
[9]Geoffrey GC,Larter CZ.No nalcoholic fatty liver disease from steato⁃sis to cirrhosis[J].Hepatology,2006,43(2):S99-S112.
[10]Badamchian M,Damavandy AA,Damavandy H,et al.Identification and quantification of thymosin beta 4 in human saliva and tears[J].Ann NY Acad Sci,2007,1112:458-465.
[11]Sosne G,Qiu P,Christopherson PL,et al.Thymosin beta 4 suppres⁃sion of corneal NFkappaB:a potential anti-inflammatory pathway[J].Exp Eye Res,2007,84(4):663-669.
[12]Cha HJ,Jeong MJ,Kleinman HK.Role of thymosin beta4 in tu mor metastasis and angiogenesis[J].J Natl Cancer Inst,2003,95(22):1674-1680.
