HLA—DQA1基因拷贝数目多态性与中国汉族人群类风湿关节炎易感性的研究
2013-04-29陈洁君吉恒东郭士成等
陈洁君 吉恒东 郭士成等
【摘 要】目的:探讨中国汉族人群中HLA-DQAl基因拷贝数目多态性与类风湿关节炎发病风险的关系。方法:采用比较基因组杂交和AccuCopy检测技术,检测138例类风湿关节炎患者和191例正常对照者的HLA-DQAl基因拷贝数目。采用Logistic回归模型分析各基因型患者类风湿关节炎的发病风险。结果:HLA-DQAl基因拷贝数目增加的个体,类风湿关节炎发病风险显著升高(p = 0.009)。结论:HLA-DQAl基因拷贝数目多态是RA的遗传易感因素,HLA-DQAl基因拷贝数目增加则是类风湿关节炎的危险因素。
【关键词】 关节炎,类风湿;HLA-DQAl;拷贝数目多态性;易感性;中国汉族人
类风湿关节炎(rheumatoid arthritis,RA)是一种以关节滑膜慢性炎症为主的自身免疫性疾病,其病因及发病机制尚未完全明确,遗传和环境都有可能导致此疾病的发生与发展。RA作为一种具有遗传倾向的多基因疾病,不同种族、不同地区乃至不同个体之间遗传特征均有不同程度的变异。
拷贝数目变异(copy number variation ,CNV)是近年来新发现的一类基因组结构变异,包括基因组节段的缺失、重复及复杂重排等,是疾病发生的重要遗传学基础。CNV的基因组节段占整个人类基因组的12%,覆盖人类基因组中13%的基因及5%以上的编码序列[1]。拷贝数目多态性(copy number polymorphisms,CNP)是CNV的一种,是在人群中分布频率 > 1%的CNV。到目前为止,CNV/CNP在RA发病中的机制虽不太明确,但已有少量报道。如趋化性细胞因子配体蛋白CCL3L1 (chemokine ligand 3-like-1,CCL3L1)[2-3]、Fcγ受体3B(Fc gamma receptor 3B,FCGR3B)[4-5]和
B淋巴细胞前体1(pre-B lymphocyte1,VPREB1)[6]、
晚期角质化包膜蛋白基因LCE (late cornified envelope,LCE)[7-10]和RA的易感性有关。
人类白细胞抗原(human leukocyte antigen,HLA)
是机体免疫系统的重要组成部分,参与抗原处理和免疫调节等过程。有研究表明,HLA基因拷贝数目多态性与RA发病有关[11]。HLA-DQA1基因是HLA抗原系统的成员,存在拷贝数目多态性[12],但未见HLA-DQA1基因拷贝数目变异与RA的相关报道。本研究采用病例对照研究,探讨HLA-DQA1基因拷贝数目变异与RA易感性的关系。
1 临床资料
1.1 一般资料 选取2008年至2010年在江苏省泰州市人民医院住院及门诊确诊的RA汉族患者138例,定为病例组。男30例,女108例;年龄18~75岁,平均(53.36±13.74)岁;病程最短5个月,最长15年,中位数3.23年。选取江苏省泰州市健康者191例,均为汉族,定为对照组。男111例,女 80例;年龄18~60岁,平均(46.99±5.21)岁。本研究经复旦大学伦理委员会批准,流行病调查资料收集及血液样本采集均经研究对象知情同意,遵守伦理学的各项规定。
1.2 纳入标准 ①病例组诊断均符合1987年美国风湿病学会(ACR)关于类风湿关节炎的诊断标准;②年龄18~75岁;③愿意并签署知情同意书。
1.3 排除标准 ①患胃及十二指肠溃疡或慢性胃炎者;②合并心、肝、肾和造血系统严重疾病者。
2 方 法
2.1 微阵列比较基因组杂交(aCGH)定位 CNVs
区域外周血基因组DNA抽提采用DNA抽提纯化试剂盒(Qiagen公司生产)。全基因组DNA水平上的CNVs检测采用Agilent 1M (Agilent公司生产)aCGH芯片技术平台,该平台包含约100万个寡核苷酸探针,DNA编码区和非编码区分辨率均高达3 Kb。染色体片段和基因定位依据UCSC公共数据库[UCSC Genome Browser on Human Feb. 2009 (GRCh37/hg19)Assembly]。分别采用Agilent G444GA和Feature
Extraction9.5(Agilent公司)进行微阵列扫描和数据提取。
2.2 单点CNV的检测与验证 通过aCGH定位的CNV区域,使用AccuCopy检测技术[13](一种多重竞争性PCR技术,上海天昊生物技术有限公司)在病例组和对照组样本中进行检测。取一定量的竞争DNA(I)片段混合物——每个片段与各自对应的基因片段仅有微小差别(通常为2~5个
碱基长度差异),与合适量的样本DNA(S)混合,作为随后多重荧光竞争性PCR扩增的模板;多重PCR产物经毛细管电泳后对不同基因位点扩增产物以及同一位点的不同模板(样本DNA与竞争DNA)扩增产物根据其长度差异进行分离;分析每个基因片段的S/I值,利用参照基因S/I值对目标基因S/I值进行校正后获取目标基因的准确拷贝数目。取拷贝数目为2、大于2,及小于2的样本各3个,对上述PCR产物进行测序,以避免引物序列多态性引起的拷贝数目检测的偏移。
2.3 统计学方法 所有数据均采用SPSS17.0软件进行统计分析,采用拟合优度检验检测每个位点基因型频率的分布是否符合Hardy-Weinberg遗传平衡。采用Logistic 回归对年龄、性别进行校正后分析HLA-DQA1与RA易感性的相关性关系,并以比值比(Odds Ratio, OR)及其95%可信区间(CI)表示相对风险度。拷贝数目缺失和增加的阈值分别为低于0.8和高于1.2,所用样本检验2次。检验水准 α= 0.05。
3 结 果
3.1 Hardy-Weinberg遗传平衡检验 HLA-DQA1
CNV在对照组进行χ2检验,结果为χ2= 161.1,P = 0.93,说明对照组符合Hardy-Weinberg平衡。
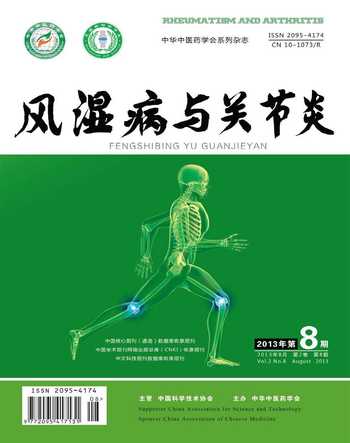
3.2 比较基因组杂交(aCGH)定位HLA-DQA1的CNV区域 通过微阵列aCGH方法,进行了10例健康对照组样本的检测。连续5个探针的一致性信号(重复或缺失)可代表一个CNV,中国汉族人群中存在HLA-DQA1的拷贝数目变异,位于6号染色体(6p21.3)32608277-32620568 Kb之间,见图1(每个点代表1个探针。绿点表示拷贝数目缺失)。
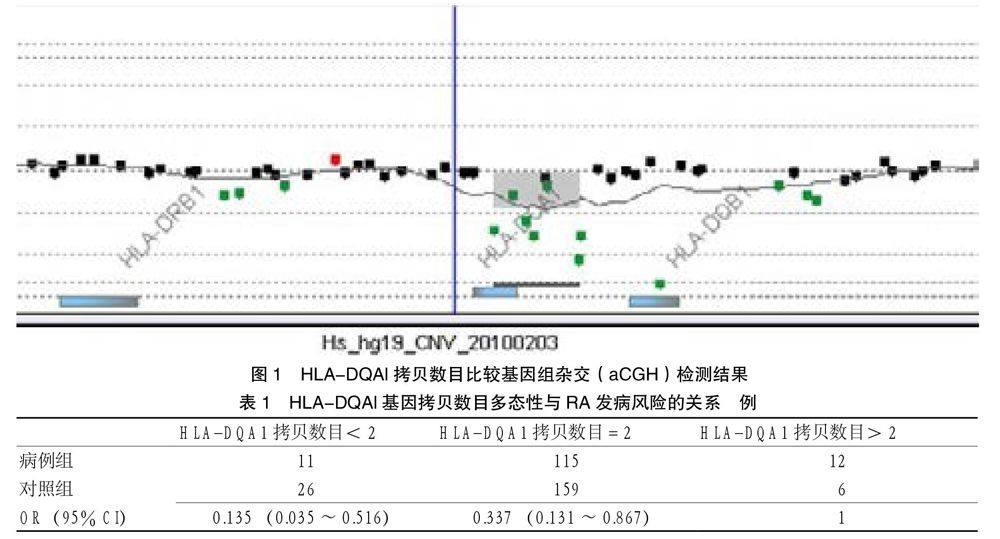
3.3 HLA-DQA1基因拷贝数目与RA易感性的相关性 针对上述CNV涉及探针,利用AccuCopy检测技术对138例病例组患者及191例对照组健康对照者进行了拷贝数目检测,发现存在拷贝数目为2、大于2及小于2三种情况。对挑选的3种拷贝数目个体进行Sanger测序后,其拷贝数目与AccuCopy的结果一致。 运用Logistic回归校正性别与年龄,发现HLA-DQA1基因拷贝数目与RA具有强相关性 (p = 0.009),见表1。
HLA-DQA1基因拷贝数目减少和正常拷贝数目都可以降低RA的发病风险,而HLA-DQA1基因拷贝数目增加则是RA的危险因素。
4 讨 论
HLA抗原是机体免疫系统的重要组成部分,参与抗原处理、免疫调节等多种过程。HLA-Ⅱ类分子是由α链和β链组成的异二聚体糖蛋白分子,DQ 抗原的α链和β链分别由6号染色体的 DQA1 和 DQB1 基因编码。DQA1 和 DQB1 等位基因均具有高度的多态性,不同的等位基因产物具有不同的氨基酸组成和空间构象,某些 HLA-DQB1、HLA-DQA1 等位基因编码的产物可能有助于选择性地提呈与疾病相关的自身抗原肽,从而导致疾病的发生。很多学者认为,某些 HLA 等位基因通过影响患者自身抗体的产生在自身免疫性疾病的发生和预后中起重要作用[14-15]。
研究表明,HLA-DQA1基因多态性与多种疾病的发病风险相关。英国Leish GEN等[16]团队发现,HLA-DRB1-HLA-DQA1与印度和巴西的内脏利什曼病易感性相关;马来西亚的研究者发现, HLA-DRB1/HLA-DQA1 rs9271366 中的等位基因G 和纯合子GG 显著增加马来西亚人系统性红斑狼疮(systemic lupus erythematosus,SLE)的易感性(OR > 1, p < 0.05),而HLA-DQB1/HLA-DQA2 rs9275328中的 T等位基因和基因型 CT 则对马来西亚人和中国人患SLE起保护作用[17];Murray JA等[18]研究发现,97%的乳糜泻患者携带DQA1*05 和DQB1* 02基因;梁敏等[19]发现,广西汉族2型糖尿病及其并发症与HLA有关联,HLA-DQA1*0401可能为2型糖尿病的保护基因,HLA-DQA1*0104可能为2型糖尿病的易感基因,HLA-DQA1*0501对2型糖尿病合并肾病、高血压具有保护作用;张雄鹰等[20]发现,HLA-DQA1*0501 和 HLA-DQB1*0201等位基因可能是山西汉族干燥综合征的易感基因,而 HLA-DQA1*0301/2 等位基因可能是其保护基因。
拷贝数目的变化可影响基因的剂量,因此,HLA-DQA1 基因的拷贝数目多态性也可能导致HLA-DQA1抗原表达改变,进而影响疾病的发生发展。黄理明等[12]在研究中国人群中HLA-DQA1基因拷贝数目多态性与胃癌发病风险的关系时发现,携带HLA-DQA1 基因2拷贝基因型的患者,胃癌发病风险显著升高(OR=1.87,95%CI为1.15~3.06,P = 0.01)。我们的研究结果表明,HLA-DQA1基因拷贝数目与RA具有强相关性
(p = 0.009),HLA-DQA1基因拷贝数目减少和正常拷贝数目都可以降低RA的发病机率,而HLA-DQA1基因拷贝数目增加则是RA发病的危险因素。
HLA-DQA1基因拷贝数目多态性是RA的遗传易感因素,其具体的关联格局尚有待进一步进行功能研究来确定。
5 参考文献
[1] Craddock N, Hurles ME, Cardin N, et al. Genome-wide association study of CNVs in 16,000 cases of eight common diseases and 3,000 shared controls[J].Nature,2010,464(7289):713-720.
[2] Townson JR, Barcellos LF, Nibbs RJ. Gene copy number regulates the production of the human chemokine CCL3-L1[J]. Eur J Immunol,2002,32(10):3016-3026.
[3] Carpenter D, Walker S, Prescott N, et al. Accuracy and differential bias in copy number measurement of CCL3L1 in association studies with three auto-immune disorders[J].BMC Genomics,2011,12(10):418-426.
[4] McKinney C,Merriman TR. Meta-analysis confirms a role for deletion in FCGR3B in autoimmune phenotypes[J]. Hum Mol Genet,2012,21(10):2370-2376.
[5] McKinney C,Fanciulli M,Merriman ME,et al.Association of variation in Fcgamma receptor 3B gene copy number with rheumatoid arthritis in Caucasian samples[J].Ann Rheum Dis,2010,69(9):1711-1716.
[6] Yim SH, Chung YJ, Jin EH, et al. The potential role of VPREB1 gene copy number variation in susceptibility to rheumatoid arthritis[J].Mol Immunol,2011,48(11):1338-1343.
[7] Zhang XJ, Huang W, Yang S, et al. Psoriasis genome-wide association study identifies susceptibility variants within LCE gene cluster at 1q21[J].Nat Genet,2009,41(2):205-210.
[8] Huffmeier U, Bergboer JG, Becker T, et al.Replication of LCE3C-LCE3B CNV as a risk factor for psoriasis and analysis of interaction with other genetic risk factors[J].J Invest Dermatol,2010,130(4):979-984.
[9] Lu XL, Guo JP, Zhou XJ,et al.Deletion of LCE3C_LCE3B is associated with rheumatoid arthritis and systemic lupus erythematosus in the Chinese Han population[J]. Ann Rheum Dis,2011,70(9):1648-1651.
[10] Docampo E, Rabionet R, Riveira-Munoz E, et al.Deletion of the late cornified envelope genes, LCE3C and LCE3B, is associated with rheumatoid arthritis[J].Arthritis Rheum,2010,62(5):1246-1251.
[11] Jiang DK, Sun JL, Cao GW, et al. Genetic variants in STAT4 and HLA-DQ genes confer risk of hepatitis B virus-related hepatocellular carcinoma[J].Nat Genet,2013,45(1):72-75.
[12] 黄理明,程炎,于典科,等.HLA-DQAl基因拷贝数目多态与胃癌发病风险的关系[J].中华肿瘤杂志,2012,34(4):269-271.
[13] Du RQ, Lu CC, Jiang ZW, et al. Efficient typing of copy number variations in a segmental duplication-mediated rearrangement hotspot using multiplex competitive amplification[J].J Hum Genet,2012,57(8):545-551.
[14] Mikuls TR, Thiele GM, Deane KD,et al. Porphyromonas gingivalis and disease-related autoantibodies in individuals at increased risk of rheumatoid arthritis[J]. Arthritis Rheum, 2012,64(11):3522-3530.
[15] Duquesnoy RJ.The antibody response to an HLA mismatch: a model for nonself-self discrimination in relation to HLA epitope immunogenicity[J]. Int J Immunogenet, 2012,39(1):1 - 9.
[16] Fakiola M ,Strange A,Cordell HJ,et al. Common variants in the HLA-DRB1-HLA-DQA1 HLA class II region are associated with susceptibility to visceral leishmaniasis[J].Nat Genet,2013,45(2):208-213.
[17] Chai HC, Phipps ME, Othman I,et al.HLA variants rs9271366 and rs9275328 are associated with systemic lupus erythematosus susceptibility in Malays and Chinese[J].Lupus,2013,22(2):198-204.
[18] Murray JA,Moore SB,Van Dyke CT,et al.HLA DQ gene dosage and risk and severity of celiac disease[J].Clin Gastroenterol Hepatol,2007,5(12):1406-1412.
[19] 梁敏,罗佐杰,冼苏,等.HLA-DQA1基因与广西地区2型糖尿病关联性的研究[J].广西医科大学学报,2000,17(6):972-974.
[20] 张雄鹰,宋秀珍,秦雄伟,等.山西汉族原发性干燥综合征与 HLA-DQ基因多态性相关性的研究[J].细胞与分子免疫学杂志,2011,27(2):182-185.