维持性血液透析患者他汀类调脂治疗
2013-04-26张志宏,谢红浪
慢性肾脏病(CKD)是心血管疾病(CVD)的独立危险因素[1,2]。因终末期肾病(ESRD)行维持性血液透析(MHD)患者半数死于CVD[3],其中<45岁的MHD患者CVD死亡风险是同龄人群的100倍[4]。脂代谢异常是动脉粥样硬化性病变形成的必要因素,也是诱发CVD,尤其是发生冠心病的重要危险因素。CKD患者早期即可出现脂代谢异常,而MHD患者的脂代谢问题更为普遍和突出[5]。近年来,已有大量研究证实羟甲基戊二酸单酰辅酶A还原酶抑制剂(简称为他汀)为代表的调脂治疗药物能改善心脑血管事件发生率及相关死亡率[6-8],他汀类药物应用于冠心病、脑卒中、糖尿病、代谢综合征等心脑血管事件高危患者亦为临床所公认。遗憾的是他汀类药物应用于CKD,特别是MHD患者的疗效及安全性仍缺乏系统评价,新近公布的几项前瞻性、随机、对照、多中心临床研究结果未能与理论预期相符,更是将该问题的争议推向了新的高度。本文对他汀类药物应用于MHD患者的研究进展作一综述。
MHD患者脂代谢特点
血脂是血浆中的中性脂肪[胆固醇和三酰甘油(TG)]和类脂(磷脂、糖脂、固醇、类固醇)的总称。胆固醇和TG是血脂的主要组分,参与机体重要的生理或病理生理过程,通常意义上的脂代谢即是指胆固醇和TG的代谢。脂质难溶于水,在血浆中必须与载脂蛋白(Apo)结合以脂蛋白的形式存在。应用超速离心方法,可将脂蛋白分为:乳糜微粒(CM)、极低密度脂蛋白(VLDL)、低密度脂蛋白(LDL)和高密度脂蛋白(HDL)。近年来,提出了非高密度脂蛋白(non-HDL)的概念,是指VLDL、LDL和中间密度脂蛋白(IDL)的总和。研究显示non-HDL血液浓度不受进餐与否的影响,预测冠心病风险的价值优于LDL。各类血浆脂蛋白的分类、性质、组分及主要功能见表1[9]。
随着肾功能减退,CKD患者常伴严重的脂代谢异常,而MHD患者的脂代谢紊乱愈加突出,称为“尿毒症血脂异常”[10]。研究发现,MHD患者不仅存在血脂“数量”异常[11,12],主要表现为TG、VLDL水平升高和HDL水平降低,TC和LDL水平正常或降低;还有血脂“质量”异常,表现为LDL颗粒趋于致密,HDL成分中ApoCⅡ、ApoCⅢ均显著增加,而转铁蛋白则明显减低[13-15]。
MHD患者脂代谢紊乱主要与尿毒症微炎症状态导致脂代谢相关酶的水平和活性异常有关[16];此外,继发性甲状旁腺功能亢进[17]、肝脏合成增加[18]、长期应用肝素或低分子肝素[19,20]、透析器膜材料[21,22]、透析液种类及其净化程度[23,24]、透析龄[25]等对脂代谢均有不同程度的影响,加重脂代谢的异常。
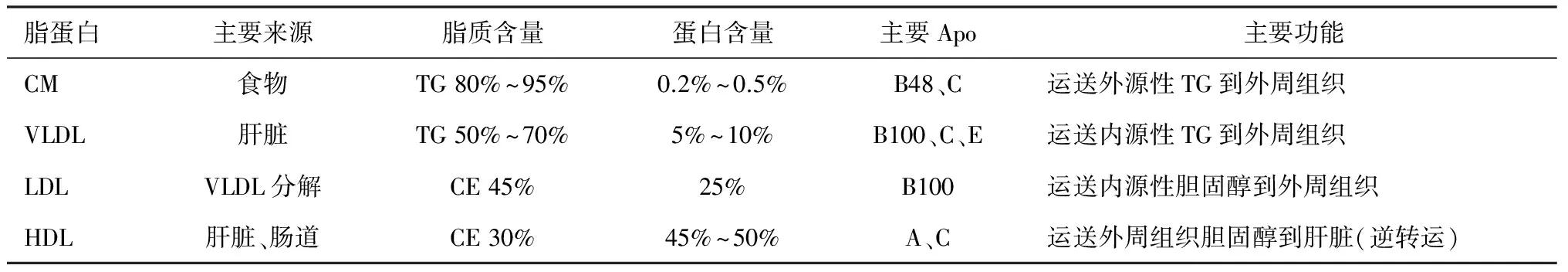
表1 各类血浆脂蛋白的分类、性质、组分及主要功能[12]
MHD患者他汀类药物临床研究
他汀类药物降脂治疗的临床研究包括普伐他汀汇集项目(PPP)、辛伐他汀生存研究(4S)、评价瑞舒伐他汀的干预试验(JUPITER)等,均纳入了部分肾功能轻中度减退的CKD患者,这些研究不仅证实LDL水平降低1mmol/L心脑血管事件风险降低20%,从而奠定了他汀类药物降脂治疗的临床地位,并且明确指出对于早中期CKD患者应用他汀类药物同样可显著改善心脑血管事件预后(表2)[26-28]。现行公布的指南有关CKD患者降脂治疗的建议见表3[29-32]。2013年1月改善全球肾脏病预后组织(KDIGO)公布了《KDIGO慢性肾脏病临床实践指南》[33],更新了CKD概念、诊断、预防和治疗等方面内容,旨在提高医务工作者对CKD的诊疗水平,对临床工作具有积极的指导意义。KDIGO指南对现阶段有关CKD患者降脂治疗的研究给予了积极评价,并于2013年正式发布《KDIGO慢性肾脏病血脂管理临床实践指南》。有关该指南草案的一项关键建议是提出对年龄>50岁伴血管粥样硬化的CKD患者无论其LDL水平如何,均应接受降脂治疗。
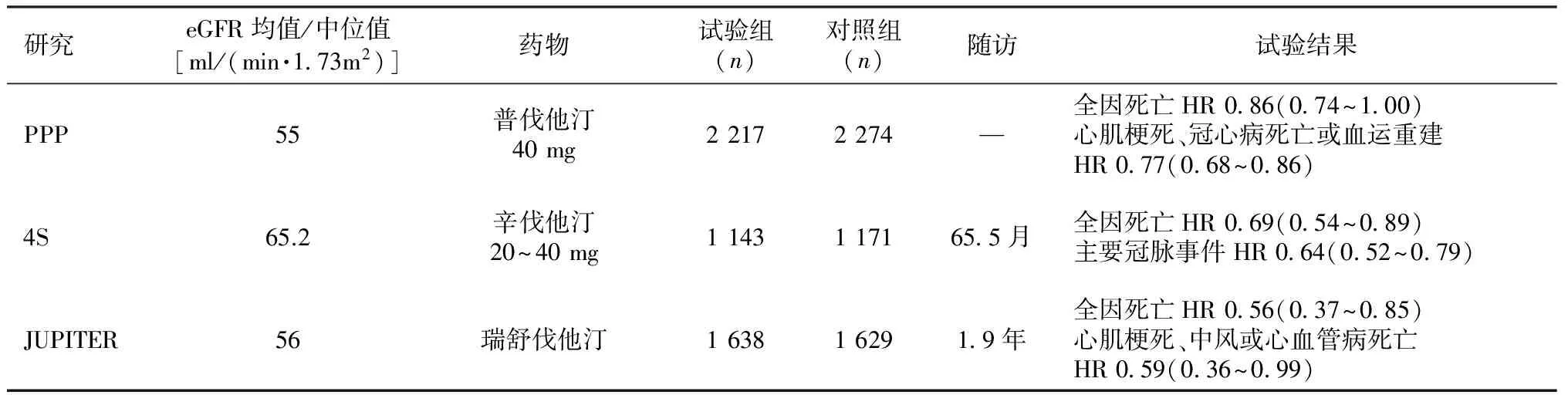
表2 CKD患者应用他汀类药物的临床试验[26-28]
尽管MHD患者脂代谢异常更显著、发生CVD事件的风险更高,但目前他汀类药物临床应用的研究仍非常有限。早期的一些回顾性研究提示他汀类药物可降低MHD患者的CVD死亡风险率达36%[34,35],但近期相继公布的3项大型前瞻性、随机、对照、多中心研究并未取得令人鼓舞的结论。
“4D”研究(Die Deutsche Diabetes Dialyse Study)[36]是一项面向糖尿病MHD患者的阿托伐他汀应用研究,从1998年至2004年随访结束共纳入1 255例2型糖尿病MHD患者,年龄18~80岁,透析龄均<2年,排除充血性心力衰竭、顽固性高血压或3月内合并心肌梗死等患者。患者随机进入阿托伐他汀组(20 mg/d)和安慰剂组,中位随访年限约4年,主要研究终点包括各种心血管病死亡、致死性中风以及非致死性心肌梗死或中风;次要终点为全因死亡、所有心脑血管事件的总和。结果显示(1)血脂变化:治疗4周后阿托伐他汀组LDL浓度中位值由3.13 mmol/L降至1.86 mmol/L,降幅达42%;安慰剂组LDL浓度中位值由3.23 mmol/L降至3.10 mmol/L,降幅仅为1.3%;随访期末两组间LDL水平差异有减少趋势,但仍非常显著。(2)临床获益:阿托伐他汀组随访第1年和第3年末主要终点事件的发生率分别为12.6%和31.9%,安慰剂组分别为11.2%和30.5%,阿托伐他汀治疗较安慰剂主要终点事件的相对风险(RR)下降仅8%;其中心血管病死亡、非致死性心肌梗死或中风的发生率均无差异,而致死性中风的发生率阿托伐他汀组略高于安慰剂组。次要研究终点比较,两组全因死亡率和脑血管事件发生率均无差异;心血管事件发生率阿托伐他汀组略低于安慰剂组,主要是需要冠脉旁路移植或经皮冠脉重建的获益。(3)安全性评价:两组均未出现横纹肌溶解症或严重肝功能受损,药物相关严重不良反应导致停药两组各有1例。总之,“4D”研究结果提示阿托伐他汀治疗可有效降低糖尿病MHD患者的LDL水平,但不能降低心血管病死亡、非致死性心肌梗死或中风等心脑血管事件的总体发生率,患者的临床获益有限。
“AURORA”研究(A study to evaluate the Use of Rosuvastatin in subjects On Regular hemodialysis:an Assessment of survival and cardiovascular events) 与“4D”研究对象限于伴糖尿病的MHD患者不同,2009年结束的“AURORA”研究主要纳入非糖尿病的MHD患者,病例数更多,以评估瑞舒伐他汀对MHD患者心脑血管事件的影响[37]。该研究共纳入2 773例MHD患者,年龄50~80岁,中位透析龄3.5年,排除6月内应用过他汀类药物、严重血液系统或胃肠道疾病、恶性肿瘤、重度感染、代谢性疾病(糖尿病除外)者。患者随机入组瑞舒伐他汀组(10 mg/d)和安慰剂组,平均随访3.2年。主要研究终点包括各种心脑血管病死亡及非致死性心肌梗死或中风的发生率,次要终点为全因死亡率及各种心脑血管事件或血管重建。结果显示(1)血脂变化:治疗3月后瑞舒伐他汀组LDL浓度中位值由2.5 mmol/L降至1.4 mmol/L,降幅达42.9%;安慰剂组LDL浓度中位值由2.4 mmol/L降至2.3 mmol/L,降幅仅为1.9%。与“4D”研究结果类似,随访期末两组间LDL水平差异有所减少,但仍非常显著。(2)临床获益:瑞舒伐他汀组与安慰剂组主要终点事件的发生率分别为9.2和9.5(单位:次/100患者·年,下同),风险比(HR)为0.96;其中心血管病死亡、非致死性心肌梗死或中风的发生率均无差异,甚至以性别、年龄、吸烟状况、合并糖尿病、血压水平、LDL水平、高敏C反应蛋白(hs-CRP)水平等因素进一步分组,各亚组间主要终点事件的发生率也均无差异。次要研究终点中两组全因死亡发生率分别为13.5和14.0,HR为0.96,亦无差异。(3)安全性评价:与“4D”研究结果类似,两组间不良事件的发生率无差异,其中药物相关严重不良反应发生率分别为1.2%和0.8%。总之,“AURORA”研究表明,瑞舒伐他汀不能降低非糖尿病MHD患者的心脑血管病死亡、非致死性心肌梗死或中风等事件的发生率。
“SHARP”研究(Study of Heart and Renal Protection) 2011年公布的“SHARP”研究是迄今为止包含MHD患者在内的最大规模、前瞻性、随机、对照临床试验[38,39],纳入标准为血清肌酐≥150.2 μmol/L(男)或132.6 μmol/L(女)且年龄≥40岁的CKD患者,包括MHD或PD患者,排除心肌梗死或冠脉血运重建病史患者。“SHARP”研究共纳入9 270例不同阶段的CKD患者,其中2 527例为MHD患者,占总病例数的27%。患者随机进入联合治疗组(辛伐他汀20 mg/d+依折麦布10 mg/d)和安慰剂组,中位随访4.9年。主要研究终点包括冠心病死亡、非致死性心肌梗死、非出血性中风及所有动脉血管血运重建。结果显示(1)血脂变化:治疗前联合治疗组LDL中位值为2.77 mmol/L,1年后下降38%,2.5年后下降36%,4年后下降30%,安慰剂组LDL中位值为2.78 mmol/L,1年后略有升高,2.5年后下降5%,4年后下降2%,两组间各年份差异均非常显著。(2)临床获益:联合治疗组随访期末主要终点事件发生率较安慰剂组降低17%,差异非常显著。其中联合治疗组在非出血性中风和冠脉血运重建事件发生率低于安慰剂组,而非致死性心肌梗死、冠心病死亡、出血性中风、非冠脉血运重建事件均无差异;在心脑血管病死亡、非心脑血管病死亡及全因死亡等死亡“硬终点”的比较均无差异。矫正性别、年龄、血压、糖尿病、血脂分层、估算的肾小球滤过率(eGFR)、MHD、腹膜透析(PD)等因素后,各水平亚组间比较均无差异。(3)安全性评价:两组间不良事件包括激酶、转氨酶升高及胆石症、肌痛发生率均无差异,但联合治疗组终止治疗发生率为1.1%,高于安慰剂组的0.6%。需要指出的是,“SHARP”研究纳入的对象包含了CKD 2~5期的所有患者,尽管其总体病例数规模庞大,但MHD病例数却略低于早些的“AURORA”研究,如单纯进行MHD患者亚组分析其统计学效力并不高于“AURORA”研究。为此,“SHARP”研究中采用了“第三方评估”的手段,即通过比较发现两组间透析患者(包括MHD、PD)与非透析患者构成比以及各类事件构成比的差异均无统计学意义,间接推断MHD患者与其他阶段的CKD患者一样可从辛伐他汀和依折麦布联合降脂治疗中获益,但对MHD患者的心脑血管病死亡及全因死亡等“硬终点”均无改善。
对临床研究结果的解读
“4D”、“AURORA”和“SHARP”研究是迄今关于MHD患者应用他汀类药物降脂治疗的仅有的三项大型前瞻性、随机、对照研究,研究的设计及结果见表3。这三项研究共同揭示了单纯他汀类药物降脂治疗对MHD患者的总体生存无改善作用。因此,他汀能否成为MHD患者一线治疗药物仍存在较多疑问。Heymann等[40]提出“后SHARP时代”(post-sharp era)他汀应用于CKD患者需要解决六个方面问题:(1)CKD能否视为CVD独立危险因素;(2)CKD患者需要降脂治疗的血脂阈值;(3)CKD患者临床获益与血脂下降水平关联性如何;(4)他汀是否仅应作为CKD患者出现CVD后的二级预防用药;(5)CKD合并糖尿病与不合并糖尿病的降脂策略是否有所区别;(6)CKD患者使用他汀的安全性是否已充分确认。上述六个方面问题同样适用于MHD患者。 尽管存在一些设计上的不足,“4D”、“AURORA”和“SHARP”研究仍然提供了重要的线索。
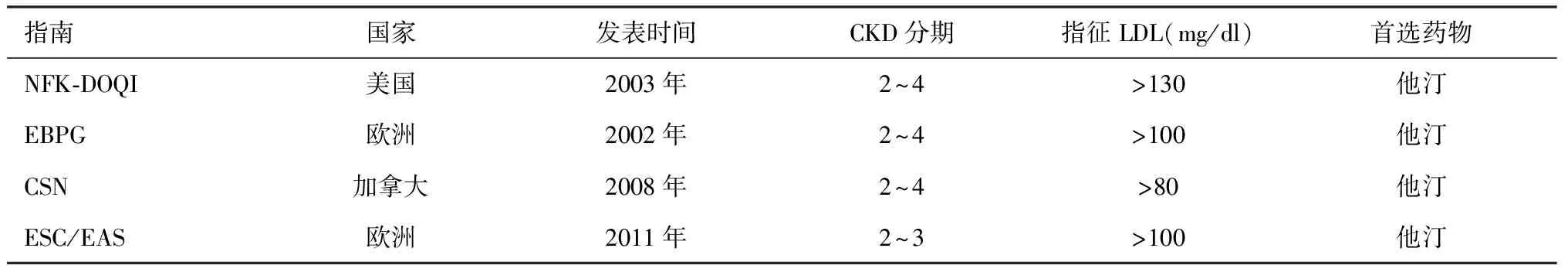
表3 CKD患者降脂治疗指南[32-35]
首先,MHD患者具有降脂治疗的适应证。2004年发表的一项大宗人群队列研究指出在矫正性别、年龄、种族、伴随疾病及社会经济状况后,以膳食改良计划公式(MDRD)所估计的eGFR水平与患者的全因死亡、心血管事件及住院率呈显著负相关[41]。2012年9月《Lancet》发表的一项研究更进一步指出[42],CKD与糖尿病一样,是冠心病的等危症。这项涉及近130万人群、平均随访4年的回顾性对照研究显示,对既往无心肌梗死、eGFR 为15~59.9 ml/(min·1.73m2)的 CKD 3~4期患者急性冠脉事件发生率平均为6.9/1000例患者·年,显著高于合并糖尿病患者的5.4/1 000例患者·年,特别是eGFR<45ml/(min·1.73m2)伴严重蛋白尿的CKD患者其发生率甚至接近后者的2倍。对照上述人群研究,当CKD进展至MHD阶段时,“4D”研究中糖尿病MHD患者心肌梗死或冠心病死亡年发生率高达8.2%,“AURORA”研究中对照组患者相应事件的发生率也达5.3/100例患者·年,均远高于上述CKD或糖尿病人群。因此,MHD患者既是冠心病事件的极高危人群,同时也是降脂治疗的合适人群。MHD患者如此之高的冠心病事件发生率一方面提示临床应尽早干预CKD患者的血脂异常,减缓动脉粥样硬化的发生;另一方面也提示MHD患者发生冠心病事件的主要风险并非血脂异常,降脂治疗必须配合对其他危险因素的干预。
其次,MHD患者他汀类药物治疗的临床获益已相对局限。“4D”、“AURORA”和“SHARP”研究共同的结论是尽管血脂LDL水平均有显著的降低,但有关死亡的“硬终点”均未有获益。有学者尝试对上述研究结果进行解读,Navaneethan等[43]分析主要原因如下:(1)MHD患者具有特殊的心血管病病理基础。CKD患者存在显著的血流动力学的紊乱和代谢功能的异常,两者共同作用导致动脉血管壁病理性重构,具体包括与矿物质代谢异常相关的动脉血管钙化及修饰、肾素-血管紧张素系统活性亢进、内皮素合成分泌增加、内皮细胞功能障碍、氧化应激和非对称性二甲基精氨酸、抗衰老分子Klotho的增加等因素。进入ESRD/MHD阶段的患者随透析龄的增长,上述血管病理性重构明显加速[44]。显然他汀类药物的单一治疗方式干预不能阻断或逆转该病理过程。(2)MHD患者具有特殊的死因构成,猝死和心律失常超过了致死性心肌梗死或中风。“4D”研究中阿托伐他汀组死因构成中猝死占13%,超过了致死性心肌梗死或中风的比重(7%),影响研究终点的评价。(3)研究设计或实施中的缺陷:“4D”和“AURORA”研究中部分患者服用了其他类型他汀药物,如研究者推测“AURORA”中该部分患者占总人数的35%~40%,这些“混杂因素”的存在降低了统计学效力;“SHARP”研究联用了依折麦布,最终的临床获益不能完全归为他汀类药物。此外,Strippoli等[45]认为“4D”和“AURORA”研究将非动脉粥样硬化事件纳入研究终点客观上削弱了两组间的差异。Baigent等[46]则提出“SHARP”研究中将MHD与PD患者合并进行“第三方评估”并不恰当,因为PD患者脂代谢异常较MHD患者更突出,他汀类药物对PD患者的心血管保护作用较MHD患者更显著。因此,迫切需要设计良好、更大样本量的前瞻性临床研究验证他汀类药物对MHD患者的疗效。
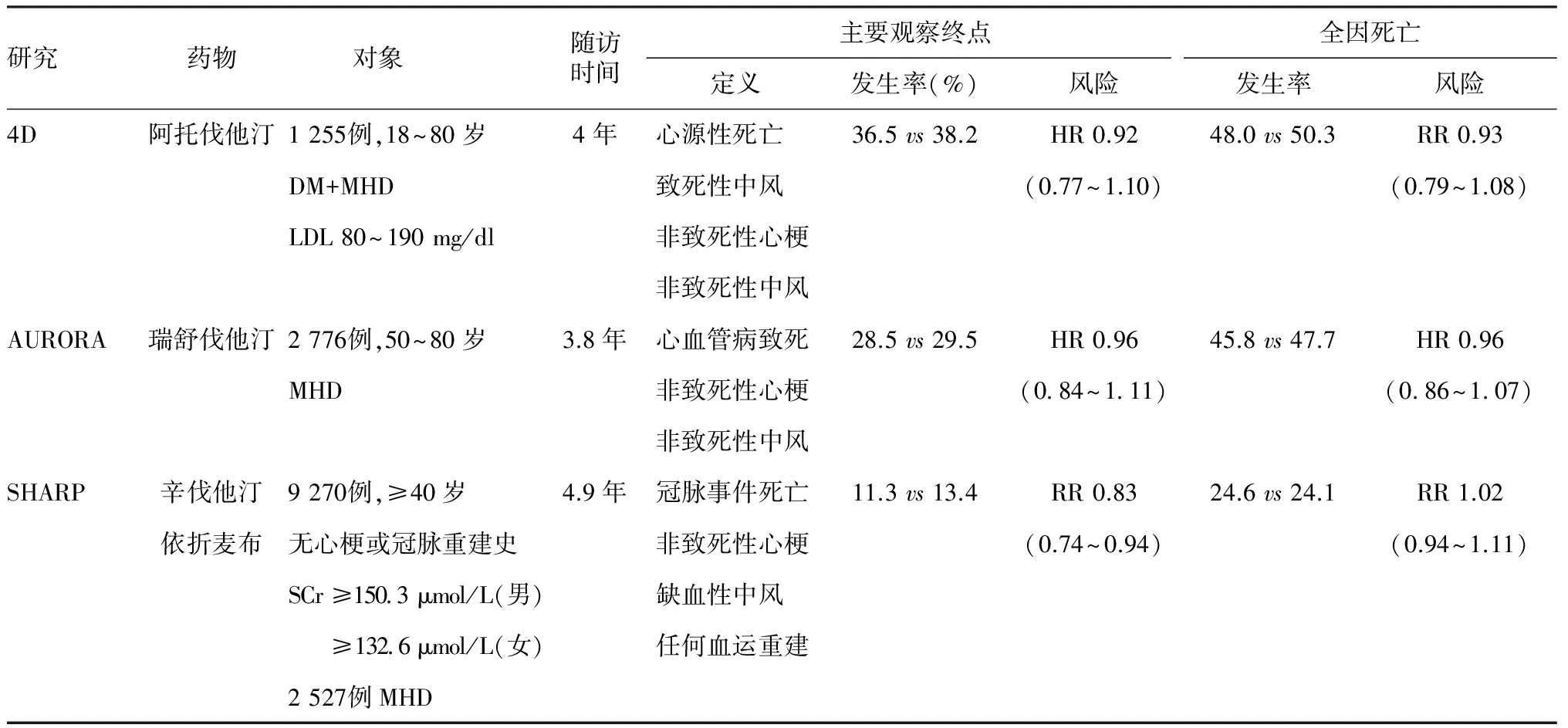
表4 MHD患者应用他汀类药物临床试验[38-41]
再者,MHD患者降脂治疗的阈值和靶目标尚有待更深入研究。MHD患者血脂异常并非表现为LDL水平的异常升高,“4D”、“AURORA”和“SHARP”研究治疗前他汀组的LDL水平中位值分别为3.2 mmol/L、2.5 mmol/L和2.77 mmol/L。“4D”和“SHARP”研究根据指南推荐的CKD 2~4期LDL阈值100 mg/dl(2.5 mmol/L)进行了亚组分析,“AURORA”研究由于LDL平均水平较低,以2.0~2.8 mmol/L为界进行了比较。三项研究中他汀治疗后LDL降幅均能达到或接近40%,但LDL不同水平的亚组间临床获益比较均无显著差异,表明MHD患者的血脂因素在冠心病事件风险中的权重有别于早中期CKD患者。未来的研究设计,有必要参考上述三项研究重新拟定降脂治疗的阈值和靶目标水平,同时筛选对MHD患者灵敏度和特异性更好的血脂评价指标。由于non-HDL较LDL固有的优势,对MHD患者开展non-HDL相关研究不失为一条新途径。
最后,“4D”、“AURORA”和“SHARP”研究均显示他汀类药物在MHD患者中同样具有良好的安全性,为后续开展新的试验奠定了基础。他汀类药物罕见的不良反应有肌炎、横纹肌溶解,后者可能导致严重后果。对于MHD患者,“强化他汀”治疗方案单纯增加剂量存在较大的风险。“SHARP”研究中辛伐他汀剂量减半同时联合胆固醇吸收抑制剂依折麦布同样取得良好的降脂效果,且并发症未见显著增加,有望为将来的研究提供新选择。
小结:目前的临床研究显示MHD患者应用他汀类药物可有效降低LDL水平,但未能从总体上改善MHD患者CVD死亡风险。他汀类药物能否成为MHD患者一线治疗药物尚需设计良好的更大规模临床研究以明确。
1 Sarnak MJ,Levey AS,Schoolwerth AC,et al.Kidney disease as a risk factor for development of cardiovascular disease:a statement from the American Heart Association Councils on Kidney in Cardiovascular Disease,High Blood Pressure Research,Clinical Cardiology,and Epidemiology and Prevention.Circulation,2003,108(17):2154-2169.
2 Vanholder R,Massy Z,Argiles A,et al.Chronic kidney disease as cause of cardiovascular morbidity and mortality.Nephrol Dial Transplant,2005,20(6):1048-1056.
3 USRenal Data System.USRDS 2012 annual data report.http://www.usrds.org/2012/slides/indiv/v2index.htm
4 Stenvinkel P.Chronic kidney disease:a public health priority and harbinger of premature cardiovascular disease.J Intern Med,2010,268(5):456-467.
5 Liu Y,Coresh J,Eustace JA,et al.Association between cholesterol level and mortality in dialysis patients:role of inflammation and malnutrition.JAMA,2004,291(4):451-459.
6 Baigent C,Keech A,Kearney PM,et al.Efficacy and safety of cholesterol-lowering treatment:prospective meta-analysis of data from 90,056 participants in 14 randomised trials of statins.Lancet,2005,366(9493):1267-1278.
7 Ford I,Murray H,Packard CJ,et al.Long-term follow-up of the West of Scotland Coronary Prevention Study.N Engl J Med,2007,357(15):1477-1486.
8 Ridker PM,Danielson E,Fonseca FA,et al.Rosuvastatin to prevent vascular events in men and women with elevated C-reactive protein.N Engl J Med,2008,359(21):2195-2207.
9 Konstantinos M,Lipids and diabetes//Katsilambros N,Diakoumopoulou E,Ioannidis I,et al.Diabetes in Clinical Practice:Questions and Answers from Case Studies.John Wiley & Sons,Ltd.2006:293-297.
10 Shoji T,Ishimura E,Inaba M,et al.Atherogenic lipoproteins in end-stage renal disease.Am J Kidney Dis,2001,38(4 Suppl 1):S30-33.
11 Ansari MR,Maheshwari N,Shaikh MA,et al.Correlation of serum magnesium with dyslipidemia in patients on maintenance hemodialysis.Saudi J Kidney Dis Transpl,2012,23(1):21-25.
12 Pennell P,Leclercq B,Delahunty MI,et al.The utility of non-HDL in managing dyslipidemia of stage 5 chronic kidney disease.Clin Nephrol,2006,66(5):336-347.
13 Ritz E,Wanner C.Lipid abnormalities and cardiovascular risk in renal disease.J Am Soc Nephrol,2008,19(6):1065-1070.
14 Samouilidou EC,Karpouza AP,Kostopoulos V,et al.Lipid abnormalities and oxidized LDL in chronic kidney disease patients on hemodialysis and peritoneal dialysis.Ren Fail,2012,34(2):160-164.
15 Hirano T,Sakaue T,Misaki A,et al.Very low-density lipoprotein-apoprotein CI is increased in diabetic nephropathy:comparison with apoprotein CIII.Kidney Int,2003,63(6):2171-2177.
16 Chan DT,Dogra GK,Irish AB,et al.Chronic kidney disease delays VLDL-apoB-100 particle catabolism:potential role of apolipoprotein C-III.J Lipid Res,2009,50(12):2524-2531.
27 Vaziri ND,Wang XQ,Liang K.Secondary hyperparathyroidism downregulates lipoprotein lipase expression in chronic renal failure.Am J Physiol,1997,273(6 Pt 2):F925-930.
18 Prinsen BH,de Sain-van der Velden MG,de Koning EJ,et al.Hypertriglyceridemia in patients with chronic renal failure:possible mechanisms.Kidney Int Suppl,2003,(84):S121-124.
19 Katopodis KP,Elisaf M,Balafa O,et al.Influence of the type of membrane and heparin on serum lipid parameters during a dialysis session:a pilot study.Am J Nephrol,2004,24(5):469-473.
20 Vaziri ND,Navab K,Gollapudi P,et al.Salutary effects of hemodialysis on low-density lipoprotein proinflammatory and high-density lipoprotein anti-inflammatory properties in patient with end-stage renal disease.J Natl Med Assoc,2011,103(6):524-533.
21 Wanner C,Bahner U,Mattern R,et al.Effect of dialysis flux and membrane material on dyslipidaemia and inflammation in haemodialysis patients.Nephrol Dial Transplant,2004,19(10):2570-2575.
22 Li PK,Cheng YL,Leung CB,et al.Effect of membrane permeability on inflammation and arterial stiffenss:a randomized trial.Clin J Am Soc Nephrol,2010,5(4):652-658.
23 Jung K,Scheifler A,Schulze BD,et al.Lower serum high-density lipoprotein-cholesterol concentration in patients undergoing maintenance hemodialysis with acetate than with bicarbonate.Am J Kidney Dis,1995,25(4):584-588.
24 Schiffl H,Lang SM.Effects of dialysis purity on uremic dyslipidemia.Ther Apher Dial,2010,14(1):5-11.
25 Mekki K,Remaoun M,Belleville J,et al.Hemodialysis duration impairs food intake and nutritional parameters in chronic kidney disease patients.Int Urol Nephrol,2012,44(1):237-244.
26 Tonelli M,Isles C,Curhan GC,et al.Effect of pravastatin on cardiovascular events in people with chronic kidney disease.Circulation,2004,110(12):1557-1563.
27 Pedersen TR,Kjekshus J,Berg K,et al.Randomised trial of cholesterol lowering in 4444 patients with coronary heart disease:the Scandinavian Simvastatin Survival Study (4S).1994.Atheroscler Suppl,2004,5(3):81-87.
28 Ridker PM,Danielson E,Fonseca FA,et al.Rosuvastatin to prevent vascular events in men and women with elevated C-reactive protein.N Engl J Med,2008,359(21):2195-2207.
29 Kidney Disease Outcomes Quality Initiative (K/DOQI) Group.K/DOQI clinical practice guidelines for management of dyslipidemias in patients with kidney disease.Am J Kidney Dis,2003,41 (4 Suppl 3):S1-S91.
30 European Best Practice Guidelines Expert Group on Hemodialysis,European Renal Association.Section VII.Vascular disease and risk factors.Nephrol Dial Transplant,2002,17(Suppl 7):88-109.
31 Levin A,Hemmelgarn B,Culleton B,et al.Guidelines for the management of chronic kidney disease.CMAJ,2008,179(11):1154-1162.
32 Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and the European Atherosclerosis Society (EAS),Catapano AL,Reiner Z,De Backer G,et al.ESC/EAS Guidelines for the management of dyslipidaemias:the Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and the European Atherosclerosis Society (EAS).Atherosclerosis,2011,217(suppl 1):S1-44.
33 Kidney Disease:improving Global Outcomes(KDIGO) CKD Work Group.KDIGO Clinical Practice Guideline for the Evaluation and Managemen of Chronic Kidney Disease.Kidney Int suppl,2013,3(1):1-150.
34 Seliger SL,Weiss NS,Gillen DL,et al.HMG-CoA reductase inhibitors are associated with reduced mortality in ESRD patients.Kidney Int,2002,61(1):297-304.
35 Mason NA,Bailie GR,Satayathum S,et al.HMG-coenzyme a reductase inhibitor use is associated with mortality reduction in hemodialysis patients.Am J Kidney Dis,2005,45(1):119-126.
36 Wanner C,Krane V,M?rz W,et al.Atorvastatin in patients with type 2 diabetes mellitus undergoing hemodialysis.N Engl J Med,2005,353(3):238-248.
37 AURORA Study Group.Fellstr?m BC,Jardine AG,Schmieder RE,et al.Rosuvastatin and cardiovascular events in patients undergoing hemodialysis.N Engl J Med,2009,360(14):1395-1407.
38 Sharp Collaborative Group.Study of Heart and Renal Protection (SHARP):randomized trial to assess the effects of lowering low-density lipoprotein cholesterol among 9,438 patients with chronic kidney disease.Am Heart J,2010,160(5):785-794.
39 SHARP Investigators.Baigent C,Landray MJ,Reith C,et al.The effects of lowering LDL cholesterol with simvastatin plus ezetimibe in patients with chronic kidney disease (Study of Heart and Renal Protection):a randomised placebo-controlled trial.Lancet,2011,377(9784):2181-2192.
40 Heymann EP,Kassimatis TI,Goldsmith DJ.Dyslipidemia,statins,and CKD patients' outcomes - review of the evidence in the post-sharp era.J Nephrol,2012,25(4):460 -472.
41 Go AS,Chertow GM,Fan D,et al.Chronic kidney disease and the risks of death,cardiovascular events,and hospitalization.N Engl J Med,2004,351(13):1296-1305.
42 Tonelli M,Muntner P,Lloyd A,et al.Risk of coronary events in people with chronic kidney disease compared with those with diabetes:a population-level cohort study.Lancet,2012,380(9844):807-814.
43 Navaneethan SD,Hegbrant J,Strippoli GF.Role of statins in preventing adverse cardiovascular outcomes in patients with chronic kidney disease.Curr Opin Nephrol Hypertens,2011,20(2):146-152.
44 Briet M,Burns KD.Chronic kidney disease and vascular remodelling:molecular mechanisms and clinical implications.Clin Sci (Lond),2012,123(7):399-416.
45 Strippoli GF,Craig JC.Sunset for statins after AURORA? N Engl J Med,2009,360(14),1455-1457.
46 Upadhyay A,Weiner DE.Lipid-lowering therapy in individuals with CKD:lessons learned from SHARP.Am J Kidney Dis,2012,59(2):170-173.
