尿液microRNAs作为局灶节段性肾小球硬化疾病活动生物标志物的研究
2013-04-26张婉芬,张昌明,刘春蓓等
对象和方法
研究对象按患者蛋白尿的程度将患者分为两组:活动性FSGS组(FSGS-A组)98例,患者尿蛋白定量>3.5 g/24h;非活动性FSGS组(FSGS-NA组)94例,患者尿蛋白定量<0.4 g/24h。
FSGS治疗组:41例初次接受60 mg足量激素治疗的FSGS患者,激素治疗8周,留取治疗前后尿液标本,其中26例激素治疗有效,15例激素治疗无效。
疾病对照组:膜性肾病(MN),分为MN活动组(MN-A组)29例,患者尿蛋白>3.5 g/24h ; MN非活动组(MN-NA组)26例,患者尿蛋白<0.4 g/24h。糖尿病肾病(DN),分为DN活动组(DN-A组) 23例,患者尿蛋白>3.5 g/24h;DN非活动组(DN-NA组) 27例,患者尿蛋白<0.4 g/24h。
正常对照组(NC组):共94例,年龄性别与患者年龄、性别匹配,全身无器质及功能性疾病。
记录性别、年龄、尿蛋白、尿N-乙酰-β-D-氨基葡萄糖苷酶(NAG)、尿视黄醇结合蛋白(RBP)、血白蛋白、血清肌酐(SCr)、血胱抑素C(CysC)、血总胆固醇、三酰甘油等临床资料。采用MDRD4估算肾小球滤过率(eGFR),eGFR=186×SCr-1.154×年龄-0.203×(0.742,女性)[7]。所有标本留取都根据伦理委员会的标准经过本人的同意。
RNA提取方法送检TaqMan低密度芯片尿标本RNA的提取:每组每例取等量尿液上清混合后(每组共100 ml尿液上清)使用Trizol(Invitrogen公司)法提取总RNA,即每份血浆中加入两倍体积的Trizol,然后进行2次酚/氯仿抽提,得到的RNA用20 μl DEPC水溶解后送Invitrogen公司行microRNA低密度芯片检测[8]。尿液单个样本miRNAs提取方法:取300 μl样品加入100 μl DEPC水,充分混匀后加入等体积的酸性酚(pH 4.7~5.5)和氯仿,酸性酚氯仿体积1∶1,进行抽提,后续抽提方法同血清中提取RNA方法一致[9],RNA用10 μl DEPC水溶解,-80℃保存。
miRNA RT-PCR和quantitative Real-time实时定量PCR(qRT-PCR) 采用探针法检测尿中的miRNAs的含量,探针购于Applied Biosystems(Foster City,CA,USA)。逆转录酶及taq聚合酶购于takara。逆转录使用RNA 2 μl,所得到的cDNA于-20℃保存备用。定量PCR每反应体系使用不稀释的cDNA 1 μl。所有的PCR反应均行3副孔。qRT-PCR采用ABI Prism 7900 定量PCR仪器进行检测。CT值越大表示含量越低[10]。
他的声调,阴沉沉的,干巴巴的,完全没有感情。他冷冷地说着这些话;前面的那个只顾一瘸一拐地向流过岩石、激起一片泡沫的白茫茫的小河里走去,一句话也不回答。
TaqMan microRNAarray检测将提取的尿液上清总RNA送invitrogen公司行TaqMan低密度芯片检测。芯片版本为TaqMan Array Human MicroRNA A+B Cards Set v3.0,可检测754个人类miRNA分子,采用7900HT PCR 系统进行检测(Applied biosystems)。以U6为内参,2-ΔΔCT计算各miRNAs的变化倍数,选取CT>30且FSGS组尿液上清中miRNAs较正常对照组升高>2倍的miRNAs进行后续的验证。
统计学分析所有的数据采用SPSS 18.0统计分析软件进行处理。本研究中临床指标用均数±标准差表示;各组之间miRNAs表达水平用均数±标准误差示,比较采用Nonparametric Mann—Whitney U检验。相关性分析采用Spearman检验,P<0.05为差异有统计学意义。
结 果
筛选和验证FSGS疾病活动相关的miRNAs FSGS患者临床资料见表1和表2。
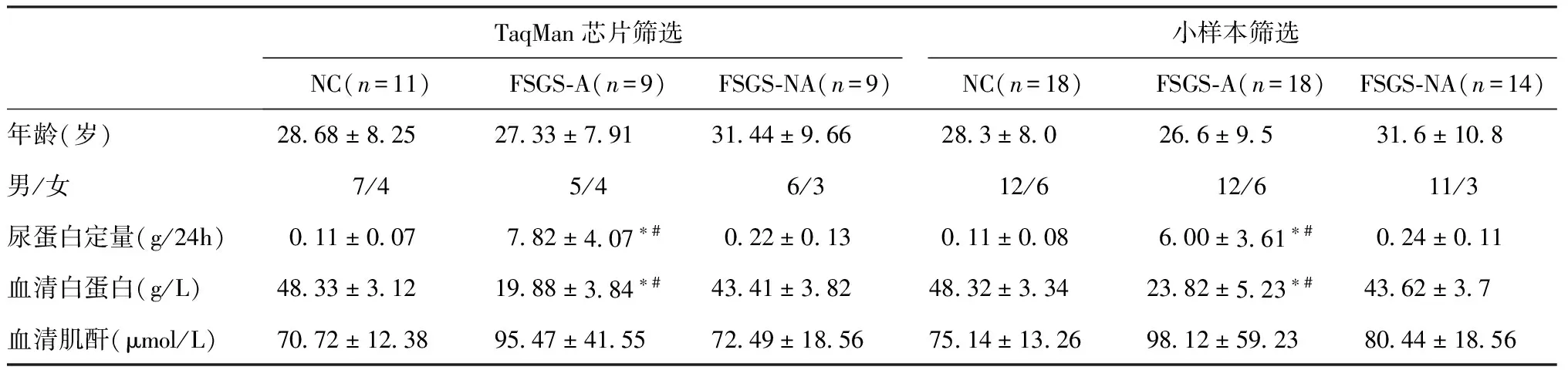
表1 芯片检测及初步筛选FSGS患者的临床资料
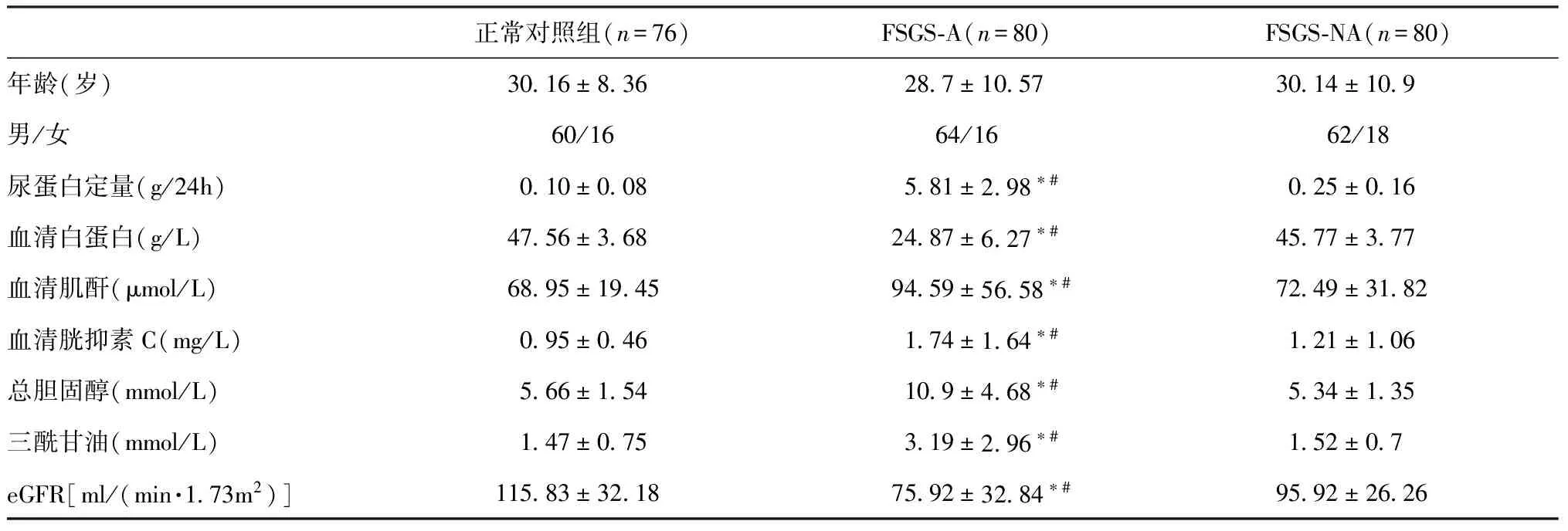
表2 大样本验证FSGS患者的临床资料
芯片筛选与FSGS活动性相关的miRNAs 实验采用低密度芯片检测FSGS患者尿液上清中循环microRNAs表达谱,检测分为三组:FSGS-A,FSGS-NA和NC组。三组患者的具体信息见表1。在芯片检测的754种miRNAs中,FSGS-A组,FSGS-NA组和NC患者分别检测到226种,197种和 173种miRNAs的表达。miRNAs表达认为具有显著性差异的标准:(1) 检测的CT值≤30;(2) 在两组之间进行比较时,变化倍数在2倍以上。基于上述的标准,与NC组比较,FSGS-A组患者尿液中,有52种miRNAs表达升高,111种miRNAs表达下降;与FSGS-NA组比较,FSGS-A患者尿液中,有32种miRNAs表达上调,164种miRNAs表达下调。27个miRNAs在FSGS-A组中比FSGS-NA组和NC组表达均上调。
小样本初步筛选尿液miRNAs的表达 在初步筛选中对18例FSGS-A组,14例FSGS-NA组患者和18例NC组对照的尿液进行了qR-PCR测定。除了FSGS-A组升高的27个miRNAs,另外miRNA-10a,miRNA-10b,miRNA-21,miRNA-27b,miRNA-29c,miRNA-30a,miRNA-146a,miRNA-155,miRNA-192,miRNA-194,miRNA-196a,miRNA-200a,miRNA-204,miRNA-320也进行了测定[11-13]。 qRT-PCR测定CT>32或在标本中的检出率<75%认为超过准确的定量范围,排除后续的验证。结果显示其中miRNA-21、miRNA-146a、miRNA-192、miRNA-199a、miRNA-200a和miRNA-204各组之间表达水平不存在明显差异。有6个miRNAs表达水平在活动组明显升高,分别是miRNA-196a、miRNA-30a-5p、miRNA-155、miRNA-320、miRNA-135b和miRNA-490。 活动性FSGS组与正常组相比,尿液上清miRNA-196a、miRNA-155和miRNA-320尿液上清表达变化倍数>5,miRNA-135b、miRNA-490和miRNA-30a的变化倍数>2,(P均<0.05);非活动性FSGS组与正常组相比,尿液上清miRNA-30a、miRNA-155和miRNA-320的水平明显升高(P<0.05),其中miRNA-155的变化最为明显,变化倍数>5(图1)。据此,选定miRNA-196a,miRNA-30a-5p,miRNA-155,miRNA-320,miRNA-135b和miRNA-490进行后续大样本的验证。
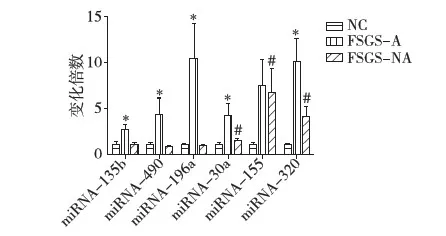
图1 尿液miRNAs的表达水平的比较
大样本尿液miRNAs表达的验证 大样本验证阶段对80例FSGS-A组,80例FSGS-NA组和76例NC组患者尿液miRNA-196a,miRNA-30a-5p,miRNA-155,miRNA-320,miRNA-135b和miRNA-490的水平进行了测定。结果显示,尿液miRNA-135b和miRNA-320的水平在样本增大之后,各组间无明显的差异。miRNA-196a,miRNA-30a-5p,miRNA-155和miRNA-490的水平在FSGS-A组尿液中的水平显著高于FSGS-NA组和对照组(P<0.001)。本研究结果发现:miRNA-155在尿液上清中的含量最高,miRNA-490的含量最低。尿液上清miRNA-196a和miRNA-30a的水平在FSGS-NA组和NC组之间无统计学差异,而尿液上清miRNA-155和miRNA-490的水平,不仅FSGS-A组显著高于FSGS-NA组和NC组(P<0.001),而且FSGS-NA组显著高于NC组(P<0.05)。与NC组相比,FSGS-A组尿液上清miRNA-196a,miRNA-30a,miRNA-155和miRNA-490的变化倍数分别是7.58,2.52,7.72,6.11;与正常组相比,FSGS-NA组尿液上清miRNA-196a,miRNA-30a,miRNA-155和miRNA-490的变化倍数分别是1.24,0.8,2.38,1.61(图2)。验证结果显示,尿液miRNAs在FSGS疾病活动状态下显著升高,疾病缓解状态时水平较活动组下降,提示尿液miRNAs可能与疾病活动性相关。

图2 尿液上清miRNA-196a,miRNA-30a,miRNA-155and miRNA-490的表达变化
尿液miRNAs水平与临床指标之间的关系本研究结果显示,尿液miRNA-196a,miRNA-30a,miRNA-155和miRNA-490的水平在FSGS-A组患者显著高于NC组和FSGS-NA组的患者,进一步分析miRNA-196a,miRNA-30a,miRNA-155和miRNA-490的升高倍数与患者临床指标之间的关系验证miRNAs水平与FSGS活动性之间的关系。结果显示,尿液miRNAs的水平与蛋白尿正相关,相关系数分别是miRNA-196a(r=0.622,P<0.01),miRNA-30a(r=0.561,P<0.01),miRNA-155(r=0.363,P<0.01)和miRNA-490(r=0.624,P<0.01)(图3);尿液miRNAs的水平与血清白蛋白水平负相关,相关系数分别是miRNA-196a(r=-0.608,P<0.01),miRNA-30a(r=-0.544,P<0.01),miRNA-155(r=-0.361,P<0.01)和miRNA-490(r=-0.591,P<0.01)(图4);此外,尿液miRNAs水平与总胆固醇水平正相关,相关系数分别是miRNA-196a(r=0.568,P<0.01),miRNA-30a(r=0.556,P<0.01),miRNA-155(r=0.404,P<0.01)和miRNA-490(r=0.554,P<0.01);与三酰甘油的水平也存在正相关性,分别是miRNA-196a(r=0.485,P<0.01),miRNA-30a(r=0.421,P<0.01),miRNA-155(r=0.228,P<0.01)和miRNA-490(r=0.483,P<0.01)。相关性分析显示,尿液miRNA-196a,miRNA-30a,miRNA-155和miRNA-490的变化水平与患者尿蛋白、白蛋白、胆固醇、三酰甘油等临床特征性指标相关性良好。
FSGS患者尿液miRNAs表达的特异性
临床资料 作为疾病对照的MN和DN患者的基本情况见表3。

图3 尿液miRNAs水平与尿蛋白之间的相关性
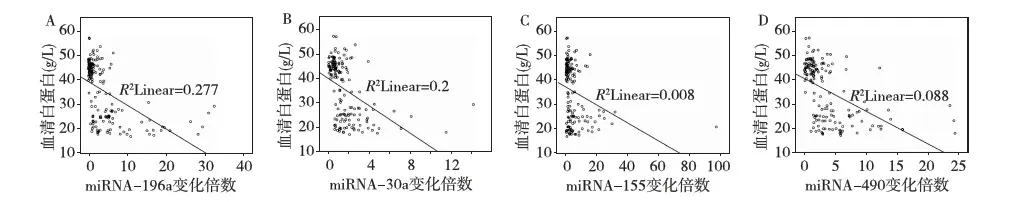
图4 尿液miRNAs水平与血清白蛋白之间的相关性
表3MN和DN患者的临床资料
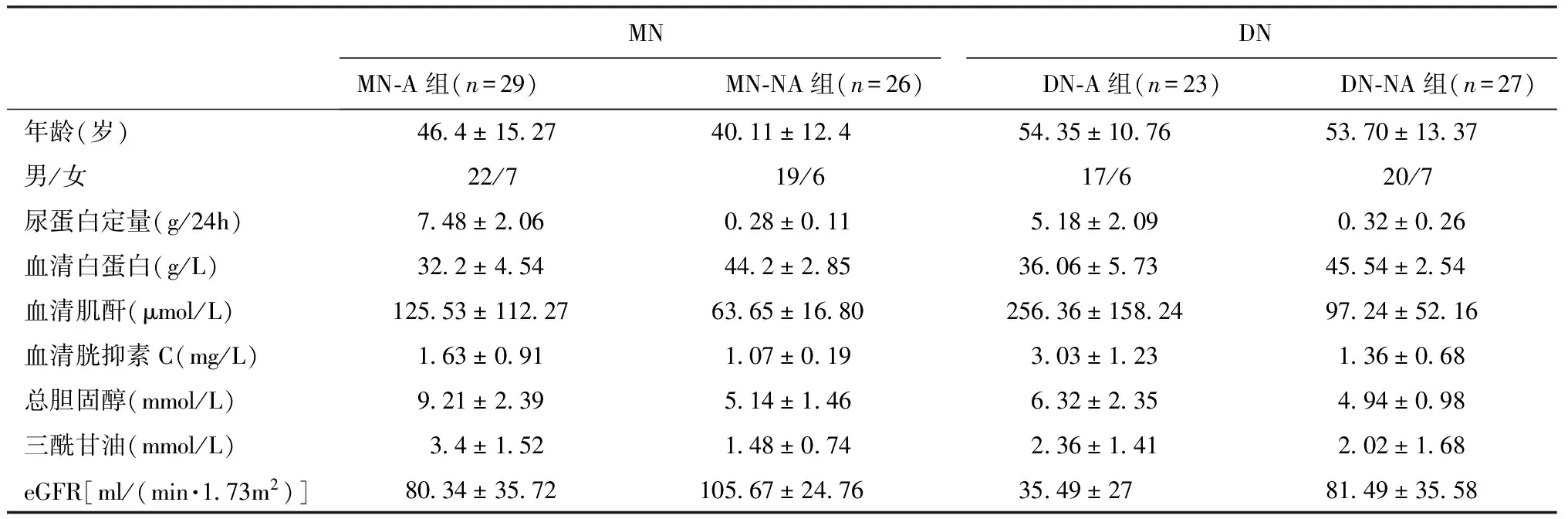
MN:膜性肾病;DN:糖尿病肾病;eGFR:估算的肾小球滤过率;MN-A组:活性性MN组;MN-NA组:非活动性MN组;DN-A组:活动性DN组;DN-NA组:非活动性DN组
MN和DN患者尿液miRNA-196a、miRNA-30a、miRNA-155和miRNA-490表达变化 为了进一步明确FSGS尿液miRNAs变化的疾病特异性,因此实验进一步评估了miRNA-196a、miRNA-30a、miRNA-155和miRNA-490在MN和DN尿液中的表达情况。结果显示:在MN和DN患者尿液miRNA-196a、miRNA-30a和miRNA-490在MN-A组和MN-NA组CT值下降表明其表达水平在MN-A组和MN-NA组均明显高于NC组(P<0.001),但是在MN-A和MN-NA组之间不存在统计学差异;尿液miRNA-196a、miRNA-30a和miRNA-490的表达变化在DN中与MN相同;但是miRNA-196a、miRNA-30a和miRNA-490的变化趋势MN、DN患者与FSGS患者不同。尿液miRNA-155的水平在MN患者和DN患者中变化相同,在MN-A和DN-A组尿液中miRNA-155的水平不仅显著高于正常组,且显著高于MN-NA和DN-NA组(P<0.05),与其在FSGS患者尿液中的变化相同(图5)。上述结果显示,尿液miRNA-196a、miRNA-490和miRNA-30a的在FSGS中的变化与NN和DN不相同,在FSGS患者中活动性的患者中变化明显。
FSGS患者尿液miRNAs的表达变化与治疗的关系
临床资料 治疗组患者临床资料见表4。接受足量激素治疗的FSGS患者26例激素治疗有效,15例激素治疗无效。
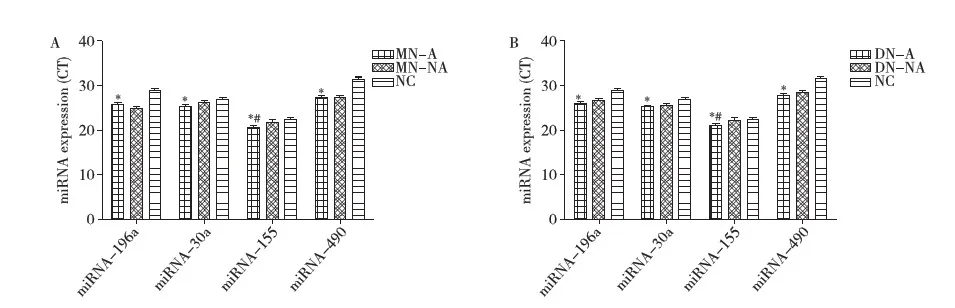
图5 MN和DN患者尿液miRNA-196a,miRNA-30a,miRNA-155和miRNA-490的表达情况
表4FSGS患者激素治疗前后临床资料的比较
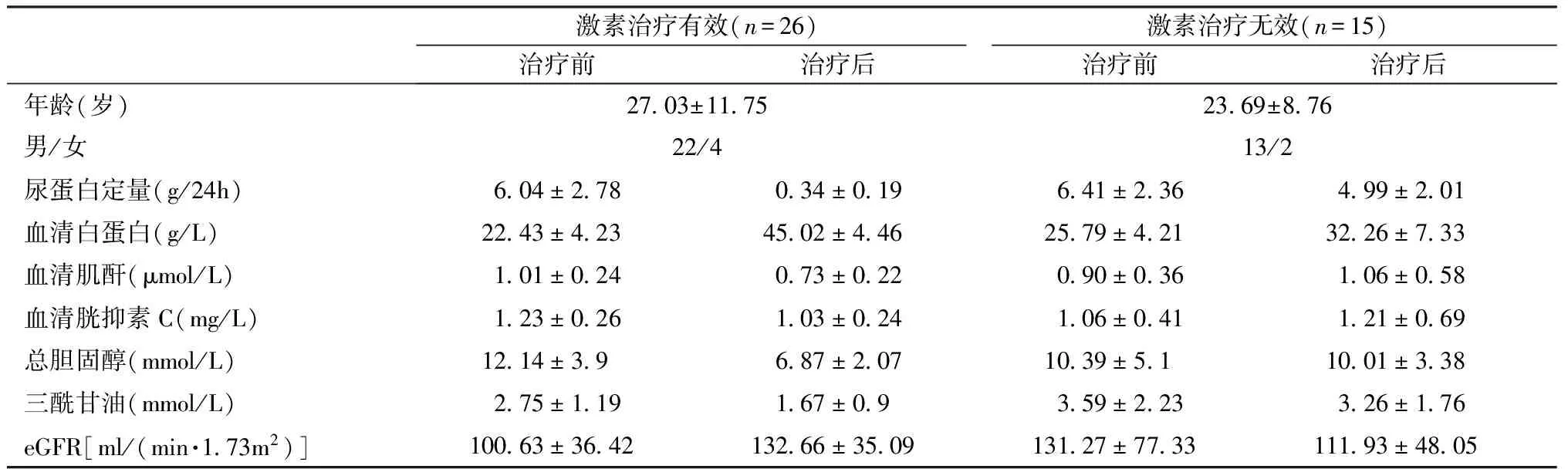
FSGS:局灶节段性肾小球硬化:eGFR:估算的肾小球滤过率
FSGS患者激素治疗前后尿液miRNAs的改变 为了评估同一个FSGS患者在治疗前后的尿液miRNAs水平的改变,我们测定了41例FSGS患者在接受足量激素治疗前后尿液miRNA-196a、miRNA-30a、miRNA-155和miRNA-490的水平。在激素治疗有效的FSGS患者尿液中,miRNA-196a、miRNA-30a、miRNA-155和miRNA-490治疗后CT值上升,表明其表达水平随着病情的缓解明显下降(P<0.001),与NC组相比,尿液miRNAs水平还是升高的;而激素治疗无效的FSGS患者,miRNA-196a、miRNA-30a、miRNA-155和miRNA-490在治疗前后无明显的变化(P>0.05)(图6)。结果证实,当FSGS患者经激素治疗有效,上述四个miRNAs在尿液中的变化与激素治疗无效情况存在明显差异。
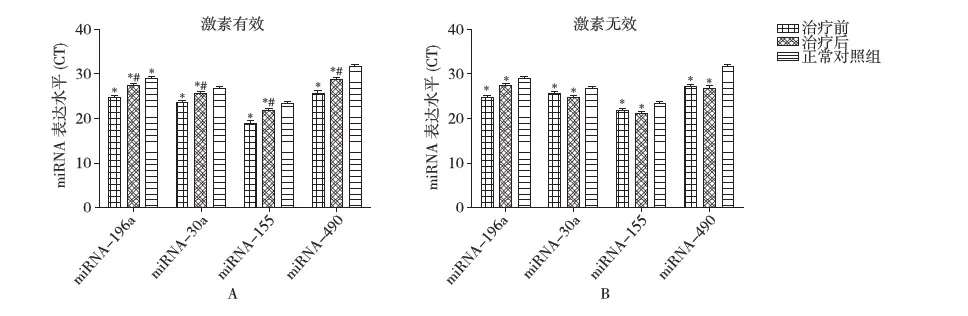
图6 在激素治疗前后尿液miRNA-196a、miRNA-30a、miRNA-155和miRNA-490的表达变化
讨 论
本研究发现FSGS患者尿液中miRNA-155、miRNA-196a、miRNA-30a、miRNA-490的含量在疾病活动状态明显高于疾病缓解状态,miRNA-155、miRNA-196a、miRNA-30a、miRNA-490的改变与患者的尿蛋白、血清白蛋白,血脂等临床指标具有很好的相关性,且治疗后,随着疾病的缓解上述miRNAs水平明显下降。为了对其在反映FSGS疾病活动中的特异性进行验证,我们同时测定了MN和DN患者尿液miRNA-155、miRNA-196a、miRNA-30a、miRNA-490的水平,发现miRNA-196a、miRNA-30a和miRNA-490这三种miRNAs是FSGS特异的标志物。因此,有必要在临床上扩大病例,开展前瞻性的研究对上述标志物的临床应用以进一步的研究验证。
miRNA-30家族,miR196a、196b在人体的肾脏的含量明显高于心、肺、肝、脾、结肠[11]。FSGS患者尿液中miRNA-196a和miRNA-30a含量的增加可能反映了肾脏组织固有细胞的表达情况。近期研究发现,miRNA-30参与了足细胞损伤[14],足细胞Dicer敲除小鼠的肾小球基因表达谱芯片显示在190个基因表达上调,其中很多是miRNA-30家族的靶基因,推测miRNA-30家族可能参与了Dicer敲除小鼠的足细胞损伤的过程[14-16]。FSGS患者肾小球中表达下降,在嘌呤霉素诱导的大鼠肾病模型中表达下降,进一步研究发现miRNA-30能通过抑制p53和notch1的激活保护足细胞避免损伤。体内和体外实验还发现,糖皮质激素能维持miRNA-30在足细胞中的表达,发挥足细胞保护作用(未发表资料)。
在脊椎动物基因组中miRNA-196家族位于HOX基因簇上[17],miRNA-196的进化行为上与HOX基因非常相似[18],HOX基因与胚胎发育密切相关[19],研究证实miRNA-196a在胚胎发育中起着重要的作用[20,21]。miRNA-196a还参与了多种肿瘤的病理生理过程,参与调节免疫及细胞的增生[22]。血清miRNA-196a水平在胰腺导管腺癌的患者中显著升高,肿瘤切除之后表达水平下降,并且miRNA-196a水平与患者的中位生存时间相关[23],提示血清miRNA-196a可能是诊断的潜在生物标志物。在肾透明细胞癌中,miRNA-196a表达下调[24],在高血压肾脏病中,miR196a在肾皮质中表达升高,在肾脏髓质中无显著变化[25]。本研究发现活动性FSGS患者尿液miRNA-196a水平升高,该变化与疾病发病机制之间的关联尚需进一步研究阐明。
miRNA-155参与多种生理和病理过程,功能包括造血细胞的分化、免疫、炎症、肿瘤及心血管疾病等等[26-28]。体内研究发现miRNA-155通过影响Ⅰ型干扰素信号影响CD8+T细胞的应答和清除病毒的能力[29]。沉默miRNA-155通过上调肾肿瘤细胞BACH1,抑制肿瘤细胞增生和迁移,诱导细胞凋亡[30],IgA肾病患者肾组织和尿液中miRNA-155的表达均升高,且与疾病的严重程度相关,提示了miRNA-155参与了肾脏细胞疾病状态下的病理过程。在小鼠急性肾损伤模型中,miRNA-155在肾组织中表达升高,在血清和尿液上清中表达下降[31]。上述研究结果提示,miRNA-155是肾组织损伤后一个共同的反应,本研究也表明无论是FSGS,还是MN和DN,尿液miRNA-155在疾病活动情况下均明显升高。此外,尿液miRNA-155含量的改变不有可能与患者的全身免疫调节异常有关。
目前尚无关于miRNA-490在肾脏方面的研究。之前的研究发现miRNA-490在肝细胞癌细胞中表达上调,体外高表达miRNA-490导致细胞增生、迁移及浸润能力的增加,有促进上皮细胞转分化的作用[32]。本研究发现活动性FSGS患者尿液中miRNA-490 水平明显增高,其在肾脏疾病发病机制中的作用值得进一步探究。
本研究也存在一些不足之处。首先,未对患者组织miRNAs谱进行检测,因此,影响了对这几个miRNAs的变化与FSGS发病机制之间的联系进行讨论。其次,缺少FSGS患者血清中miRNAs的同步研究。因此,进一步探寻FSGS患者疾病活动时尿液中miRNA-196a、miRNA-30a和miRNA-490这三种miRNAs的来源及其调控机制,对于提高FSGS发病机制的认识和上述三种尿液miRNAs的临床应用具有重要的意义。
本研究发现活动性FSGS患者尿液中miRNA-196a、miRNA-30a、miRNA-490水平明显升高,其水平不仅与疾病活动性密切相关,且与治疗反应密切相关,提示尿液中这三种miRNAs,有可能成是判断FSGS疾病活动和观察疗效的生物标志物。
1 D’Agati VD,Fogo AB,Bruijn JA,et al.Pathologic classification of focal segmental glomerulosclerosis:a working proposal.Am J Kidney Dis,2004,43(2):368-382.
2 Thomas DB,Franceschini N,Hogan SL,et al.Clinical and pathologic characteristics of focal segmental glomerulosclerosis pathologic variants.Kidney Int,2006,69(5):920-926.
3 Wang G,Tam LS,Li EK,et al.Serum and urinary free microRNA level in patients with systemic lupus erythematosus.Lupus,2011,20(5):493-500.
4 Wang G,Kwan BC,Lai FM,et al.Elevated levels of miRNA-146a and miRNA-155 in kidney biopsy and urine from patients with IgA nephropathy.Dis Markers,2011,30(4):171-179.
5 Wang G,Kwan BC,Lai FM,et al.Intrarenal expression of miRNAs in patients with hypertensive nephrosclerosis.Am J Hypertens,2010,23(1):78-84.
6 Wang G,Kwan BC,Lai FM,et al.Intrarenal expression of microRNAs in patients with IgA nephropathy.Lab Invest,2010,90(1):98-103.
7 Kimmel PL,Emont SL,Newmann JM,et al.ESRD patient quality of life:symptoms,spiritual beliefs,psychosocial factors,and ethnicity.Am J Kidney Dis,2003,42(4):713-721.
8 Zhang C,Wang C,Chen X,et al.Expression profile of microRNAs in serum:a fingerprint for esophageal squamous cell carcinoma.Clin Chem,2010,56(12):1871-1879.
9 Chen X,Ba Y,Ma L,et al.Characterization of microRNAs in serum:a novel class of biomarkers for diagnosis of cancer and other diseases.Cell Res,2008,18(10):997-1006.
10 Liu R,Zhang C,Hu Z,et al.A five-microRNA signature identified from genome-wide serum microRNA expression profiling serves as a fingerprint for gastric cancer diagnosis.Eur J Cancer,2011,47(5):784-791.
11 Wang N,Zhou Y,Jiang L,et al.Urinary microRNA-10a and microRNA-30d serve as novel,sensitive and specific biomarkers for kidney injury.PLoS One,2012,7(12):e51140.
12 Ichii O,Otsuka S,Sasaki N,et al.Altered expression of microRNA miRNA-146a correlates with the development of chronic renal inflammation.Kidney Int,2012,81(3):280-292.
13 Lorenzen JM,Kielstein JT,Hafer C,et al.Circulating miRNA-210 predicts survival in critically ill patients with acute kidney injury.Clin J Am Soc Nephrol,2011,6(7):1540-1546.
14 Shi S,Yu L,Chiu C,et al.Podocyte-selective deletion of dicer induces proteinuria and glomerulosclerosis.J Am Soc Nephrol,2008,19(11):2159-2169.
15 Ho J,Ng KH,Rosen S,et al.Podocyte-specific loss of functional microRNAs leads to rapid glomerular and tubular injury.J Am Soc Nephrol,2008,19(11):2069-2075.
16 Harvey SJ,Jarad G,Cunningham J,et al.Podocyte-specific deletion of dicer alters cytoskeletal dynamics and causes glomerular disease.J Am Soc Nephrol,2008,19(11):2150-2158.
17 Woltering JM,Durston AJ.MiRNA-10 represses HoxB1a and HoxB3a in zebrafish.PLoS One,2008,3(1):e1396.
18 Tanzer A,Amemiya CT,Kim CB,et al.Evolution of microRNAs located within Hox gene clusters.J Exp Zool B Mol Dev Evol,2005,304(1):75-85.
19 McGinnis W,Krumlauf R.Homeobox genes and axial patterning.Cell,1992,68(2):283-302.
20 Hornstein E,Mansfield JH,Yekta S,et al.The microRNA miRNA-196 acts upstream of Hoxb8 and Shh in limb development.Nature,2005,438(7068):671-674.
21 Qiu R,Liu Y,Wu JY,et al.Misexpression of miRNA-196a induces eye anomaly in Xenopus laevis.Brain Res Bull,2009,79(1):26-31.
22 Chen C,Zhang Y,Zhang L,et al.MicroRNA-196:critical roles and clinical applications in development and cancer.J Cell Mol Med,2011,15(1):14-23.
23 Kong X,Du Y,Wang G,et al.Detection of differentially expressed microRNAs in serum of pancreatic ductal adenocarcinoma patients:miRNA-196a could be a potential marker for poor prognosis.Dig Dis Sci,2011,56(2):602-609.
24 White NM,Khella HW,Grigull J,et al.miRNA profiling in metastatic renal cell carcinoma reveals a tumour-suppressor effect for miRNA-215.Br J Cancer,2011,105(11):1741-1749.
25 Marques FZ,Campain AE,Tomaszewski M,et al.Gene expression profiling reveals renin mRNA overexpression in human hypertensive kidneys and a role for microRNAs.Hypertension,2011,58(6):1093-1098.
26 Faraoni I,Antonetti FR,Cardone J,et al.miRNA-155 gene:a typical multifunctional microRNA.Biochim Biophys Acta,2009,1792(6):497-505.
27 Lindsay MA.microRNAs and the immune response.Trends Immunol,2008,29(7):343-351.
28 Yang W,Lee DY,Ben-David Y.The roles of microRNAs in tumorigenesis and angiogenesis.Int J Physiol Pathophysiol Pharmacol,2011,3(2):140-155.
29 Gracias DT,Stelekati E,Hope JL,et al.The microRNA miRNA-155 controls CD8(+) T cell responses by regulating interferon signaling.Nat Immunol,2013,14(6):593-602.
30 Li S,Chen T,Zhong Z,et al.microRNA-155 silencing inhibits proliferation and migration and induces apoptosis by upregulating BACH1 in renal cancer cells.Mol Med Rep,2012,5(4):949-954.
31 Saikumar J,Hoffmann D,Kim TM,et al.Expression,circulation,and excretion profile of microRNA-21,-155,and-18a following acute kidney injury.Toxicol Sci,2012,129(2):256-267.
32 Zhang LY,Liu M,Li X,et al.miRNA-490-3p modulates cell growth and epithelial to mesenchymal transition of hepatocellular carcinoma cells by targeting endoplasmic reticulum-Golgi intermediate compartment protein 3(ERGIC3).J Biol Chem,2013,288(6):4035-4047.
