重型神经精神性狼疮患者的临床表现及影像学改变
2013-04-26谢红浪,胡伟新,桂兰兰等
系统性红斑狼疮(SLE)是一种多系统受累的自身免疫性疾病,累及神经精神系统时称为神经精神性狼疮(NPSLE)。NPSLE临床表现多样,轻者认知障碍、焦虑、记忆力下降,重者可见脑卒中、癫痫大发作等。1999年,美国风湿病学会(ACR)定义的NPSLE包括12项中枢神经系统症状和7项外周神经症状,并可分为局部定位症状和弥漫性症状[1]。
重型NPSLE通常指SLE相关的神经系统局部定位性病变及癫痫发作等严重事件[2],往往与疾病复发、发病率和死亡率增高相关[3]。本文回顾性分析了51例重型NPSLE患者临床表现、头颅MRI改变及其近期预后,以期为此类患者的临床诊治提供帮助。
对象和方法
研究对象选取2006年12月至2013年4月间南京军区南京总医院全军肾脏病研究所的住院患者62例,均满足1997年ACR修改的SLE诊断标准[4]及1999年ACR特别委员会有关NPSLE的命名和定义[1],且均伴肾脏损害。重型NPSLE的诊断参照Bortoluzzi等[5]的定义,包括与SLE相关的局灶神经系统定位症状(包括癫痫发作、精神病、横贯性脊髓炎、情绪紊乱及认知障碍等),包括难治和反复发作者,排除由于药物、高血压、低氧血症、尿毒症、电解质紊乱及感染等因素所导致的神经精神症状。
研究方法回顾性分析患者的临床和实验室检查资料。收集患者性别、年龄、病程,血压、肾活检病理类型、神经精神症状,急性生理和慢性健康评分(APACHE Ⅱ)、系统性红斑狼疮活动性指数(SLE-DAI)、血常规、血生化、自身抗体[包括抗核抗体(ANA)、抗双链DNA(ds-DNA)、抗心磷脂抗体、狼疮样抗凝物质、抗C1q抗体]、补体、内皮细胞功能检查包括循环内皮细胞(CECs)计数、凝血酶调节蛋白活性、可溶性血栓调节蛋白(sTM)、血管细胞黏附分子1(VCAM-1)、血浆血管性假血友病因子(vWF)、血清E选择素(ES)等。同时收集头颅MRI和脑脊液检查结果,治疗前评估SLE-DAI[6],分析治疗方法及近期预后等。62例患者中11例因资料不完整被排除,余51例纳入本研究。
实验室检查方法生化指标血清白蛋白、血清肌酐(SCr)、尿素氮(BUN),采用日立7180自动生化分析仪检测。CECs采用免疫磁珠法测定;vWF、sTM、VCAM-1、ES均采用酶联免疫吸附法(ELISA)检测。其中vWF试剂盒购自上海太阳生物科技有限公司,sTM、VCAM-1、ES试剂盒购自法国DIACLONE公司,具体方法严格按说明书进行。检测数值超过正常对照组均值2倍标准差(mean+2SD)定义为阳性。
相关定义高血压定义为收缩压>140 mmHg和(或)舒张压>90 mmHg;肾病综合征蛋白尿定义为尿蛋白定量>3.5 g/d;肉眼血尿定义为尿沉渣红细胞计数>1 000万/ml。低补体C3血症指血清补体C3≤0.6 g/L,低补体C4血症指血清补体C4≤0.1 g/L。
统计学方法采用SPSS 13.0软件进行统计分析,正态分布计量资料以均数±标准差表示,组间比较采用t检验;非正态分布计量资料中位数(范围)表示,组间比较采用秩和检验。计数资料采用百分比表示,组间比较采用卡方检验,P<0.05为差异有统计学意义。
结 果
一般情况本组51例患者中,男性9例,女性 42例,脑病发作时平均年龄26.3±9.7岁(15~64岁)。出现脑病时SLE的中位病程为36月(0.3~132月),其中10例(19.6%)为初发初治的病例。脑病发作时APACHE Ⅱ评分为15.9±6.1分(5~28分),SLE-DAI为20.3±7.0分(8~36分)。29例(56.9%)患者伴高血压,10例(19.6%)伴有发热。
NPSLE的临床表现51例患者共发生101例次神经精神事件,出现ACR定义的19项神经精神综合征中的12项(表1),中枢神经系统事件92例次(91.1%),周围神经系统事件9例次(8.9%),2例(3.9%)患者中枢神经和外周神经系统事件并存。最常见的症状分别为癫痫发作、顽固性头痛、急性精神错乱和脑血管病(表1)。

表1 神经精神性狼疮患者的临床表现*
MRI及其他辅助检查结果1例女性患者突发脑干梗塞征象,出现呼吸、心跳异常,病情危重,未行MRI检查。余50例行头颅MRI检查的患者中5例(10%)未见异常影像,最常见的影像改变为多发异常信号、脑梗塞和皮质梗塞(表2),12例(24%)患者存在两种以上类型的影像改变。行脊髓MRI检查的7例患者中,5例可见异常信号,2例未见异常。
11例患者行脑电图均有异常。8例患者行脑脊液检查均无感染征象,其中4例脑脊液正常,4例潘氏实验弱阳性,蛋白含量520~900 mg/L(正常值150~450 mg/L)。
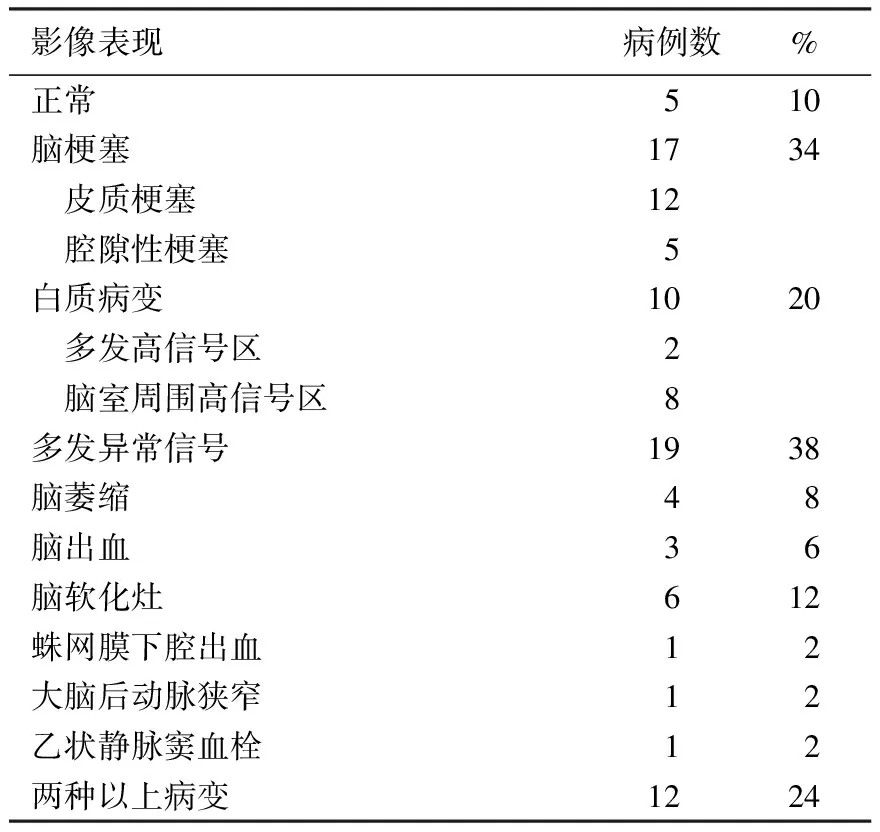
表2 本组患者头颅MRI改变(n=50)
肾脏损害本组重型NPSLE患者均有肾脏损害,表现为慢性肾炎综合征16例,急进性肾炎综合征14例,慢性肾功能衰竭9例,急性肾炎综合征和肾病综合征各6例。19例患者合并急性肾损伤。尿蛋白定量中位数为2.65 g/d(0.21~10.05 g/d),尿沉渣红细胞计数<100万/ml者29例,>1 000万/ml(即肉眼血尿)者15例。SCr 212.2±176.8 μmol/L(40.7~832.7 μmol/L),BUN 14.3±8.1 mmol/L(4.3~33.7 mmol/L)。
共有25例患者行肾活检,其病理类型分别为:Ⅳ型10例,Ⅳ+Ⅴ型6例,Ⅴ+Ⅲ型5例,Ⅴ型3例,Ⅲ型1例,其中5例患者合并血栓性微血管病变(TMA)。
血液系统损害51例患者中48例(94.1%)存在贫血,血红蛋白86.4±19.5 g/L (42~110 g/L)。25例患者血小板计数≤100×109/L,9例患者≤50×109/L,平均血小板计数为(120±81)×109/L。白细胞计数≤4×109/L者9例,平均为8.0±4.6×109/L。
免疫学异常和内皮细胞功能损伤本组患者均存在明显的免疫学异常,其中ANA、抗ds-DNA和抗C1q抗体的阳性率分别为94.1%、54.9%和65.8%,抗心磷脂抗体和狼疮样抗凝物质的阳性率分别为42.6%和31.8%(表3)。30例(61.2%)和17例(34.7%)患者存在低补体C3和低补体C4血症。同时本组患者内皮细胞功能异常突出,VACM-1的阳性率高达90.9%,循环内皮细胞阳性率为69.7%。

表3 51例患者免疫学检查及内皮细胞功能指标

图1 1例死亡患者的头颅影像学特点
治疗、预后及影响预后因素分析所有患者入院明确诊断后,在常规足量激素[泼尼松0.75~1 mg/(kg·d)]治疗的基础上,32例(62.7%)予甲泼尼龙冲击治疗,16例(31.4%)患者予静脉丙球治疗,8例(15.6%)予双重血浆滤过治疗(表4),住院期间其他药物治疗包括环磷酰胺、低分子肝素、抗血小板、抗癫痫、抗精神病及镇静等。26例(50.9%)予连续性肾脏替代治疗,调整电解质和内环境稳定,保持容量平衡,清除尿毒症毒素。4例患者行气管插管辅助机械通气治疗。
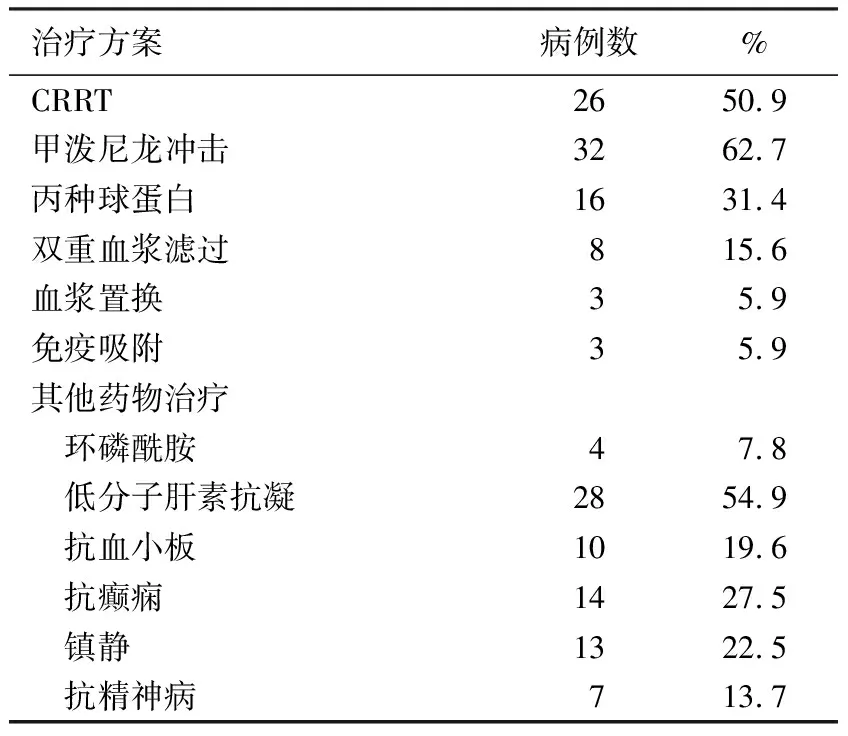
表4 51例患者住院期间的治疗方案
经治疗46例(90.2%)患者病情好转出院,3例(5.9%)患者因病情较重、药物治疗症状改善不明显放弃治疗。2例(3.9%)患者死亡,1例临床诊断为脑干梗塞,另一例头颅MRI及CT检查见左颞顶叶皮层及皮层下出血性脑梗塞(图1),后出现脑出血破入脑室、脑疝形成。
治疗效果不佳的患者SLE-DAI显著高于缓解组(28.2±6.0vs19.6±6.7,P=0.009),外周血CECs计数更高(47.8±19.8个/mlvs28.5±14.4个/ml,P=0.014);抗C1q抗体均阳性(100%vs60.6%,P>0.05)。两组高血压比例、血常规、血生化、肾功能、尿蛋白定量及肉眼血尿的比例均无显著差异。
讨 论
NPSLE可累及中枢神经、外周神经及自主神经系统,导致既有神经症状,也有精神症状的系列临床表现,根据病变范围和特点分为弥漫性症状(如头痛、认知障碍、精神病、抑郁等)和局部定位症状(如脑卒中、舞蹈病、横贯性脊髓炎等)[7]。诊断NPSLE必需除外疾病本身的并发症(如高血压、电解质紊乱、尿毒症)、治疗相关的并发症(如感染、激素的神经系统反应)及非SLE因素(如脑血管畸形)导致的神经精神症状[8]。根据ACR诊断标准,各家文献报道的NPSLE发生率变异度较大,从12%~91%不等[5],可能与研究类型(前瞻或回顾)、研究对象、病程、疾病活动程度及随访时间等不同有关。Unterman等[9]对17个研究的Meta分析共入选5 057例SLE患者,其中1 439例共出现 2 709 项神经精神事件,估计的NPSLE发生率为56.3% (42.5%~74.7%),头痛[28.3%(18.2%~44.1%)]、情绪改变[20.7%(11.5%~37.4%)]及认知障碍[19.7%(10.7%~36%)]等弥漫性神经精神症状的发生率最高,其次为癫痫9.9%(4.8%~20.5%)和脑血管病8%(4.5%~14.3%)。
本研究观察了重型NPSLE患者的临床特征和影像学表现发现,常见的临床表现依次为癫痫发作(43.1%)、顽固性头痛(33.3%)、急性精神错乱(33.3%)和脑血管病(21.6%);最常见的头颅MRI改变为多发异常信号(38%)、脑梗塞(34%)和白质病变(20%),约10%患者头颅MRI未见异常征象,24%患者患者存在两种以上类型的影像改变。该组患者SLE活动明显,SLE-DAI为20.3±7.0,58.8%患者SLE-DAI≥20,存在明显的免疫学异常和内皮细胞损伤。临床表现与头颅MRI病变之间并无明确固定的联系,但累及重要部分(如脑干)及脑出血量较多的患者预后不佳。除循环内皮细胞计数外,其他血清学检查结果也不能预测颅内病变性质和预后。
既往研究发现,NPSLE的发病机制与血管病变[10]、细胞因子、趋化因子[11]及一些自身抗体有关,如抗核糖体P蛋白、抗神经元抗体及抗磷脂抗体等。Govoni等[12]报道,NPSLE患者狼疮样抗凝物质和抗心磷脂抗体的阳性率分别39.3%和54.9%,显著高于无神经精神事件的SLE患者分别为20.8%和37.7%(P均<0.000 1)。本研究中这两种抗体的阳性率分别为31.8%和42.6%,总阳性率为54.2%(26/48)。另有研究报道,NPSLE患者抗β2糖蛋白I抗体阳性率高于无神经精神症状者[13],遗憾的是本文中仅少数患者检测了该抗体。抗磷脂抗体可上调内皮细胞黏附分子的表达,如细胞间黏附分子1(ICAM-1)、VCAM-1及ES等,介导炎症反应和血栓栓塞事件[14]。磁化传递成像(MTI)是一种定量的MRI检查技术,可敏感地反映头颅的细微变化,Steens等[15]研究证实抗心磷脂抗体与头颅弥漫弥小病变之间显著相关。但目前并未证实抗心磷脂抗体与NPSLE的认知障碍明确相关[16]。
本研究的结果也支持内皮细胞损伤参与了NPSLE的发生机制。CECs可反映内皮细胞损伤和功能异常,是SLE相关内皮细胞损伤的标志物。Elshal等[17]发现,与健康对照相比,SLE患者CECs显著升高,并且与SLE-DAI 、血沉和抗ds-DNA抗体滴度相关,在合并中枢神经系统、肾脏受累及皮肤血管炎的患者升高更为明显。血液循环中活化的补体、膜攻击复合物及白细胞介素1(IL-1)等因素参与了内皮细胞组织因子活性上调,导致凝血因子活化,是引起血管损伤的重要病理生理机制[18]。内皮细胞与循环中的IL-1,肿瘤坏死因子或C3a结合可导致多种黏附分子表达,而与免疫复合物沉积无关。糖皮质激素可下调培养的人脐静脉内皮细胞ES和ICAM-1的表达,从而佐证了激素对急性SLE的疗效[19]。
NPSLE的治疗临床突出的难题,几乎都是经验性治疗,缺少随机对照临床研究结果的支持。2011年欧洲风湿病防治联盟(EULAR)对1 000余篇文献进行了系统回顾,并参考专家的观点,推荐根据患者的临床表现或神经精神症状进行治疗,其主要处理原则类同“非狼疮”患者。首先要排除其他继发原因导致的神经精神病变,在治疗过程中严密监测疾病的严重程度、活动程度及临床表现等,根据潜在发病机制施治,区分炎症性病变和血栓性病变,可分别予个体化的免疫抑制/抗炎治疗、抗血小板聚集/抗凝治疗,并强调对症治疗和支持治疗的重要性[20]。存在心脑血管病变和抗心磷脂抗体的患者应予抗血小板/抗凝治疗[21]。疑有炎症或神经毒性病变过程者,尤其是SLE高度活动时,宜用大剂量的激素或联合使用其他免疫抑制剂(如环磷酰胺、硫唑嘌呤等)[22]。在药物治疗过程中,应当密切监测药物的不良反应,如激素治疗本身(尤其是大剂量、长疗程)即可引起精神症状。上述药物治疗效果不佳时,可行血浆置换、大剂量丙种球蛋白冲击和利妥昔单抗治疗,但目前均缺乏随机、对照的临床研究证实其疗效[23]。
本组重型NPSLE患者临床表现复杂多样,头颅MRI检查可见多种类型异常病变,SLE-DAI评分高,免疫及内皮损伤指标明显异常。治疗效果不佳的患者CECs计数高,颅内病变严重者预后不佳。
1 ACR Ad Hoc Committee on Neuropsychiatric Lupus Nomenclature.The American College of Rheumatology nomenclature and case definitions for neuropsychiatric lupus syndromes.Arthritis Rheum,1999,42(4):599-608.
2 McCune WJ,Golbus J,Zeldes W,et al.Clinical and immunologic effects of monthly administration of intravenous cyclophosphamide in severe systemic lupus erythematosus.N Eng J Med,1988,318(22):1423-1431.
3 Hanly JG,Urowitz MB,Sanchez-Guerrero J,et al; Systemic Lupus International Collaborating Clinics.Neuropsychiatric events at the time of diagnosis of systemic lupus erythematosus:an international inception cohort study.Arthritis Rheum,2007,56(1):265-273.
4 Hochberg MC.Updating the American College of Rheumatology revised criteria for the classification of systemic lupus erythematosus.Arthritis Rheum,1997,40(9):1725.
5 Bortoluzzi A,Padovan M,Farina I,et al.Therapeutic strategies in severe neuropsychiatric systemic lupus erythematosus:experience from a tertiary referral centre.Reumatismo,2012,64 (6):350-359.
6 Bombardier C,Gladman DD,Urowitz MB,et al.Derivation of the SLEDAI.A disease activity index for lupus patients.The Committee on Prognosis Studies in SLE.Arthritis Rheum,1992,35(6):630-640.
7 Luyendijk J,Steens SC,Ouwendijk WJ,et al.Neuropsychiatric systemic lupus erythematosus:lessons learned from magnetic resonance imaging.Arthritis Rheum,2011,63(3):722-732.
8 Hanly JG.The neuropsychiatric SLE SLICC inception cohort study.Lupus,2008,17(12):1059-1063.
9 Unterman A,Nolte JE,Boaz M,et al.Neuropsychiatric syndromes in systemic lupus erythematosus:a meta-analysis.Sem Arthr.Rheum,2011,41(1):1-11.
10 Jennekens FG,Kater L.The central nervous system in systemic lupus erythematosus.Part 2.Pathogenetic mechanisms of clinical syndromes:a literature investigation.Rheumatology (Oxford),2002,41(6):619-630.
11 Efthimiou P,Blanco M.Pathogenesis of neuropsychiatric systemic lupus erythematosus and potential biomarkers.Mod Rheumatol,2009,19(5):457-468.
12 Govoni M,Bombardieri S,Bortoluzzi A,et al.Factors and comorbidities associated with first neuropsychiatric event in systemic lupus erythematosus:does a risk profile exist? A large multicentre retrospective cross-sectional study on 959 Italian patients.Rheumatology (Oxford),2012,51(1):157-168.
13 Avcin T,Benseler SM,Tyrrell PN,et al.A followup study of antiphospholipid antibodies and associated neuropsychiatric manifestations in 137 children with systemic lupus erythematosus.Arthritis Rheum,2008,59(2):206-213.
14 Zaccagni H,Fried J,Cornell J,et al.Soluble adhesion molecule levels,neuropsychiatric lupus and lupus-related damage.Front Biosci,2004,9:1654-1659.
15 Steens SC,Bosma GP,Steup-Beekman GM,et al.Association between microscopic brain damage as indicated by magnetization transfer imaging and anticardiolipin antibodies in neuropsychiatric lupus.Arthritis Res Ther,2006,8(2):R38.
16 Menon S,Jameson-Shortall E,Newman SP,et al.A longitudinal study of anticardiolipin antibody levels and cognitive functioning in systemic lupus erythematosus.Arthritis Rheum,1999,42(4):735-741.
17 Elshal M,Abdelaziz A,Abbas A,et al.Quantification of circulating endothelial cells in peripheral blood of systemic lupus erythematosus patients:a simple and reproducible method of assessing endothelial injury and repair.Nephrol Dial Transplant,2009,24(5):1495-1499.
18 Saadi S,Holzknecht RA,Patte CP,et al.Complement-mediated regulation of tissue factor activity in endothelium.J Exp Med,1995,182(6):1807-1814.
19 Cronstein BN,Kimmel SC,Levin RI,et al.A mechanism for the antiinflammatory effects of corticosteroids:the glucocorticoid receptor regulates leukocyte adhesion to endothelial cells and expression of endothelial-leukocyte adhesion molecule 1 and intercellular adhesion molecule 1.Proc Natl Acad Sci U S A,1992,89(21):9991-9995.
20 Bertsias G,Ioannidis JP,Boletis J,et al.EULAR recommendations for the management of systemic lupus erythematosus.Report of a Task Force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics.Ann Rheum Dis,2008,67(2):195-205.
21 Ruiz-Irastorza G,Hunt BJ,Khamashta MA.A systematic review of secondary thromboprophylaxis in patients with antiphospholipid antibodies.Arthritis Rheum,2007,57(8):1487-1495.
22 Barile-Fabris L,Ariza-Andraca R,Olguín-Ortega L,et al.Controlled clinical trial of IV cyclophosphamide versus IV methylprednisolone in severe neurological manifestations in systemic lupus erythematosus.Ann Rheum Dis,2005,64(4):620-625.
23 Bertsias GK,Boumpas DT.Pathogenesis,diagnosis and management of neuropsychiatric SLE manifestations.Nat Rev Rheumatol,2010,6(6):358-367.
