维持性血液透析患者血清25-羟维生素D与心脏结构及功能的关系
2013-04-26武晓春,叶红,闻萍等
维持性血液透析(MHD)是终末期肾病(ESRD)患者替代治疗方法之一。肾脏疾病导致的1α羟化酶缺乏,使患者存在不同程度的维生素D缺乏并加剧其钙磷代谢紊乱和肾性骨病[1],同时能引起血管和软组织钙化[2,3];临床发现此类患者普遍存在心脏瓣膜钙化(CVC)、血管壁钙化等现象。因此,心血管疾病(CVD)[包括左心室肥厚(LVH)、心脏瓣膜病(VHD)及充血性心力衰竭(CHF)等]已成为ESRD患者最主要的共患疾病和死亡病因[4-6]。
近年来,各国学者不乏对肾脏疾病患者体内维生素D水平与CVD关系的研究,我们也分析了MHD患者血清25-羟维生素D[25(OH)D]水平和经心脏彩超诊断的LVH、CVC、左心室收缩舒张功能的关系。
资料和方法
研究对象横断面调查126例在南京医科大学第二附属医院肾脏病医学中心行MHD治疗≥3月的ESRD患者,其中男性73例,女性53例,平均年龄58±13岁(27~87岁),基础肾脏疾病包括慢性肾小球肾炎53例,高血压肾损害29例,糖尿病肾病17例,多囊肾7例,慢性肾盂肾炎3例,17例病因不明,排除存在急性心肌梗死、肥厚型心肌病、扩张型心肌病、心肌淀粉样变性、恶性肿瘤及合并严重感染的患者。
HD方案本组患者均为MHD 3次/周、4h/次,平均透析龄67±62月(3~306月),使用东丽TR8000 HD机和东丽TS1.3S透析器,超滤系数44 ml/(h·mmHg),透析液流量500 ml/min。
研究方法记录患者的性别、年龄、体重、身高、血压、吸烟史、基础肾脏疾病及HD时间(透析龄)、3次/周透析的总脱水量。记录用药情况,包括血管紧张素转换酶抑制剂(ACEI)、血管紧张素Ⅱ受体拮抗剂(ARB)、β受体阻滞剂、碳酸钙和活性维生素D制剂(骨化三醇和阿法骨化醇),降压治疗的靶目标为血压≤140/90 mmHg,根据血压情况和检验指标调整上述药物剂量。推荐患者热量摄入为30~35 kcal/(kg·d),蛋白质摄入量1.0~1.2 g/(kg·d),氯化钠约6 g/d,推荐患者透析间期体重增长为干体重的3~5%。
观察指标观察并记录患者血常规、血清钙磷、血清全段甲状旁腺激素、血清25(OH)D等检查结果。在患者透析后当日下午或次日上午行经胸壁多普勒心脏彩超检查,以观察心脏结构功能的变化。
统计方法采用SPSS 15.0软件进行统计分析。计量资料以mean±SD表示,两组比较采用独立样本t检验,多组比较采用单因素方差分析(one-way ANOVA),其中两两比较采用LSD法,计数资料以率(%)表示,比较采用卡方检验或校正的卡方检验(χ2test),相关分析采用两变量直线相关分析,相关系数为Pearson r(r),P<0.05为差异有统计学意义。
结 果
一般情况126例MHD患者中男性73例(57.94%),女性53例(42.06%),男性平均年龄低于女性(P=0.016),然透析脱水量则高于女性(P=0.031),血红蛋白水平高于女性(P=0.026),其余各项检查结果均无统计学意义(表1)。
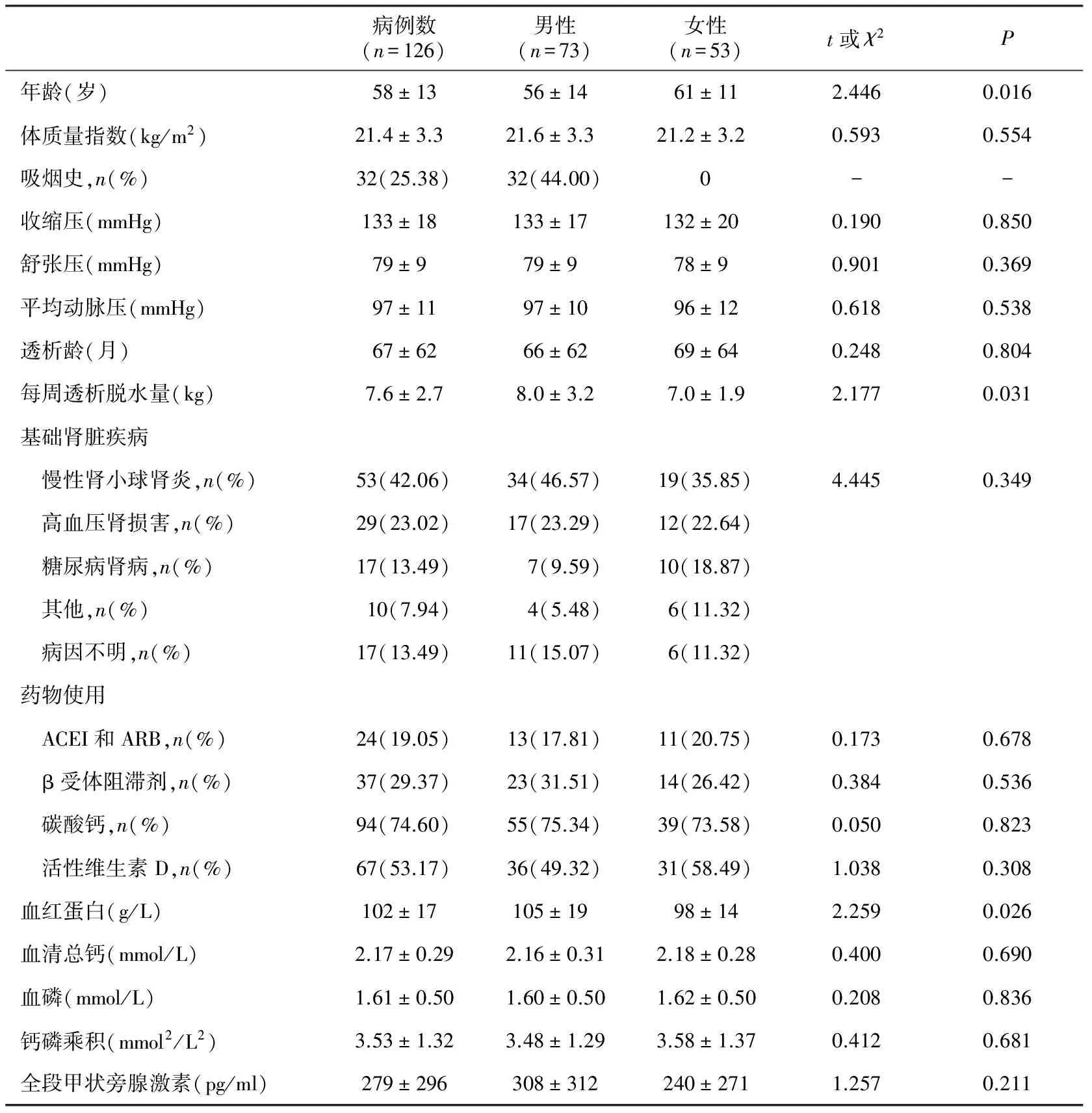
表1 126例维持性血液透析患者临床资料
血清25(OH)D分布状况126例MHD患者25(OH)D符合正态分布,平均40.3±19.8 nmol/L(10.6~122.1 nmol/L),男、女分别为42.9±20.2 nmol/L、36.7±18.8 nmol/L(t=1.751,P=0.082)。血清25(OH)D<25 nmol/L为维生素D严重缺乏(26例,20.63%),≥25 nmol/L且<50 nmol/L为维生素D缺乏(67例,53.18%),≥50 nmol/L且<75 nmol/L为维生素D不足(25例,19.84%),≥75 nmol/L为维生素D充足(18例,6.35%),由此可见仅有约1/4(26.19%)的患者不存在维生素D缺乏。

图1 本组126例患者血清25(OH)D的分布
左心室质量(LVM)与左心室质量指数(LVMI)的分布情况按照美国超声心动图学会推荐的校正公式计算LVM和LVMI。
LVM(g)=0.8×1.04×[(IVSTd+LVIDd+IVPWTd)3-LVIDd3]+0.6;
LVMI(g/m2)=LVM(g)/体表面积(BSA)(m2)。
Zhang等[6]对Sagae进行了改进,使用线性模型对决策序列进行预测,从全局的角度对决策进行了考量,采用泛化的感知器算法对模型的参数进行训练,模型解码时,不再像Sagae使用确定性方式,而是引入BeamSearch策略,实验中讨论了Beam-size和训练数据集的大小对实验结果的影响,可惜的是此文只给出了在CTB上的实验结果。
计算BSA采用DuBois公式。
BSA(m2)=0.202 47×身高(m)0.725×体重(kg)0.425。
本研究126例MHD患者平均LVM为196±56g(图2),其中男性为207±59g,女性为181±50g(t=2.617,P=0.010),平均LVMI为119±33 g/m2(图2),其中男性为120±34 g/m2,女性为118±33 g/m2(t=0.296,P=0.768)。
按照美国与欧洲超声心动图学会的推荐,以LVMI男性≥125 g/m2和女性≥110 g/m2为诊断LVH的标准,本组126例患者中共56例(44.44%)被诊为LVH,其中73例男性患者中25例(34.25%),53例女性患者中31例(58.49%),女性高于男性(χ2=7.310,P=0.007)。
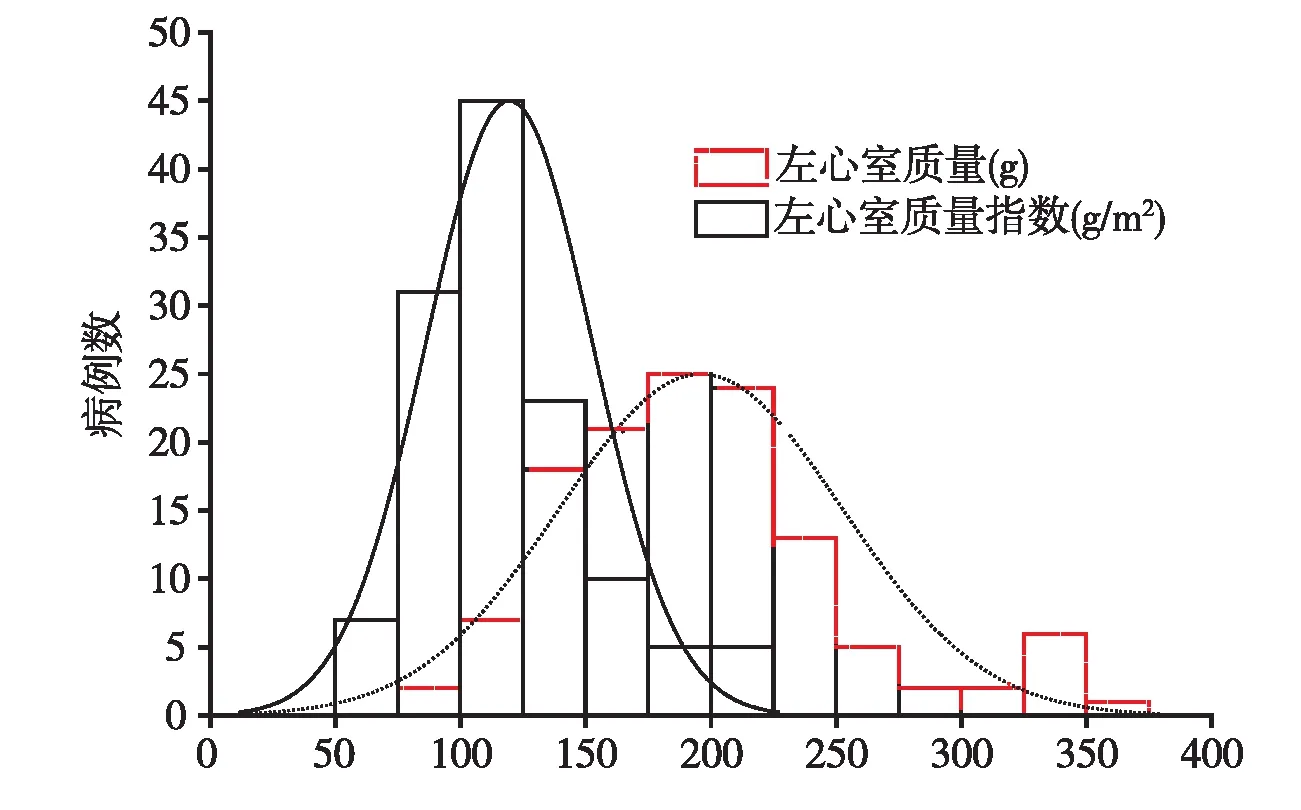
图2 本组126例患者左心室质量与左心室质量指数的分布
左心室质量指数和左心室肥厚在不同维生素D水平患者的分布情况按照患者维生素D严重缺乏、缺乏、不缺乏(包括维生素D不足和充足)分层,LVMI分别为121±41 g/m2(26例)、121±32 g/m2(67例)和116±29 g/m2(33例)(F=0.282,P=0.754,两两比较P均>0.05)。同样以维生素D水平分层,各组LVH的患者分别为10例(38.46%,男性4例,女性6例)、33例(49.25%,男性12例,女性21例)、13例(39.39%,男性9例,女性4例)(χ2=1.345,P=0.510)(图3)。
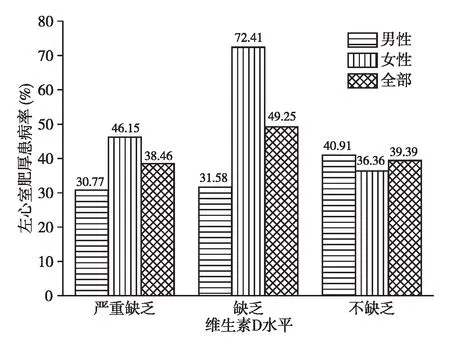
图3 本组患者维生素D水平与左心室肥厚的关系
MHD患者血清25(OH)D与左心室质量和左心室质量指数的相关分析进行两变量直线相关分析,血清25(OH)D与LVM之间r=-0.057、P=0.527,男性患者两变量r=-0.003、P=0.982,女性患者两变量r=-0.260、P=0.061,结果显示两变量之间无直线相关关系(图4)。25(OH)D与LVMI之间r=-0.084、P=0.348,男性患者两变量r=0.028、P=0.814,女性患者两变量r=-0.269、P=0.051,结果显示两变量之间无直线相关关系(图5)。
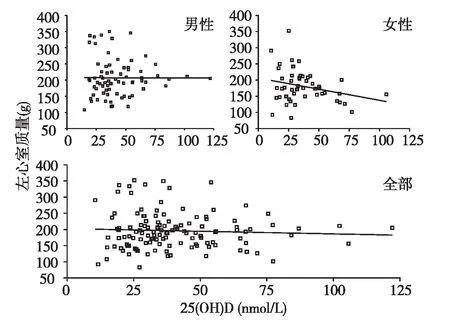
图4 本组患者血清25(OH)D与左心室质量的相关性
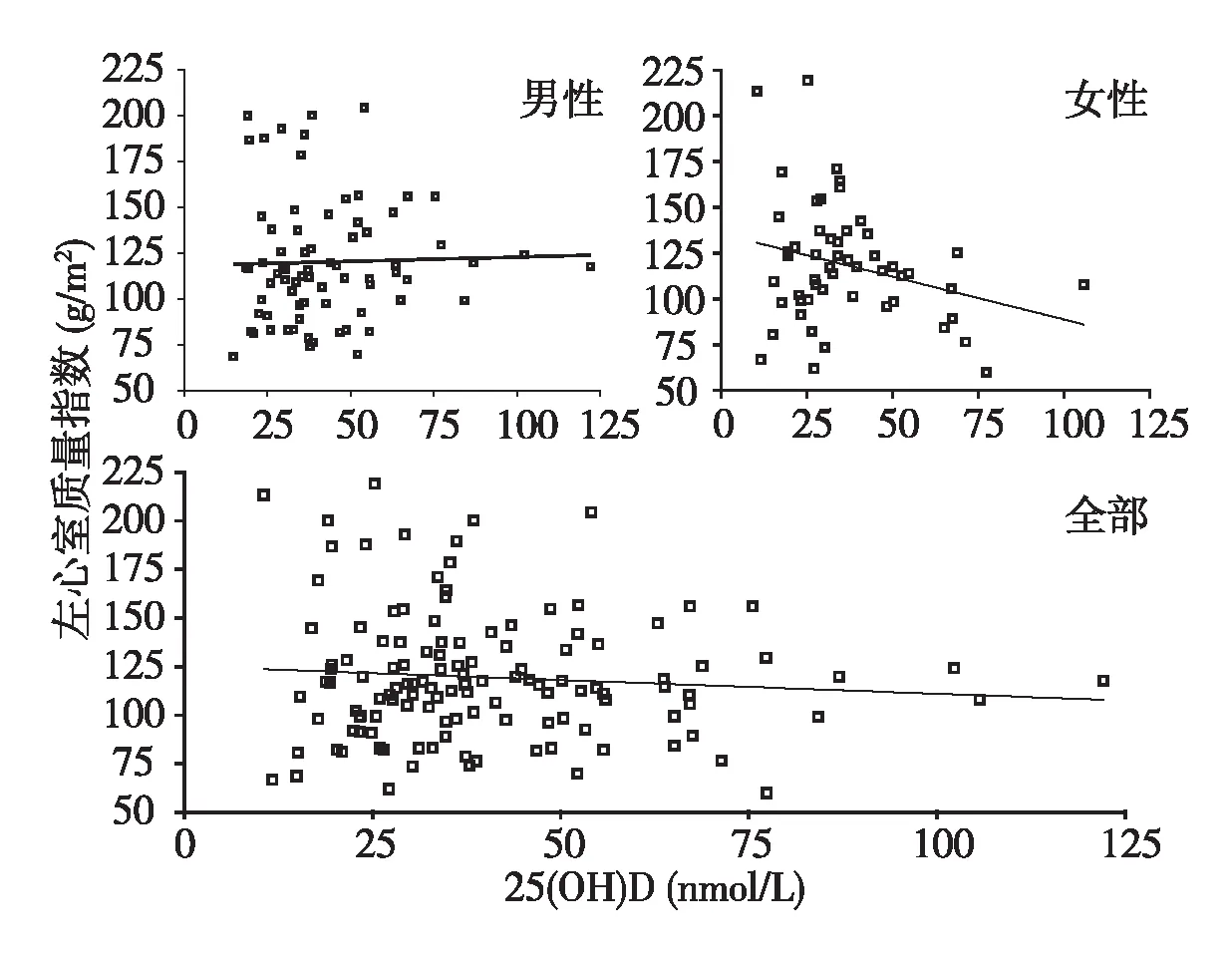
图5 本组患者血清25(OH)D与左心室质量指数的相关性
CVC及其与血清25(OH)D的相关分析本研究126例MHD患者经心脏彩超检查发现,55.56%(70例)的患者存在CVC,其中以主动脉瓣钙化最多,占46.03%(58例),二尖瓣瓣膜钙化占27.78%(35例),其中单瓣膜钙化47例(37.30%,男性30例、女性17例),主动脉瓣和二尖瓣瓣膜同时钙化(双瓣膜钙化)23例(18.25%,男性11例,女性12例),44.44%的患者(56例,男性32例,女性24例)未被发现CVC(图6)(χ2=1.649,P=0.438)。
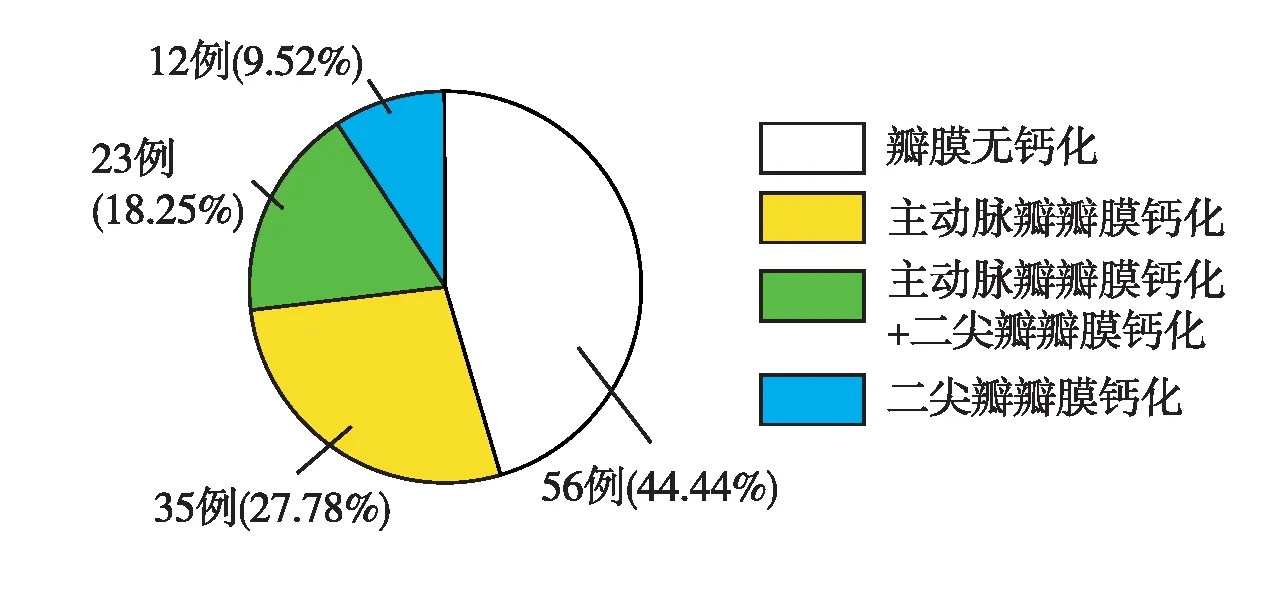
图6 本组患者心脏瓣膜钙化的分布
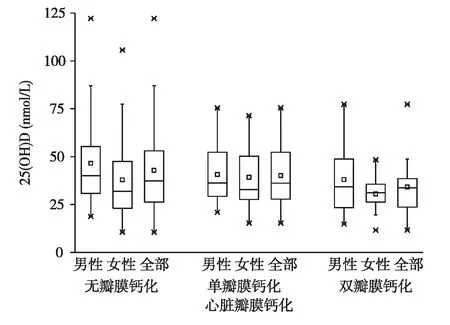
图7 按照心脏瓣膜钙化数量分层本组患者血清25(OH)D的分布
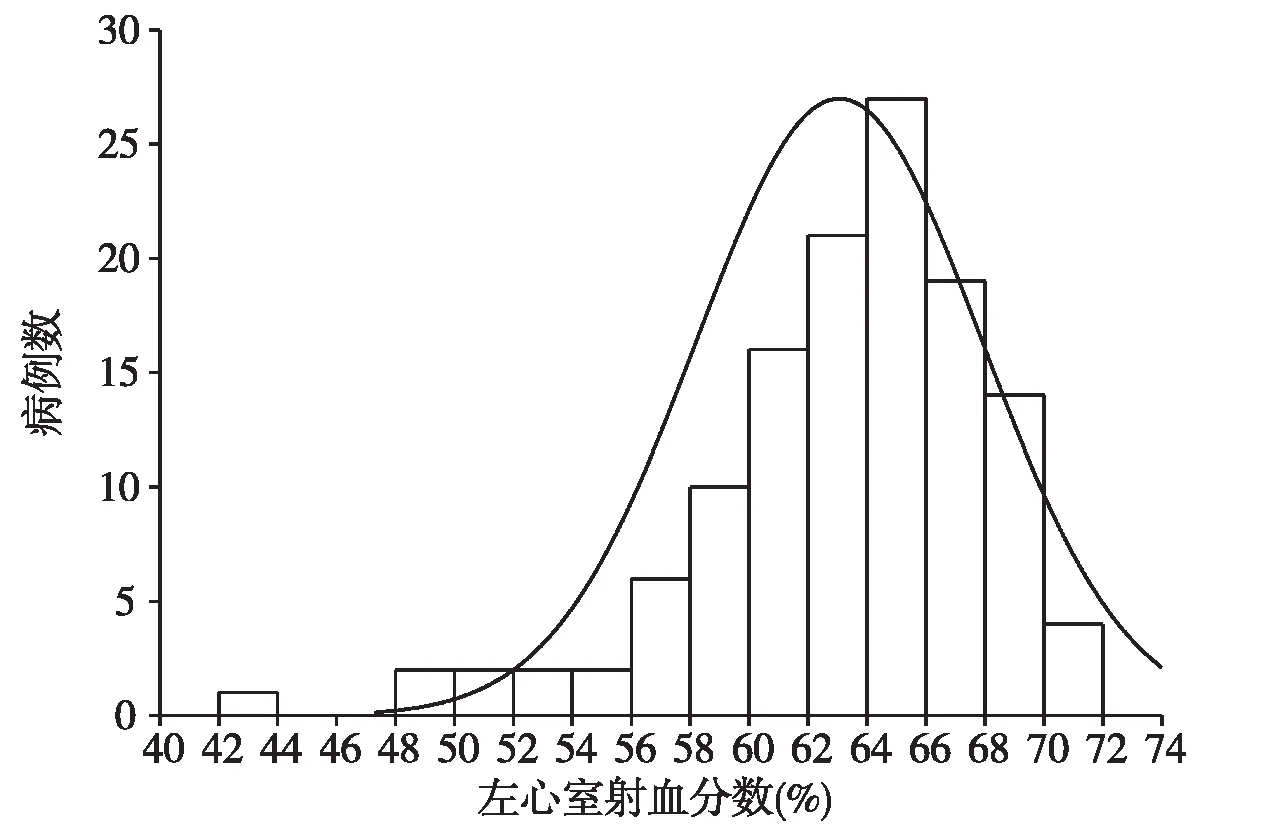
图8 本组患者左心室射血分数的分布
左心室收缩功能及其与血清25(OH)D的相关分析本研究126例MHD患者的左心室射血分数(LVEF)均值为63.1±4.8%(图8),仅3例(2.38%)符合美国与欧洲超声心动图学会推荐的以LVEF<50%作为左心室收缩性心力衰竭的标准。按照维生素D严重缺乏、缺乏和不缺乏分层,患者的LVEF为62.5%±6.4%、63.4%±4.3%、62.7%±4.5%(F=0.463,P=0.630,两两比较P均>0.05)。进行两变量直线相关分析,25(OH)D与LVEF之间r=-0.003、P=0.973,显示两变量之间无直线相关关系,其中男性患者两者之间r=-0.116、P=0.327,女性患者两者之间r=0.138、P=0.325,两变量之间的无直线相关关系(图9)。
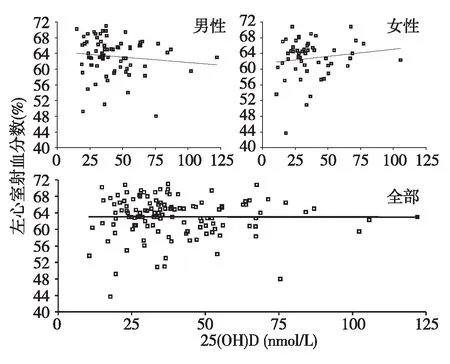
图9 本组患者血清25(OH)D与左心室射血分数的相关性
左心室舒张功能及其与血清25(OH)D的相关分析94例MHD患者经心脏彩超检查测定了二尖瓣血流舒张早期最大流速/二尖瓣血流心房收缩期最大流速(E/A)比,均值为0.83±0.25(图10),其中78例E/A<1、16例≥1,另外32例未测定具体数值,其中31例E/A<1、1例≥1,总计109例E/A<1、17例E/A≥1,按照美国与欧洲超声心动图学会的推荐,以E/A<1作为标准,左心室舒张功能不全患者占86.51%,其血清25(OH)D均值为38.9±19.9 nmol/L,余舒张功能正常者血清25(OH)D均值为48.9±17.0 nmol/L(图11)(t=1.950,P=0.053)。73例男性患者中61例E/A<1,25(OH)D均值为42.5±21.0 nmol/L,12例E/A≥1,25(OH)D均值为44.9±16.0 nmol/L(t=0.375,P=0.709);53例女性患者中48例E/A<1,25(OH)D均值为34.4±17.7 nmol/L,5例E/A≥1,25(OH)D均值为58.4±17.1 nmol/L(t=2.904,P=0.005)(图11)。

图11 按照E/A比分层本组患者血清25(OH)D的分布
血压及实验室检查指标与血清25(OH)D的相关分析进行两变量直线相关分析,血清25(OH)D与血压之间无直线相关关系(与收缩压r=-0.085、P=0.344,与舒张压r=0.082、P=0.363),与血红蛋白(r=-0.024、P=0.792)、钙(r=-0.109、P=0.224)、全段甲状旁腺激素(r=-0.113、P=0.209)之间均无直线相关关系,但是与血磷存在直线相关关系(r=-0.183、P=0.040),血磷越高,25(OH)D水平越低(图12)。

图12 本组患者血清25(OH)D与血压和实验室检查的相关性
讨 论
MHD是ESRD患者替代治疗方法之一,随着透析方法不断改进,透析充分性的问题已不再是影响患者生存的主要问题,因此,透析患者的生存时间和生活质量均不断提高[7]。
美国肾脏基金会(NKF)的KDOQI指南[1,4]明确指出,透析患者存在的包括透析充分性、贫血、营养、血管通路等几类主要问题,其中特别强调钙磷代谢紊乱/继发性甲状旁腺功能亢进和心血管疾病的关系,前者除造成骨骼本身的病变外,更大的危害在于造成软组织钙化、加重代谢紊乱(包括脂代谢紊乱、胰岛素抵抗等)、不利于纠正贫血等,甚至出现血管钙化,导致患者过早死亡,CVD则是透析患者最常见的共患疾病,是影响所有肾脏疾病患者生存的高危因素,无论在肾脏疾病的哪个阶段,CVD都是患者死亡的首要病因,尤其ESRD伴CVD的患者,其死亡率明显高于无肾脏疾病的患者。
KDIGO指南[2]将肾性骨病的概念扩展为慢性肾脏病-矿物质骨代谢紊乱(CKD-MBD),除需关注血钙磷、甲状旁腺激素外,进一步研究了循环中相关激素的水平和相互关系,如25(OH)D、1,25-二羟维生素D[1,25(OH)2D]、成纤维细胞生长因子23(FGF-23)等与肾脏病本身及CVD间的关系,进一步强调肾脏疾病患者可能因骨折、CVD等增加死亡率。
文献往往把25(OH)D作为反映机体是否缺乏维生素D的标志物之一,由此发现在肾脏疾病患者体内普遍缺乏维生素D。LaClair等[8]研究发现,体内25(OH)D缺乏或不足[25(OH)D<75 nmol/L]在非透析治疗的中重度慢性肾脏病患者中达70%~83%,该现象主要与低血钙及女性相关。Del Valle等[9]研究发现,76.1%的MHD患者存在25(OH)D缺乏或不足[25(OH)D<75 nmol/L],作者认为这与冬季、阳光照射不足和女性患者尤其缺乏25(OH)D。本研究证实MHD患者25(OH)D<75 nmol/L的比例高达93.65%,高于上述研究结果,且本组女性患者血清25(OH)D水平低于男性患者。
文献报道增加摄入维生素D制剂可改善25(OH)D水平。Al-Aly等[10]和Kooienga等[11]的研究发现,补充钙剂、维生素D制剂或两者同时补充,能够提高血清25(OH)D和降低甲状旁腺水平。另一项研究发现补充骨化三醇可降低非透析患者的死亡率,推测其机制与提高机体维生素D水平后,阻碍肾素基因启动子表达而减少肾素产生、降低系统血压、有益于心血管系统有关[12]。本研究中维生素D缺乏患者的比例明显高于国外研究,反映出在透析这一特殊人群中维生素D的缺乏更为显著,与严重的肾脏病变所致的1α羟化酶严重缺乏密切相关,还可能与活性维生素D类药物治疗比例低有关(仅53.17%)。因此合理使用活性维生素D类药物,可使患者获益。
文献不乏维生素D水平和CVD的关系的相关研究。Wolf等[13]对新进入HD的患者分析发现,维生素D缺乏与充足的患者相比,经过校正年龄、性别后,其因CVD而90d死亡的风险增加60%,90d全因死亡率增加30%~60%。London等[14]研究发现,体内维生素D的缺乏与动脉粥样硬化相关,主要表现为大动脉的钙化积分增加和顺应性降低。de Boer等[15]认为血清25(OH)D水平减低与冠脉钙化的风险呈正相关。
目前对透析患者CVC情况的报道较少。本研究发现55.56%的MHD患者存在主动脉瓣瓣膜钙化和(或)二尖瓣瓣膜钙化,其中以主动脉瓣瓣膜钙化最多,可能与左心室肥厚、心脏后负荷增加、瓣膜承受的机械压力大有关,近1/5的患者存在双瓣膜同时钙化。随着瓣膜钙化数量增多,25(OH)D存在降低趋势,双瓣膜钙化的患者25(OH)D水平明显降低,在小样本研究中与其他患者相比虽无统计学差异,但增加研究的样本量后,即可体现差异,提示提高血清维生素D水平可能改善患者组织或血管钙化程度。
LVH是肾脏疾病常见的CVD之一。常有学者研究其在肾脏疾病患者中的作用。Foley等[16]发现新进入透析的患者中,LVH与高血压、贫血相关,Zoccali等[17]研究表明透析患者LVMI的增加与CVD死亡事件密切相关,Mcmahon等[18]研究发现通过有效降低血压和控制容量负荷可降低患者死亡率。本研究发现,透析患者平均LVM为196±56g,平均LVMI为119±33 g/m2,高于非肾脏疾病患者,总的LVH患病率高达44.44%,其中女性高于男性(P=0.007)。虽然女性同时存在较高LVH患病率和低25(OH)D,尚需进一步研究证实其与25(OH)D是否存在直接联系。为减轻患者的LVH,除重视高血压、心肌缺血等传统危险因素外,更应该重视如贫血、尿毒症毒素、钙磷代谢紊乱、炎症反应及氧化应激等的影响[19]。
本研究发现,MHD患者左心室收缩功能不全的比例较低(2.38%),而左心室舒张功能不全的比例明显增高(86.51%),其原因可能与患者经充分透析后,减少心脏前后负荷,贫血、缺氧、酸中毒等内环境紊乱程度减轻,加上心肌代偿性肥厚,因此左心室收缩功能的多见正常,而舒张功能降低除反映LVH外,更重要的是反映了左心室顺应性降低,这与血清维生素D水平较低有一定关系[血清25(OH)D为38.9±19.9 nmol/L,舒张功能正常者为48.9±17.0 nmol/L,P=0.053,差异尚未达到统计学意义]。未来可以进一步观察增加维生素D的摄入能否够改善左心室舒张功能。
综上所述,本研究发现在MHD患者中存在较高比例的维生素D缺乏和不足,同时还存在一定程度的LVH和CVC,且两者间存在一定的联系,其中女性患者可同时出现低维生素D水平和高左心室肥厚。在MHD患者中还存在很高比例的左心室舒张功能不全,而收缩功能不全的比例较低,对于这类人群,合理使用活性维生素D类药物、提高体内维生素D的水平可能获得临床益处。本文属于横断面、非前瞻性的研究,回顾性分析病历资料,无严格对照,同时患者例数偏少,另外因检测方法和费用等问题,无法同时研究分析体内25(OH)D、1,25(OH)2D、FGF23等,因此存在一定缺陷,尚需更好的临床设计、观察和分析,在将来的研究中进一步证实MHD患者血清25(OH)D等激素水平与CVD的关系。
1 K/DOQI clinical practice guidelines for bone metabolism and disease in chronic kidney disease.Am J Kidney Dis,2003,42(4):S1-S201.
2 KDIGO clinical practice guidelines for the diagnosis,evaluation,prevention,and treatment of chronic kidney disease-mineral and bone disorder (CKD-MBD).Kidney Int Suppl,2009,76(113):S1-S130.
3 Goodman WG.The consequence of uncontrolled secondary hyperparathyroidism and its treatment in chronic kidney disease.Semin Dial,2004,17(3):209-216.
4 K/DOQI clinical practice guidelines for cardiovascular disease in dialysis patients.Am J Kidney Dis,2003,45(4):S1-S153.
5 Locatelli F,Marcelli D,Conte F,et al.Survival and development of cardiovascular disease by modality of treatment in patients with end-stage renal disease.J Am Soc Nephrol,2001,12(11):2411-2417.
6 Go AS,Chertow GM,Fan D,et al.Chronic kidney disease and risks of death,cardiovascular events,and hospitalization.N Engl J Med,2004,351(13):1296-1305.
7 2011 USRDS annual data report (volume two):Atlas of end-stage renal disease in the United States.http://www.usrds.org/2011/v2_esrd_full_11.zip.
8 LaClair RE,Hellman RN,Karp SL,et al.Prevalence of calcidiol deficiency in CKD: A cross-sectional study across latitudes in the United States.Am J Kidney Dis,2005,45(6):1026-1033.
9 Del Valle E,Negri AL,Aguirre C,et al.Prevalence of 25(OH) vitamin D insufficiency and deficiency in chronic kidney disease stage 5 patients on hemodialysis.Hemodial Int,2007,11(3):315-321.
10 Al-Aly Z,Qazi RA,Gonzalet EA,et al.Changes in serum 25-hydroxyvitamin D and plasma intact PTH levels following treatment with ergocalciferol in patients with CKD.Am J Kidney Dis,2007,50(1):59-68.
11 Kooienga L,Fried L,Scragg R,et al.The effect of combined calcium and vitamin D3 supplementation on serum intact parathyroid hormone in moderate CKD.Am J Kidney Dis,2009,53(3):408-416.
12 Shoben AB,Rudser KD,de Boer IH,et al.Association of oral calcitriol with improved survival in nondialysis CKD.J Am Soc Nephrol,2008,19(8):1613-1619.
13 Wolf M,Shah A,Gutierrez O,et al.Vitamin D levels and early mortality among incident hemodialysis patients.Kidney Int,2007,72(8):1004-1013.
14 London GM,Guerin AP,Verbeke FH,et al.Mineral metabolism and arterial functions in end stage renal disease: potential role of 25-hydroxyvitamin D deficiency.J Am Soc Nephrol,2007,18(2):613-620.
15 de Boer IH,Kestenbaum B,Shoben AB,et al.25-hydroxyvitamin D levels inversely associate with risk for developing coronary artery calcification.J Am Soc Nephrol,2009,20(8):1805-1812.
16 Foley RN,Curtis BM,Randell EW,et al.left ventricular hypertrophy in new hemodialysis patients without symptomatic cardiac disease.Clin J Am Soc Nephrol,2010,5(5):805-813.
17 Zoccali C,Benedetto FA,Mallamaci F,et al.Left ventricular mass monitoring in the follow-up of dialysis patients: prognostic value of left ventricular hypertrophy progression.Kidney Int,2004,65(4):1492-1498.
18 Mamahon LP,Roger SD,Levin A,et al.Development,prevention,and potential reversal of left ventricular hypertrophy in chronic kidney disease.J Am Soc Nephrol,2004,15(6):1640-1647.
19 Shik J,Parfrey PS.The clinical epidemiology of cardiovascular disease in chronic kidney disease.Curr Opin Nephrol Hypertens,2005,14:550-557.
