抗粘灵气雾剂中5种成分的提取工艺研究
2013-04-24田力田晓晔于鑫琛于洋张立群张霄华王静
田力,田晓晔,于鑫琛,于洋,张立群,张霄华,王静
(沈阳医学院临床教研室,辽宁 沈阳 110034)
抗粘灵气雾剂由白芨、黄芪、赤芍、当归等8味中药材组成,用于预防腹腔术后粘连,具有效果确切、方法简便易行,为临床外科领域术中抗粘连有效药物[1—6]。阿魏酸是当归的有效成分之一,有抑制胶原和ADP诱导的血小板聚集作用,对脑血管和白细胞减少症有较好疗效。2010年版药典Ⅰ部规定黄芪甲苷是黄芪的有效成分之一,有降压消炎、镇静镇痛,影响血清和肝脏蛋白质合成,影响血浆CAMP及再生肝DNA合成,促进NK细胞 (自然杀伤细胞)活性及抗肝损害等作用[7]。本文选取阿魏酸、黄芪甲苷为指标成分,通过正交试验设计,考察因素及水平,再进行数据分析,最后获得各因素的最优水平组合,为该方质量控制方法的建立和其深入研究开发提供参考[8-11]。
1 仪器与材料
Agilent1100高效液相色谱仪、Agilent 1100紫外检测器 (美国 Agilent公司);BS110型电子分析天平 (北京赛多利斯仪器系统有限公司);TG332A型微量分析天平 (上海仪器有限公司);HH-2数显恒温水浴锅 (金坛市新航仪器厂)。阿魏酸、黄芪甲苷对照品 (中国药品生物制品检定所)。
白芨 Bletilla striata(Thunb.)Reichb.f.的干燥块茎;黄芪 Astragalus membranaceus(Fisch.)Bunge的干燥根;赤芍Paeonia lactiflora Pall.的干燥根;当归Angelica sinensis(Oliv)Diels(A.polymorpha Maxim.var.siuensis Oliv.)的根;灯盏花Erigeron breviscapus(Vant.)Hand. - Mazz.的 干燥全草;大黄Rheum palmatum L.的干燥根及根茎。
2 方法与结果
2.1 提取溶剂的选择
2.1.1 供试品的制备 水提法:按处方比例取白芨、黄芪、赤芍、当归、灯盏花、大黄药材粉末适量,精密称定,加10倍量的水,水浴回流1.5 h,过滤,提取液置已干燥至恒重的蒸发皿中,水浴浓缩至稠膏状,用烘箱烘干,即得。
水提-醇沉法:操作方法同上,平行操作4份,自“过滤”起,加入适量乙醇至乙醇浓度分别为40%、55%、75%、85%、95%,4℃冷藏24 h,过滤,减压回收乙醇,浓缩至干,即得。
醇提法:按处方比例取白芨、黄芪、赤芍、当归、灯盏花、大黄药材粉末4份,精密称定,分别加10倍量的40%、55%、75%、85%、95%的乙醇,回流提取1.5 h,过滤,提取液置已干燥至恒重的蒸发皿中,水浴浓缩至稠膏状,用烘箱烘干,即得。
2.1.2 浸膏得率的测定 按“2.1.1”项下方法制备供试品,精密称定,计算浸膏得率。结果见表1。由表1可知,浸膏得率大小顺序为水提法>85%醇提法>75%醇沉法>55%醇提法>75%醇提法>40%醇提法>55%醇沉法>85%醇沉法>95%醇沉法>40%醇沉法>95%醇提法。
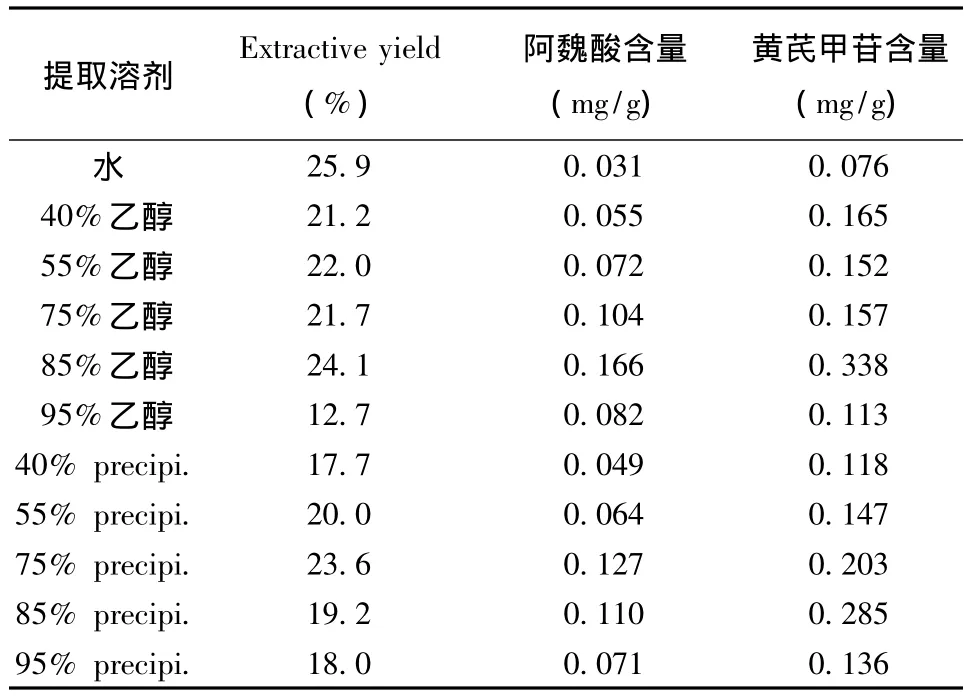
表1 不同提取溶剂的测定结果
2.2 指标成分的含量测定
2.2.1 当归中阿魏酸的HPLC测定
2.2.1.1 阿魏酸的提取分离 取当归药材粉末约1 g,精密称定,置50 m l量瓶中,加入甲醇-甲酸 (95∶5)30 ml,超声60 min,放置12 h,加入甲醇-甲酸 (95∶5)至刻度,取上清液经0.5μm滤膜滤过,弃去初滤液,取续滤液20μl做HPLC分析。
2.2.1.2 色谱条件 色谱柱:Kromasil C18(250 mm×4.6 mm,5μm);柱温:32℃;流动相:5%醋酸-甲醇 (80∶20);流速:1.0 ml/min;检测波长:320 nm;进样量:20μl。
2.2.1.3 色谱系统适用性试验 理论塔板数按阿魏酸色谱峰计算不低于8 000,各色谱峰与相邻峰之间分离度均大于1.5,阿魏酸色谱峰的拖尾因子为1.02。色谱图见图1。
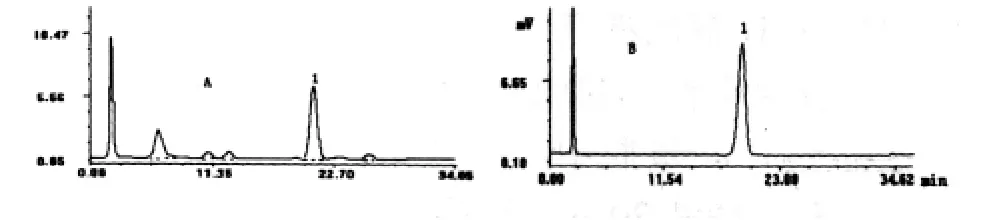
图1 当归提取物和阿魏酸对照品HPLC色谱图
2.2.1.4 线性 阿魏酸对照品储备液液的配制:精密称取阿魏酸对照品1.00 mg,置于10 ml量瓶中,用甲醇溶解并稀释至刻度,摇匀,备用。
标准曲线的绘制:精密吸取对照品储备液1.0、2.0、3.0、4.0、5.0 ml分别置 10 ml量瓶中,用甲醇加至刻度,摇匀,做HPLC分析。以阿魏酸的峰面积Y对浓度C作线性回归处理,结果表明阿魏酸对照品在该范围内线性良好。
2.2.1.5 精密度试验 取30.0μg/ml的阿魏酸对照品溶液作HPLC分析,重复进样5次,计算相对标准偏差,RSD为1.13%。
2.2.1.6 重复性 取样品5份,每份约2 g,精密称定,按“2.2.1.1”项下方法提取,按“2.2.1.2”项下方法进行HPLC分析,测定阿魏酸的含量,计算相对标准偏差,RSD为1.7%。
2.2.1.7 回收率试验 取已测阿魏酸含量的当归样品9份,每份约2 g,精密称定,精密加入阿魏酸对照品适量,按“2.2.1.1”项下提取,按“2.2.1.2”项下方法进行HPLC分析,测定阿魏酸的含量。加样回收率结果见表2。
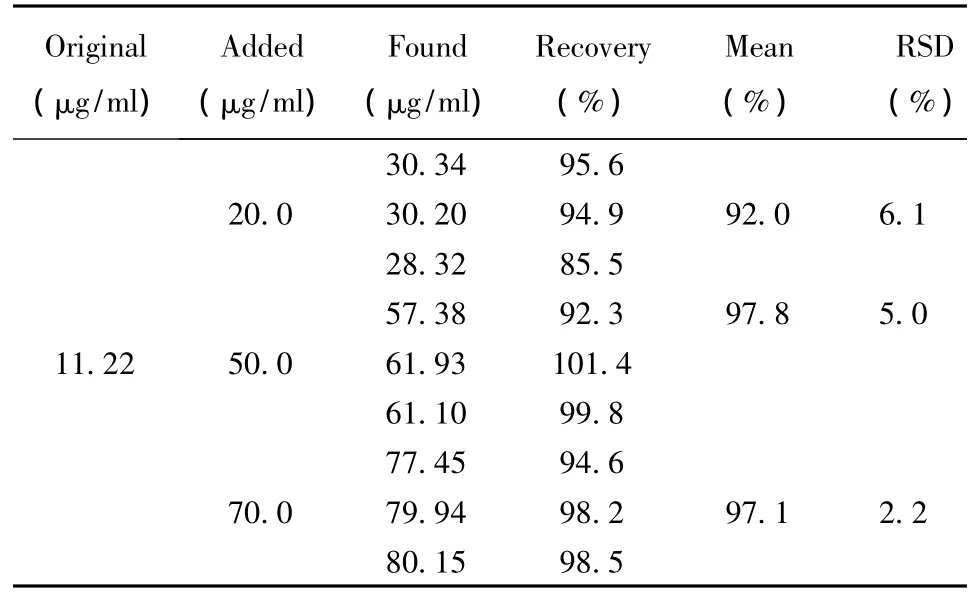
表2 阿魏酸测定回收率 (n=3)
2.2.1.8 样品的测定 将制备好的样品溶液在上述色谱条件下进行测定,结果见表3。
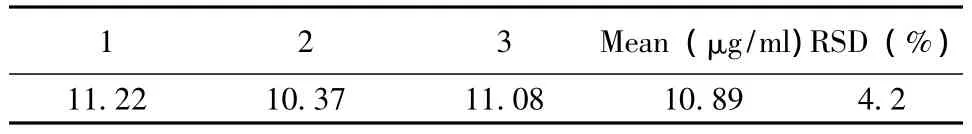
表3 当归中阿魏酸测定结果 (n=3)
2.2.2 黄芪中黄芪甲苷的HPLC测定
2.2.2.1 黄芪甲苷的提取分离 取黄芪样品粉末(40目)约2 g,精密称定,置索氏提取器中,加入甲醇100 ml,水浴提取3 h。回收甲醇,残渣用20 ml水饱和正丁醇溶解,并转入分液漏斗中。用1%的NaOH溶液洗涤 (5 ml×3次),再用正丁醇饱和水洗至中性,回收正丁醇,残渣用甲醇溶解,并定容于5 ml量瓶中。用微孔滤膜过滤,弃去初滤液,取续滤液20μl做HPLC分析。
2.2.2.2 色谱条件 色谱柱:Kromasil C18(250 mm×4.6 mm,5μm);流动相:乙腈-水 (30∶70,V/V);流量:1.0 ml/min;检测波长:203 nm;柱温:室温;进样量:20μl。
2.2.2.3 色谱系统适用性试验 理论塔板数按黄芪甲苷峰计算大于10 000,黄芪甲苷峰与相邻峰及内标峰之间分离度大于1.5,拖尾因子为1.01。色谱图见图2。
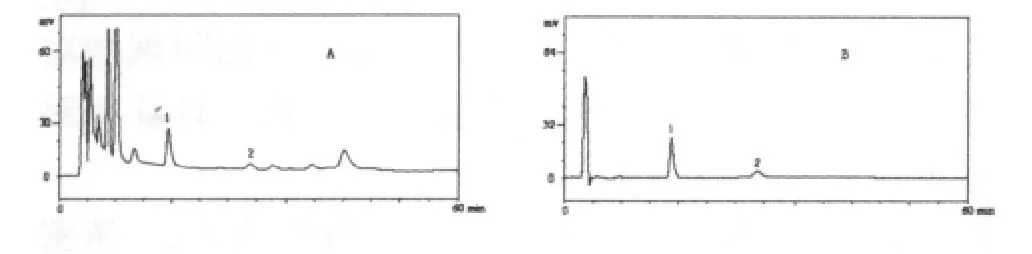
图2 黄芪提取物 (A)和黄芪甲苷对照品 (B)HPLC色谱图
2.2.2.4 线性 黄芪甲苷对照品储备液的配制:精密称取黄芪甲苷对照品10.04 mg,置于10 m l量瓶中,用甲醇溶解并稀释至刻度,摇匀,备用。
内标溶液的配制:精密称取卡马西平对照品2.21 mg,置于10 ml量瓶中,用甲醇溶解并稀释至刻度,摇匀,备用。
标准曲线的绘制:分别精密吸取黄芪甲苷对照品储备液0.1、0.2、0.4、0.6、0.8、1.0 m l分别置5 ml量瓶中,精密加入内标溶液0.25 ml,用甲醇加至刻度,摇匀,做HPLC分析。以黄芪甲苷与卡马西平峰面积比Y对浓度C作线性回归处理,结果表明黄芪甲苷对照品在该范围内线性良好。
2.2.2.5 精密度试验 取60.0μg/ml的黄芪甲苷对照品溶液作HPLC分析,重复进样5次,计算相对标准差,RSD为0.41%。
2.2.2.6 重复性 取黄芪样品5份,每份约2 g,精密称定,按“2.2.2.1”项下方法提取,按“2.2.2.2”项下方法进行HPLC分析,测定黄芪甲苷的含量,计算相对标准偏差,RSD为1.8%。
2.2.2.7 回收率试验 取已知黄芪甲苷含量的黄芪样品9份,每份约2g,精密称定,精密加入黄芪甲苷对照品溶液适量,按“2.2.2.1”项下提取后,按“2.2.2.2”项下方法进行HPLC分析,测定黄芪甲苷的含量。加样回收率见表4。
2.2.2.8 样品的测定 结果见表5。
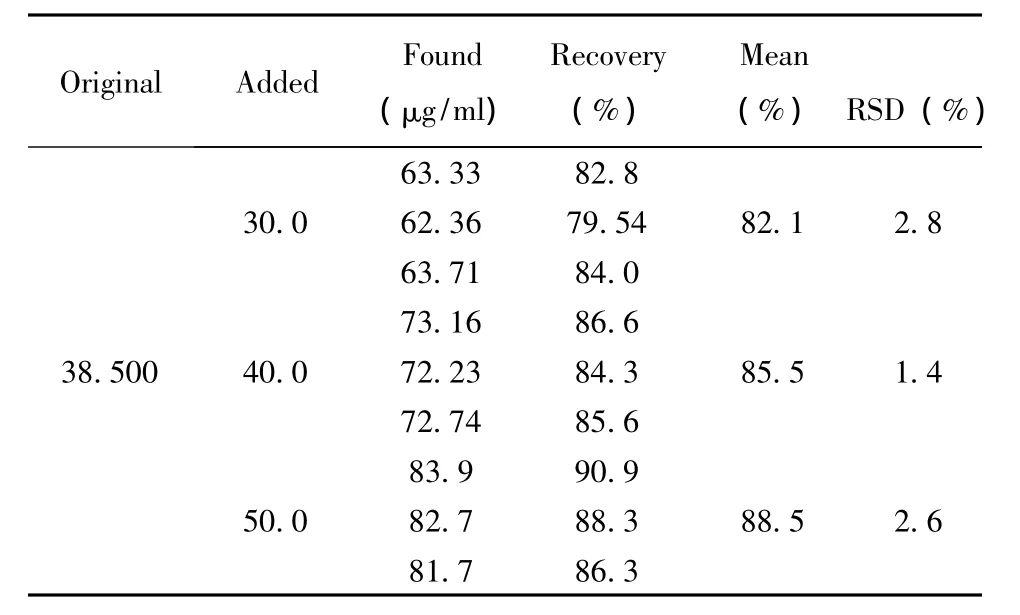
表4 黄芪甲苷测定回收率 (n=3)
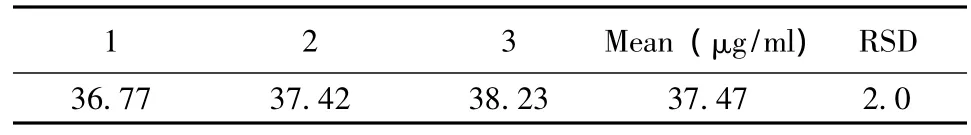
表5 黄芪中黄芪甲苷测定结果 (n=3)
2.3 提取条件的优化
2.3.1 因素与水平 选用L9(34)正交表安排试验。因素与水平表见表6。

表6 因素与水平表
2.3.2 浸膏得率的测定 按处方比例取白芨、黄芪、赤芍、当归、灯盏花、大黄药材粉末适量,精密称定,按L9(34)正交表实验安排,制备抗粘灵提取液。提取液过滤,置于已干燥至恒重的蒸发皿中,低温水浴浓缩至干,于60℃恒温箱中干燥至恒重,减去蒸发皿的重量,得浸膏重量,计算浸膏得率。结果见表7。
2.3.3 阿魏酸、黄芪甲苷的含量测定 样品溶液的制备:按处方比例取白芨、黄芪、赤芍、当归、灯盏花、大黄药材粉末适量,精密称定,按 L9(34)正交表安排实验,制备抗粘灵提取液。提取液过滤,浓缩至干。干膏用甲醇定容至10 ml,精密量取2 ml样品液于10 ml量瓶中,用甲醇定容至刻度。微孔滤膜过滤,在上述色谱条件下进样,外标法计算含量。结果见表8、9。
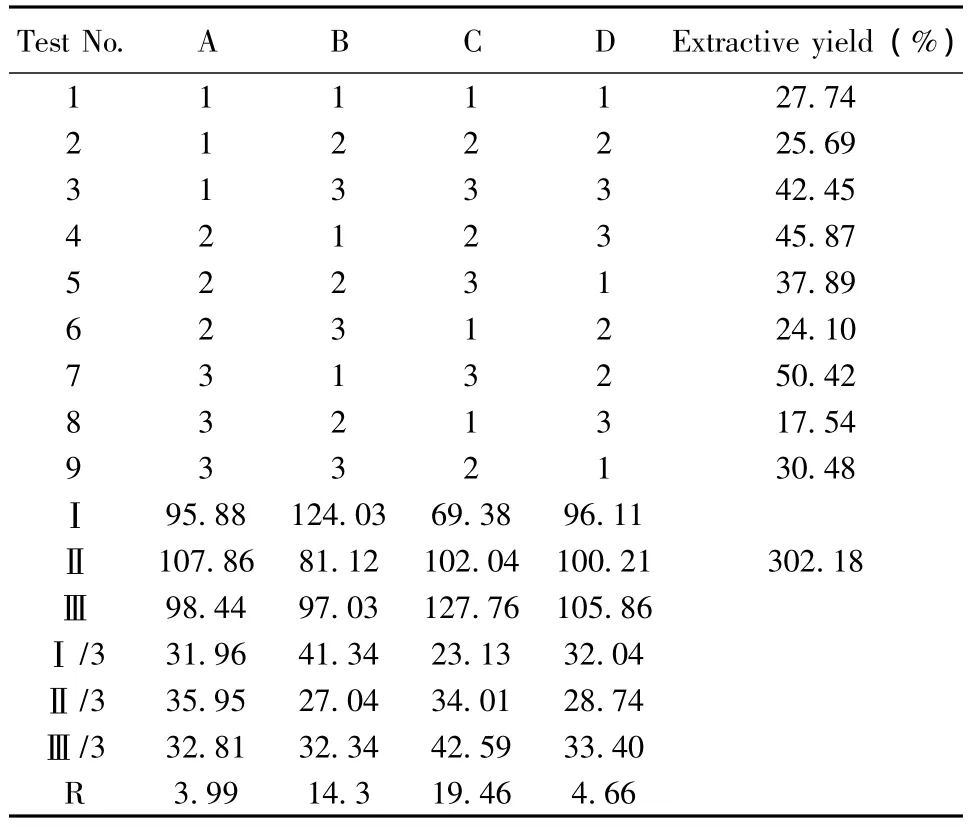
表7 提取率正交试验结果
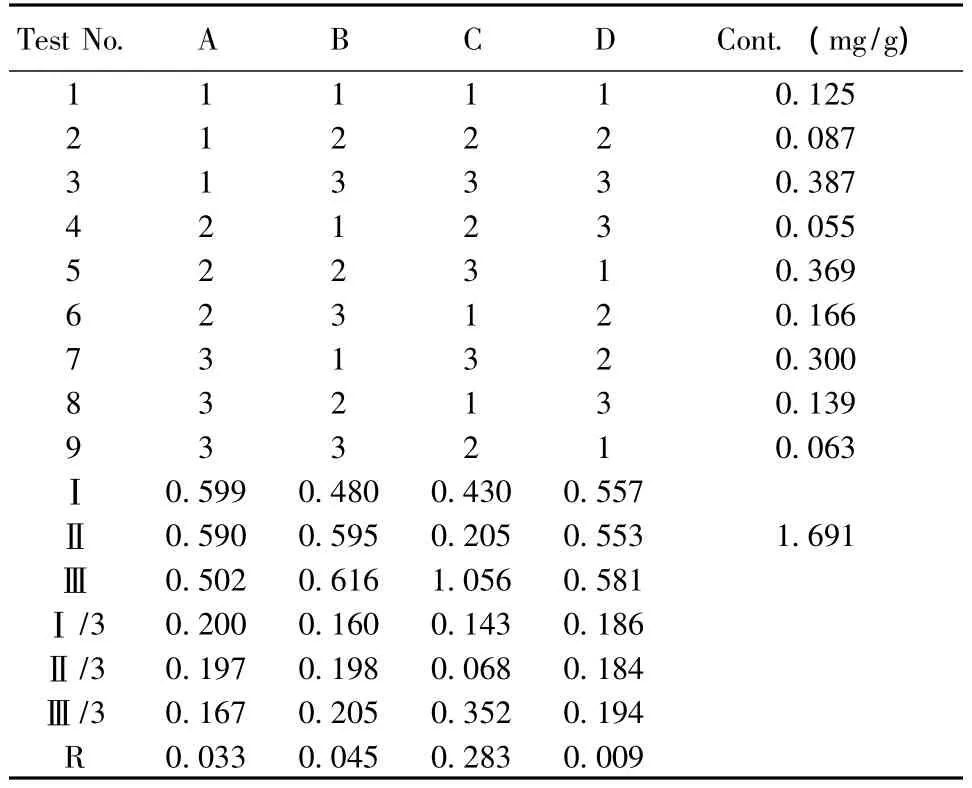
表8 阿魏酸正交试验结果
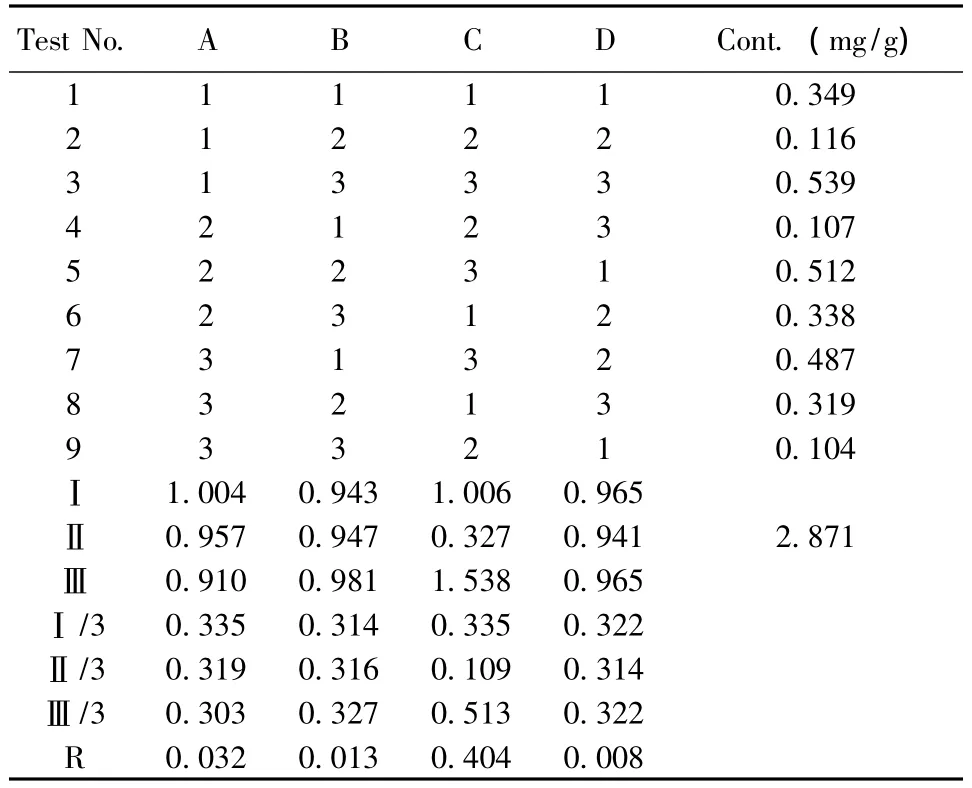
表9 黄芪甲苷正交实验结果
3 讨论
3.1 阿魏酸、黄芪甲苷检测波长与分离条件的选择 经紫外全波长扫描,确认阿魏酸在319.4 nm处有最大吸收,故此方法选用320 nm为测定波长。经紫外全波长扫描,确认黄芪甲苷在203.1 nm处有最大吸收,故此方法选用203 nm为测定波长。
3.2 正交试验结果分析 由表7、8、9可见各因素对浸膏得率的影响为 CBA,最佳水平组合为A2B1C3,即加入10倍量溶剂,提取2次,每次2 h;各因素对阿魏酸含量的影响为CAB,最佳水平组合为A1B3C3,即加入6倍量溶剂,提取2次,每次1.5 h;各因素对黄芪甲苷含量的影响为CAB,最佳水平组合为A1B3C3,即加入6倍量溶剂,提取2次,每次1.5 h。
[1]王晓阳,唐琳,赵垒.响应面法优化刺槐花多酚的超声提取工艺 [J].食品科学,2011.32(2):66-70.
[2]贾晓斌,黄洋,陈斌,等.药效学结合正交试验优选通脉颗粒抗心肌缺血成分的提取工艺研究 [J].中国中药杂志,2011,36(2):154-157.
[3]闵春艳,游本刚,许琼明,等.正交试验比较金银花药材中绿原酸与木犀草苷的乙醇提取工艺[J].中成药,2011,33(10):1815-1818.
[4]刘瑞江,张业旺,闻崇炜,等.正交试验设计和分析方法研究 [J].实验技术与管理,2010,27(9):52-55.
[5]朱平华,王勇.正交试验优化大蒜素的提取工艺 [J].食品研究与开发,2011,32(3):10-12.
[6]范云鹏,王德云,胡元亮,等.正交试验优选黄芪多糖脂质体的制备工艺[J].中草药,2011,42(3):470-473.
[7]刘晓华,于小华.正交设计优选黄芪中黄芪甲苷的最佳水提取工艺 [J].海峡药学,2010,22(8):22-23.
[8]李成义,王延惠,魏学明.HPLC测定不同产地当归中阿魏酸的含量[D].西部中药学,2012,25(1):35-36.
[9]庄志宏,吴剑坤,陈志峰,等.不同产地当归中阿魏酸的含量测定[J].北京中医药,2011,30(8):624-625.
[10]陈超超,王艳,梁超.高效液相色谱法测定当归中阿魏酸的含量 [J].成都大学学报 (自然科学版),2008,24(4):284-286.
[11]刘浩文,刘嘉仪,杨妙荣,等.黄芪药材中黄芪甲苷的含量测定的两种方法的比较研究 [J].2011,22(6):659-662.
