高速逆流色谱分离制备栀子苷
2013-04-20赵伯涛黄晓德朱羽尧
钱 骅,赵伯涛 ,黄晓德,陈 斌,朱羽尧
(南京野生植物综合利用研究院,江苏 南京210042)
栀子(Gardenia jusminoides)是卫生部颁布的第一批药食两用资源,现代药理研究表明,栀子具有解热镇静、保肝利胆等功效,临床上用于治疗急性黄疸性肝炎[1],其主要活性成分是栀子苷(京尼平苷,geniposide)和异栀子苷(gardenoside)等[2]。栀子苷在栀子果实中含量为3% ~8% ,而京尼平苷是栀子环烯醚醚苷中含量最高的一种,将其结构修饰可得到疗效较好的抗肝炎药[3],并且京尼平苷经β 葡萄糖苷酶水解后再与氨基酸反应可制备栀子蓝色素[4-5],这在日本已经商业化生产。有报道京尼平苷对植物有增产作用[6-8],而水解后的京尼平可作生物膜交链剂,如利用京尼平交联的明胶膜用于伤口包扎材料,利于伤口的愈合及减少炎症的发生率等[9-10]。
栀子苷是一种水溶性较强的化合物,用水或乙醇等极性溶剂提取后,用大孔树脂或硅胶分离纯化,但硅胶吸附损失较多。高速逆流色谱(high-speed counter-current chromatography,HSCCC)利用溶质在两种互不相溶的溶剂系统中分配系数的不同而进行的色谱法,它没有不可逆吸附;高回收率;进样量大,最大可达数克,且因固定相为液体,体系更换与平衡方便、快捷,目前是分离制备植物活性成分的一个重要手段[11-14]。本文在参考前人研究基础上,对逆流色谱分离制备栀子苷的条件进行研究。
1.1 仪器
HSCCC-TBE300A 高速逆流色谱仪(上海同田生化),泵TBD-50A,TBD-2000UV Detector,TC-1050恒温循环器,上海金达生化色谱工作站;Aglient 1200高效液相色谱仪(含G1322A Degasser,G1311A Quat pump,G 1316A TCC,G1315D DAD),Agilent chemstation.UO3200HE;
1.2 材料与试剂
栀子果实为山栀子(Gardenia jusminoides El.)由江苏省溧水博士牛生态农业有限公司提供.
HPLC 分析用甲醇、乙腈为色谱纯,其它溶剂均为分析纯,实验用水为过滤纯净水。栀子苷对照品购自中国药品生物制品检定所。
1.3 试验方法
1.3.1 样品的处理
栀子粉碎至0.30 mm 粒径,用50%乙醇加热回流提取3 次,每次30 min,合并提取液,减压回收溶剂,得浓缩液,依次过大孔吸附树脂D - 140 和HPD300A,收集HPD300A 的30%乙醇洗脱液,减压回收溶剂,真空干燥得栀子苷粗品(HPLC 检测含量为50.75%),备用。
1.3.2 两相溶剂系统及样品溶液的制备
溶剂系统参照文献[11],选择HSCCC 溶剂体系为:(1)乙酸乙酯∶正丁醇∶水(2∶1.5∶3);(2)正丁醇∶水(1∶1),按比例配制于分液漏斗中剧烈振荡,并静置过夜,体系分相平衡后分离出上下相,分别超声脱气30 min,备用。上相为固定相,下相为流动相,并用流动相溶解栀子苷粗品,浓度为25 mg/mL。
采用紫外分光光度法测定栀子苷在不同溶剂系统中的分配系数。栀子苷在溶剂系统1 和2 中的分配系数分别为0.30 和0.39。
1.4 HSCCC 分离过程
恒温循环器温度控制在25℃。将上相以流速10 mL/min 泵入高速逆流色谱仪的螺旋管,待螺旋管完全充满后(300 mL),此时有固定相流出,先以850 r/min 的速度旋转,然后以2 mL/min 泵入流动相,经过一段时间(约90 ~100 min),当体系达到流体动力学平衡后,将样品由进样阀注入分离管路,柱后流出物以紫外检测器检测,检测波长为254 nm,根据色谱图手动收集各色谱峰组分。进样4 h 后,停止主机转动,用压缩空气把固定相推出,测得溶剂系统(1)和(2)固定相保留率分别为54%和63%。
1.5 HPLC 分析
色谱条件 参照[15],色谱柱:Eclipse XDB -C18(5 μm,4.6 mm ×150 mm):流动相:水∶乙腈(85∶15),流速1 mL/min,检测波长238 nm,25 ℃,进样量20 μL,栀子苷标样用甲醇溶解,浓度0.17 μg/μL,0.45 μm 微孔滤膜滤过,所用溶剂均用有机膜滤过.栀子苷标准曲线:y =1 152.2x +6.475,R2=0.999 7。
2 结果与分析
不同溶剂系统对栀子苷分离的影响。
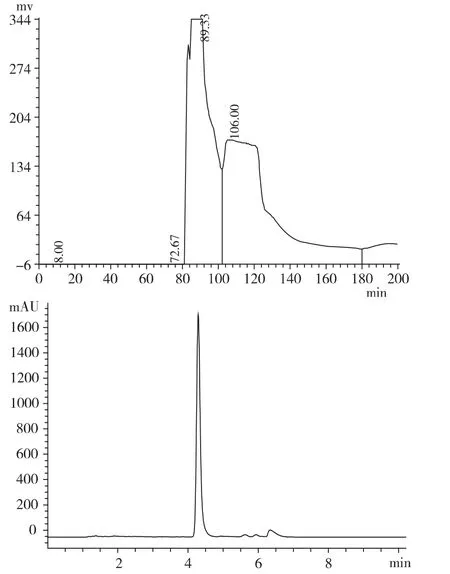
图1 栀子中栀子苷HSCCC 分离色谱图和相应峰的HPLC 图溶剂体系:乙酸乙酯∶正丁醇∶水(2∶1.5∶3)
475 mg 栀子苷粗品(HPLC 测定含量为50.75),用流动相19 mL 完全溶解后,经高速逆流色谱分离后显示有两个主要的峰,我们对出峰时间为80 ~105 min 的峰Ⅰ和105 ~126 min 峰Ⅱ进行了收集,得到组分Ⅰ和Ⅱ160.0 mg,并对Ⅰ和ⅡHPLC 对照品外标法定量测定,峰Ⅱ栀子苷含量为86.6%,峰Ⅰ栀子苷含量6.32%.Ⅱ经高速逆流色谱工艺其目标成分栀子苷回收率为81.36% 。
100 mg 栀子苷粗提物(HPLC 测定含量为50.75),用流动相15 mL 完全溶解后,经高速逆流色谱分离后显示有3 个主要的峰,我们对出峰时间为76 ~84 min 组分Ⅰ,84 ~120 minⅡ和120 ~160 minⅢ进行了收集,Ⅰ组分栀子苷含量很低,得到Ⅱ17.04 mg(13.7%)和Ⅲ38.0 mg(92.8%)。
Ⅲ经高速逆流色谱工艺其目标成分栀子苷回收率74.88% 。
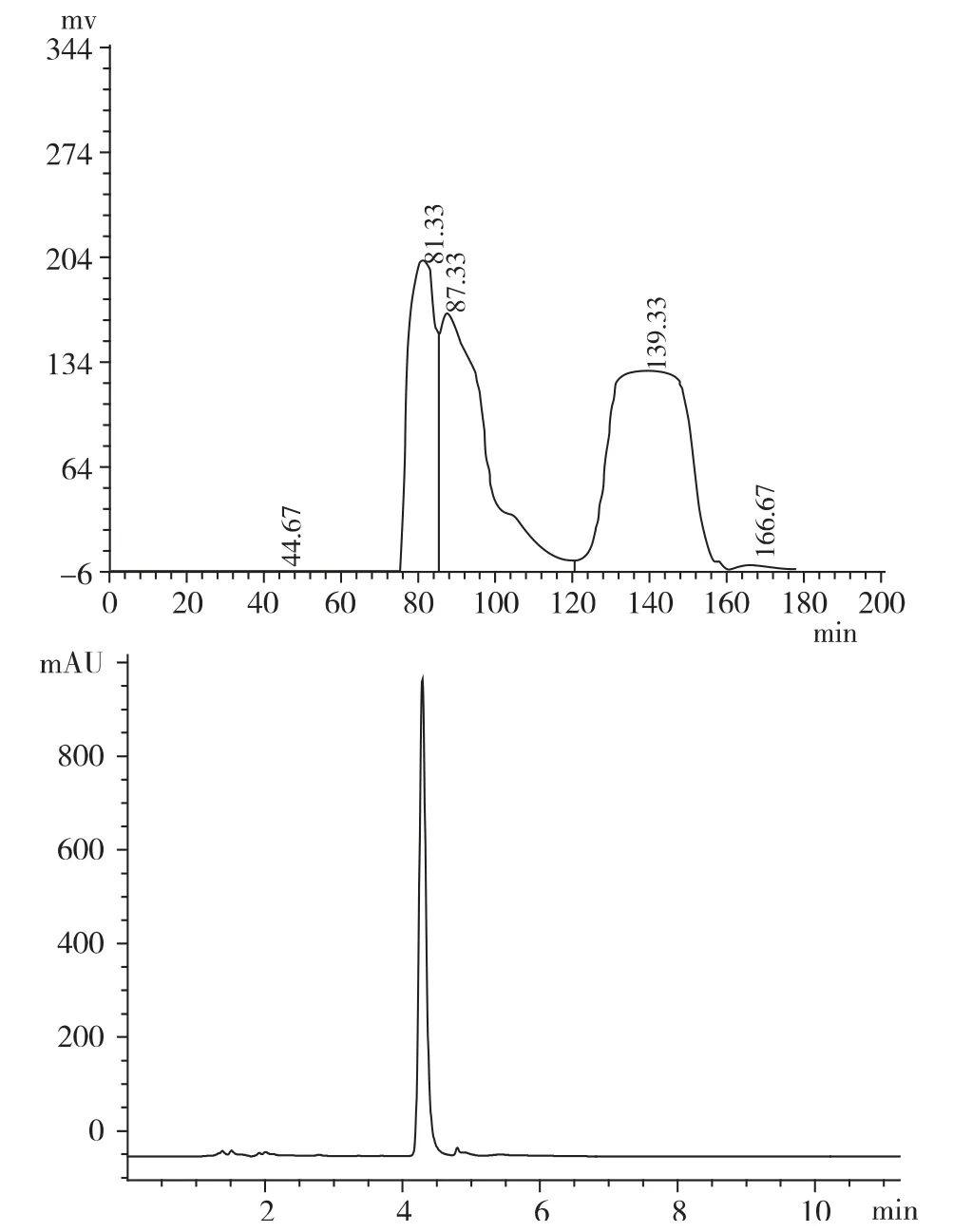
图2 栀子中栀子苷HSCCC 分离色谱图和相应峰的HPLC 图溶剂体系:正丁醇∶水(1∶1)
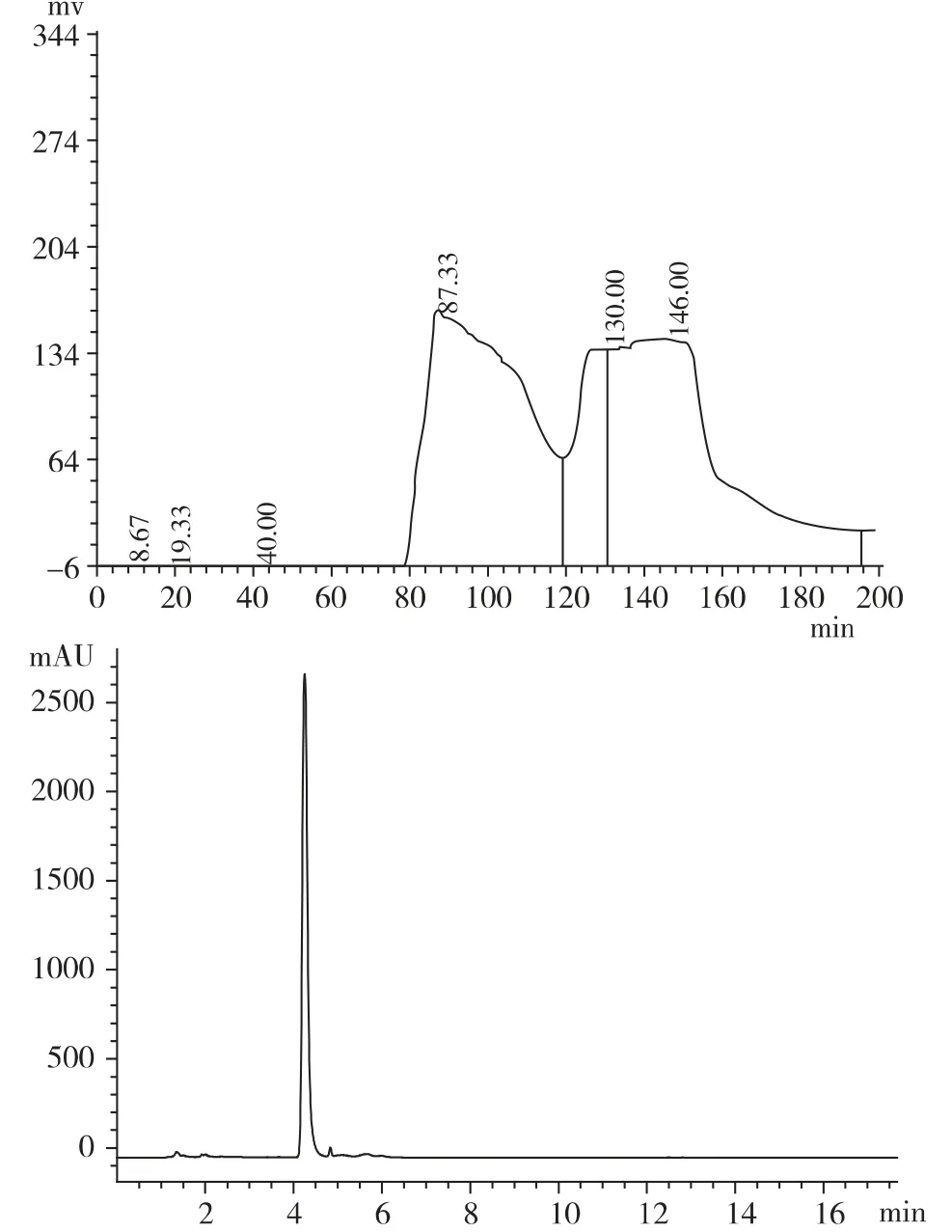
图3 栀子中栀子苷HSCCC 分离色谱图和相应峰的HPLC 图溶剂体系:正丁醇∶水(1∶1)
在分离体系不变情况下,未清洗柱子,即未用压缩空气推出固定相,以2 mL/min 泵入流动相,经过一段时间(约10 min)当体系达到流体动力学平衡后,500 mg(HPLC 67.7%)栀子苷粗品用20 mL 流动相全溶解后,继续进样。经高速逆流色谱分离后显示有两个主要的峰,分别为峰Ⅰ78 ~120 min 和峰Ⅱ120 ~157 min,对组分Ⅰ和Ⅱ收集和HPLC 栀子苷含量测定,得到Ⅰ41.31mg(3.7%),Ⅱ205.0 mg(91.8%)。Ⅱ经高速逆流色谱工艺其目标成分栀子苷回收率78.12%.这也说明HSCCC 分离体系相同,又分离物质相同,则可连续进样,出峰时间也相同,均为120 min 后开始出峰,对分离样品含量影响不大,而样品回收率还略有增高。
综上3 次HSCCC 分离栀子样品结果见表1。
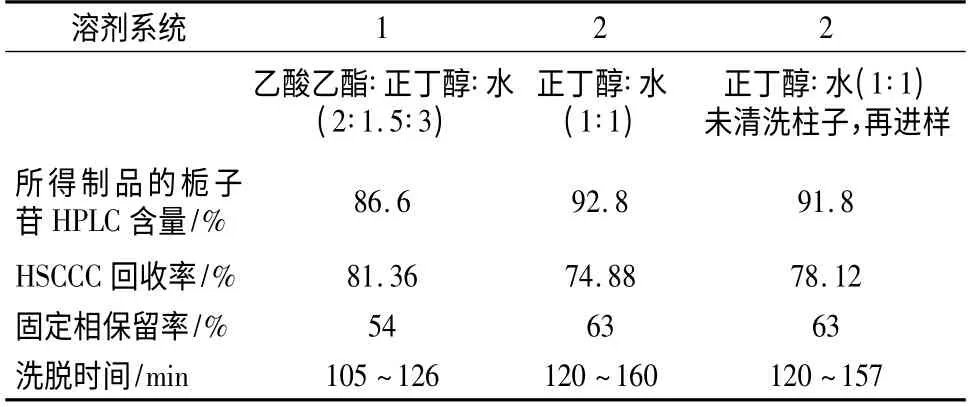
表1 不同溶剂系统中栀子苷HSCCC 分离效果
文献[11]采用分析型高速逆流色谱测定分配系数K,如其测得溶剂系统:(1)乙酸乙酯∶正丁醇∶水(2∶1∶3)的K 为0.44;(2)正丁醇∶水(1∶1)的K为0.94。本文采用紫外分光光度法测定溶剂系统:乙酸乙酯∶正丁醇∶水(2∶1.5∶3)和正丁醇∶水(1∶1)的K 值分别为0.30 和0.39。本文溶剂系统(2)正丁醇∶水(1∶1)比溶剂系统(1)乙酸乙酯∶正丁醇∶水(2∶1.5∶3)的洗脱时间延后,说明栀子苷在溶剂系统2 比溶剂系统1 的分配系数大,即栀子苷向上相(固定相)转移的倾向,溶剂系统2 比1 要大。
文献[11]分析型高速逆流色谱采用溶剂系统:乙酸乙酯∶正丁醇∶水(2∶1∶3)时,其栀子苷出峰时间为80 ~100 min. ,固定相保留率为60%。而文献制备型高速逆流色谱采用溶剂系统:乙酸乙酯∶正丁醇∶水(2∶1.5∶3),其出峰时间较晚,180 min.以后才开始出峰,固定相保留率70% 。本文比较了两个溶剂系统:(1)乙酸乙酯∶正丁醇∶水(2∶1.5∶3)和(2)正丁醇∶水(1∶1)。虽然溶剂系统均为(1),但本文出峰时间较文献[11]报道180 min.早,为105 ~126 min,这是因为设备型号不同(文献为TBE -1000A,本文为TBE300A),螺旋管柱体积不同,而出峰时间不仅与螺旋管柱体积有关,还与流动相流速,固定相保留因子,分配系数均有关。
由溶剂选择软件可知,溶剂系统(2)正丁醇∶水(1∶1)和溶剂系统(1)乙酸乙酯∶正丁醇∶水(2∶1.5∶3)的上下相密度差分别为0.1357 和0.108,而两相的密度差越大,固定相保留率就高,且分相时间也短,这都有利用分离度的提高。栀子苷极性大,适合用溶剂系统2 和1 来分离。
只要选定的溶剂系统具有一定的固定相保留率和分离溶剂系统相同,柱子可以不经清洗,经短暂平衡后,可接着再进样分离,而对其所分离栀子苷纯度和样品回收率无影响,而这可大大节省时间和溶剂。
本文所分得的栀子苷最大含量为92.%,纯度不是很高,这一方面是由于收集时是从HSCCC 峰的基部开始的,而非从含量较高的峰的肩部开始收集的;另一方面,可以通过HSCCC 的其它条件,如温度、转速和流速的比较,以获得更高的含量。
[1] 朱振家,钱之玉,陆莉华. 栀子提取无京尼平苷和西红花苷利胆作用的研究[J].中草药,1999,30(11):841 -843.
[2] 车双辉,杜琪珍,钟立人. 栀子成分的开发研究进展[J]. 天然产物研究与开发,2002,14(5):57 -59.
[3] 彭婕,钱之玉,刘同征.等.京尼平和西红花酸保肝利胆作用的比较[J].中国新药杂志,2003,12(2):105 -108.
[4] 肖亚中,栀子蓝色素菜生产工艺研究[J]. 食品与发酵工业,2002,28(7):37 -41.
[5] 吴志梅,梁华正,李佳春,等.栀子蓝色素的发酵及分离纯化工艺的研究[J].生物技术,2005,15(4):61 -64.
[6] 张伯熙,詹选怀,单永年,等.京尼平甙及其复方对黄瓜增产效果的研究[J].江西农业大学学报,2003,25(3):351 -355.
[7] 张伯熙,张劫,单永年.京尼平甙及其复方对黄瓜、豇豆的增产效果[J].长江蔬菜,1998(12):26 -29.
[8] 张伯熙,单永年,叶显荣,等.京尼平甙对小麦产量影响的研究[J].江西农业学报,1999,11(2):1 -5.
[9] 黄治本,顾其胜.新型交联剂京尼平在生物医学中的应用与发展[J].上海生物医学工程,2003,24(1):21 -25.
[10] 梁华正,廖夫生,乐长高,等. 氨基酸为显色试剂比色法测定栀子中京尼平苷的含量[J].药物分析杂志,2006,26(5):652-655.
[11] Zhou Tingting,Fan Guorong. Large-scale isolation and purification of geniposide from the fruit of Gardenia jasminoides Ellis by high-speed counter-current chromatography[J]. Journal of Chromatography A,2005,1100:76 -80.
[12] 祝顺琴,谈锋.高速逆流色谱在天然产物分离中的应用[J].中国医药工业杂志,2005,36(12):788 -791.
[13] 曹学丽.高速逆流色谱分离技术及应用[M]. 北京:化学工业出版社,2005.
[14] Peng Jinyong,Fan Guorong,Hong Zhanying,et al. preparative separation of isovitexin and isoorientin form Patrinia villosa Juss by high-speed counter-current chromatography[J]. Journal of chromatography,2005,1074:111 -115.
[15] 曹志胜,杨晓云.高效液相色谱法测定解郁安神胶囊中栀子苷含量[J].中国药业,2006,15(10):20 -21.
