尾鳍缺失对鳊鱼幼鱼游泳能力、能量效率与行为的影响
2013-04-19曹振东付世建
杨 晗 曹振东 付世建
(重庆师范大学进化生理与行为学实验室, 重庆市动物生物学重点实验室, 重庆400047)
尾鳍缺失对鳊鱼幼鱼游泳能力、能量效率与行为的影响
杨 晗 曹振东 付世建
(重庆师范大学进化生理与行为学实验室, 重庆市动物生物学重点实验室, 重庆400047)
鱼类需要多个系统的协同以完成包括游泳运动在内的各种生理功能。尾鳍作为运动系统的重要器官, 在游泳过程中具有推进及导向作用。尾鳍的形状、面积和大小等均会对鱼类的运动能力和运动方式产生影响[1—5]。在自然界中由于捕食、等级斗争等因素常常导致鱼体出现尾鳍的部分缺失, 不仅如此, 疾病、水温及食物等因素也会对尾鳍的形状及大小造成影响[6—11]。尾鳍与运动能力的关系一直受到研究者们的积极关注[12—14], 在此类相关实验研究中普遍采用剪鳍的处理方法, 其中尾鳍的剪除更为常见[12—16]。临界游泳速度(Critical swimming speed)作为鱼类有氧运动能力的重要评价指标, 不仅与觅食、洄游等生理活动紧密关联[17], 而且尾鳍缺失后的运动功能反应也常采用该指标进行评价[13,15]。最大运动代谢(活跃代谢, Active metabolic rate)表示鱼类在临界游泳过程中的最大耗氧率, 在一般情况下用来评价鱼类的最大有氧代谢能力, 通常受到温度、溶氧等一系列因素[18,19]的影响。不同种类鱼的尾鳍缺失对游泳能力的影响不尽相同[13,15]。有研究发现温度、摄食水平导致的游泳能力的改变常伴随着运动过程代谢率(Metabolic rate)和单位移动距离耗能(Cost of transport)的变化[20—22]。另外, 随着鱼类运动速度的增加, 摆尾频率与摆尾幅度均呈现明显的增加[23—26]。过往相关研究多以运动能力较强的梭形鱼类为对象[13,15],那么尾鳍缺失对体型侧扁的鱼的运动能力会有怎样的影响?这种影响是否会导致鱼类运动行为的改变?是否还会引起能量效率的变化?
为了验证上述问题, 本研究以体型侧扁的鳊鱼(Parabramis pekinensis, 俗称: 长春鳊)幼鱼为实验对象;分别切除尾鳍的上半叶和全叶, 在(20±1)℃水温下, 测定实验鱼的临界游泳速度及运动过程中耗氧率, 并计算单位距离耗能; 另外根据摄像资料, 统计实验鱼游泳运动过程中的摆尾频率及单侧最大摆尾幅度。本研究通过对结果的分析与讨论, 揭示尾鳍的缺失对实验鱼运动能力、能量代谢以及游泳行为的影响, 旨在为鱼类运动生理的相关研究提供基础资料。
1 材料与方法
1.1 实验鱼的来源与驯养
鳊鱼(Parabramis pekinensis)幼鱼(100尾)于2011年5月购自重庆市合川, 在实验室自净化循环控温水槽(专利号: ZL200520010485.9)中驯养2周。驯养期间每天8: 00采用商业颗粒饵料饱足投喂一次, 0.5h后用虹吸法排除残饵与粪便; 水槽日换水量约为水体(200 L)的10 %, 水温为(20 ± 1)℃, 溶氧水平≥7 mgO2/L, 光照周期为14 L : 10 D。驯养结束后, 挑选身体健康、体重(4.44 ± 0.40)g、体长(6.58 ± 0.18)cm接近的16尾实验鱼作为实验对象。
1.2 实验方案
本研究采用双配对处理法, 首先将选取的16尾实验鱼随机平均分为A, B两组, 每尾实验鱼分别在圆柱形的养殖单元(d·h=25 cm×25 cm)中适应2d后分别测定两组鱼的临界游泳速度(Ucrit)及运动过程中耗氧(MO2), 并获取整个测定过程的摄像资料。随后将两组鱼麻醉后分别进行剪尾鳍处理(A. 剪除上半叶尾鳍, B. 剪除全部)处理(图1)。将处理后的实验鱼放回独立养殖单元中恢复2d[27], 然后再次分别测定上述各指标并同步摄像。8尾鱼的预备实验结果表明, 麻醉后恢复2d不会对实验鱼的游泳能力产生影响。

图1 鳊鱼幼鱼剪除尾鳍处理Fig. 1 Juvenile Parabramis pekinensis with different caudal fin amputation treatments
1.3 测定方法及主要参数
临界游泳速度(Ucrit)的测定 实验测定设备采用自行设计的密闭式鱼类游泳代谢测定仪(专利号: 2005200 10485.4)其结构与工作原理已在相关文献[28, 29]中进行了详细介绍, 本文不再赘述。实验开始前首先将游泳代谢仪浸没于恒温(20±1) ℃水槽中, 然后将实验鱼分别转入游泳管在微水流(5.0 cm/s)中适应1h, 以消除转移胁迫的影响; 随后采用国际通用方法[29]进行Ucrit测定。测定采用6.0 cm/s(约为实验鱼的1倍体长)为起始速度, 以 6.0 cm/s 为速度增量(ΔV), 以 20min为持续时间(ΔT), 游泳速度不断增加直至实验鱼达到运动力竭状态。力竭状态的评判标准为实验鱼停靠在游泳管末端筛板20s以上[29]。测定过程中每20min换水1次, 以确保密闭游泳管内的水体溶氧水平不低于饱和状态的70%, 溶氧水平通过溶氧仪(HQ10, Hach Company, Ioveland, Colorado, USA)进行监测。Ucrit测定完成后取出实验鱼并测量常规参数(表1)。随后将实验鱼麻醉(30 μg/L丁香酚), 进行尾鳍剪除处理;恢复两天后再次进行Ucrit测定。
运动代谢率(MO2)测定 在测定Ucrit的过程中每2min测定1次游泳代谢仪封闭水体的溶氧值, 以溶氧值随时间变化斜率的绝对值和水体的体积计算每尾实验鱼的运动过程耗氧率。实验结束后将实验鱼取出, 对游泳代谢仪重新密闭并进行20min的耗氧率测定, 以扣除细菌耗氧的影响[29]。
单侧最大摆尾幅度 (A)与频率(TBF)测定 对整个Ucrit的测定过程的实验鱼进行摄像(佳能IXUS105), 然后采用国际通用方法[30,31]随机选取各速度下中间时段连续2min的视频资料, 分别计算各组实验鱼的每分钟尾鳍摆动次数(TPF)与单侧最大摆尾幅度(A)。
摆尾幅度的测量, 首先从2min的测量视频中随机截取16张清晰的照片(实验鱼尾鳍摆动角度达到最大, 即尾鳍摆动速度趋于零[13],然后将获得的实验鱼照片用电子标尺连接吻端与两胸鳍前端基部中点并延长作为中垂线, 将尾柄基部(除尾鳍外)至身体中垂线的距离(图2)作为单侧最大摆尾幅度(A)。

图2 实验鱼单侧最大摆尾幅度(A)Fig. 2 Amplitude (A) of juvenile Parabramis pekinensis
1.4 参数计算
临界游泳速度(Ucrit)

式中Ucrit为临界游泳速度, U 是能够完成设定时间(20min)的最大游泳速度, ΔU是速度增量(6.0 cm/s), T 是设定的持续游泳历时(T =20min), t 是未能完成设定历时的实际持续游泳时间(t<20min)。如果上式中U、ΔU的量纲为cm/s, Ucrit则表示绝对临界游泳速度(Absolute critical swimming speed); 由于本实验采用双配对处理法, 因此无需计算相对临界游泳速度(Relative critical swimming speed)。另外, 因为本实验鱼身体的横截面积并未超过游泳管截面积的10%, 所以Ucrit无需水阻校正[32]。
运动代谢率(MO2)
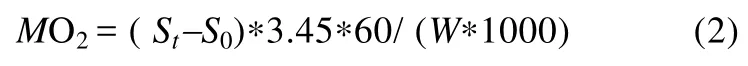
式中MO2[mgO2/(kg·h)]代表耗氧率, St为每档期间(20min)溶氧值随时间变化的斜率, S0为空白组的溶氧值变化斜率, 3.45为运动呼吸仪的系统体积(L), 60为60min。W表示体重(g)。
单位移动距离能耗(COT)

式中COT为单位移动距离能耗[J/(kg·m)]; MO2为实验鱼非体重指数校正的耗氧率[mgO2/(kg·h)]; V 则表示实验鱼游泳速度(m/h); 13.56为氧热当量系数(J/mgO2)[33]。
摆尾频率(TBF)与最大摆尾幅度(A)

TBF (Hz)为摆尾频率, TBT为单尾鱼观察时间内摆尾的次数, t(min)为观察时长。选取摆幅最大的照片, 连接吻端与两胸鳍前端基部中点并延长作为中垂线, 将尾柄基部至身体中垂线的距离作为单侧最大摆尾幅度, 最大摆尾幅度为双侧最大摆尾幅度(A)[30]。
1.5 数据统计
实验数据以Excell2007进行常规计算, 接着采用SPSS17.0进行数据分析, 其中对运动速度采用单因素方差分析。运动过程耗氧(MO2), 单位移动距离耗能(COT),摆尾频率(TBF)及摆尾幅度(A)均进行双因素方差分析(双因素分别为不同运动速度与不同剪鳍处理)。统计值均以平均值±标准误(Mean ± SE)表示, 显著性水平为P< 0.05。
2 结果
2.1 尾鳍缺失对临界游泳速度(Ucrit)的影响实验鱼在剪上半叶尾鳍处理后对照组与处理组的Ucrit分别为(54.36±1.49)和(45.90±2.46) cm/s, 显著下降15.56% (P=0.016); 剪全叶尾鳍的对照组与处理组的Ucrit分别为(51.50±1.41)和(30.66±2.16) cm/s, 下降40.47%, 差异显著(P<0.01)。另外, 统计检验结果表明, 两个对照组间Ucrit差异不显著(图1)。
2.2 尾鳍缺失后运动代谢率(MO2)与单位距离耗能(COT)的变化
尾鳍上半叶缺失的对照组与处理组的最大运动代谢率(MO2active)分别为(1036.49±101.25)和(922.38±67.01) mgO2/(kg·h), 无显著差异(P=0.48), 尾鳍全剪对照组与处理组活跃代谢分别为(923.15±134.67)和(788.00±102.38) mgO2/(kg·h), 差异仍然不显著(P=0.29)(表1)。统计结果表明两个对照组间的最大运动代谢率(MO2active)不存在显著差异。
不同的尾鳍处理下, 随着游泳速度的增加各组间代谢率均逐渐增加(图4)。当尾鳍部分丢失时与对照组比较,相同速度下的耗氧率均无显著变化(图4A)。尾鳍全部丢失后, 与对照组相比, 低流速下耗氧率无差异, 在速度达到24 cm/s时差异显著, 并随着流速的增加而变大(P<0.05)(图4B), 并且统计发现运动速度与剪鳍处理在对耗氧率影响上面存在交互作用(P=0.002)。
不同尾鳍缺失的鳊鱼幼鱼在不同游泳速度下的COT拟合曲线整体上呈U型, 表现为随着速度的增加COT先下降后上升的趋势(图5)。在尾鳍上半叶缺失后, 处理组与对照组相比有增加的迹象但无显著差异(图5A); 在尾鳍全部缺失后, 低流速下二者的差异不显著, 当速度增加到18 cm/s后, 出现显著差异并且逐渐增大(图5B)。
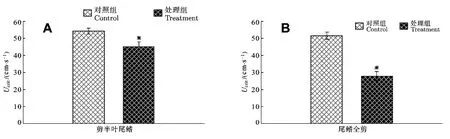
图3 尾鳍缺失对鳊鱼幼鱼游泳能力的影响(平均值±标准误, n=8)Fig. 3 Effect of different caudal fin amputation on Ucritof juvenile Parabramis pekinensis (Mean±SE, n=8)

表1 不同尾鳍缺失鳊鱼幼鱼的最大代谢率与常规参数(平均值±标准误, n=8)Tab. 1 MO2activeand morphological parameters of juvenile Parabramis pekinensis at different caudal fin amputation (Mean±SE, n=8)

图4 尾鳍缺失后不同运动速度下鳊鱼幼鱼耗氧率的变化情况Fig. 4 Effect of different caudal fin amputation on metabolic rate at different swimming speed

图5 尾鳍缺失后不同运动速度下鳊鱼幼鱼COT的变化Fig. 5 Effect of different caudal fin amputation on COT at different swimming speed (Mean±SE, n=8)

图6 不同尾鳍面积处理的鳊鱼幼鱼最大摆尾幅度(A)在不同游泳速度下的变化情况Fig. 6 Effect of different caudal fin amputation on A at different swimming speed (Mean±SE, n=8)
2.3 尾鳍缺失对最大摆尾幅度(A)和摆尾频率(TBF)的影响
不同程度的尾鳍剪除后, 对照组与处理组的摆尾幅度随着流速加大均显著增加, 处理组均显著高于对照组(P<0.05), 两个剪鳍组间的摆尾幅度并无显著差异(图6),数据统计发现运动速度与剪鳍处理在对摆尾幅度的影响上面存在交互作用(P<0.001)。
由图7可知, 剪除上半叶尾鳍的对照组与处理组的TBFmax分别为(442.5±14.95) Hz和(429.25±15.06) Hz, 无显著差异。尾鳍全剪的对照组与处理组的TBFmax分别为(532±25.19) Hz和(510.625±24.19) Hz, 仍无显著差异。不同尾鳍处理下的实验鱼TBF在整个Ucrit过程中随着流速的增加均逐渐增大。与对照组相比, 尾鳍上半叶剪除处理后, 各流速下TBF无显著变化(A), 尾鳍全剪后在速度低于Ucrit时具有显著差异(B)。
3 讨论
3.1 尾鳍缺失对运动能力(Ucrit)与最大运动代谢率(MO2active)的影响

图7 不同尾鳍面积处理的鳊鱼幼鱼摆尾频率(TBF)在不同游泳速度下的变化情况Fig. 7 Effect of different caudal fin amputation on TBF at different swimming speed (Mean±SE, n=8)
游泳运动作为鱼类逃逸、捕食、繁殖等行为的主要实现方式为其生存、生长及繁衍提供了基本保证[34,35]。自然界中鱼类的运动能力通常会受到一系列外界因素的影响, 其中包括摄食水平、温度、溶氧[18,19,36,37]等。此外,尾鳍的大小、形状也会对鱼类的游泳能力产生一定程度的影响[1—5,38]。有研究发现红大马哈鱼在尾鳍缺失较少时运动能力没有显著变化, 当大部分尾鳍缺失后, 游泳能力显著下降13%[13]; 尾鳍全部切除的斑马鱼, 游泳能力则显著下降35%[15]。本研究尾鳍上半叶缺失后实验鱼的运动速度降低16%, 尾鳍全部切除则下降40% (图3)。由此可见尾鳍缺失对鳊鱼幼鱼及斑马鱼游泳能力的影响较大,而对红大马哈鱼运动能力影响较少, 可能是由于后者的尾鳍相对面积偏小, 形状深叉; 而鳊鱼与斑马鱼的尾鳍面积较大, 形状较宽扁, 在运动中所起的推动作用更大,因此尾鳍的缺失对它们的运动能力影响更显著。上述分析表明, 尾鳍缺失对不同种鱼游泳能力的影响不尽相同。
鱼类在遭受温度、溶氧等胁迫时普遍存在着一定程度的补偿现象[39,40]。鱼类尾鳍的缺失对游泳运动能力造成的影响也可能存在生理、行为等方面的补偿现象。游泳不仅是鱼类主要的运动方式, 同时还是重要的耗能过程[41—43]。对于多数鱼类而言, 临界游泳速度状态下的耗氧率即为最大有氧运动代谢率。早期的研究发现红大马哈鱼的尾鳍缺失对于鱼体的最大有氧运动代谢没有造成显著影响[13]。本研究发现不同的尾鳍缺失处理对鳊鱼幼鱼的最大运动代谢率也没有产生显著影响(表1)。实验处理并未伤及肌肉等外周组织、没有进行较长时间的运动锻炼,因此外周组织的能量转化能力不会变化[43]。可见, 鳊鱼幼鱼尾鳍缺失后的运动能力下降并未表现出明显的能量代谢方面的补偿。
3.2 尾鳍缺失后运动能力的行为补偿
如上所述, 尾鳍缺失对不同鱼类游泳运动行为的影响不尽相同。然而很少有人关注更深层的补偿行为, 虽然早期有研究发现红大马哈鱼尾鳍缺失后运动能力显著下降, 却并未发现摆尾幅度(A)和摆尾频率(TBF)的显著改变[13], 同时以后也未见更多的类似研究。本研究结果发现:整个运动过程中剪除上半叶尾鳍的实验鱼摆尾幅度显著高于对照组(图6A), 幅度的明显增加对尾鳍缺失后运动能力下降起到了一定程度的补偿作用, 导致实验鱼运动能力的下降幅度较小(16%)。当尾鳍全部缺失后与对照组相比, 整个游泳过程除摆尾幅度显著增加外, 摆尾频率在低于Ucrit速度下也显著高于对照组(图7B), 即在幅度增加的补偿基础上还出现了频率补偿的现象, 这两种补偿方式的共存是对大面积尾鳍缺失所作出的整体行为补偿反应。
能量效率(COT)表示动物单位移动距离的能量消耗。在鱼类的相关研究中, 常用来估算运动过程中的效率以确定最适运动速度[44]。研究发现: 高、低温, 低溶氧等不利因素均会降低鱼类的能量效率[45,46]。那么尾鳍缺失对能量效率的影响也是一个值得关注的问题。本研究发现单一幅度补偿(尾鳍上半叶缺失)的能量效率在较高速度下呈现低于对照组的趋势, 然而经检验尚未达到显著水平(图5A); 而两种补偿方式同时出现时(尾鳍全部缺失)的能量效率整体上均低于对照组, 在较高速度下(>18cm/s)达到显著水平(图5B)。两种补偿方式所对应的能量效率不完全相同: 单独摆尾幅度增加后处理组的运动代谢率与对照组相比无显著差异(图4A), 相应速度下单次摆尾耗能也无显著差异, 因此仅采用摆尾幅度补偿的能量效率未见显著变化(图5A); 而尾鳍全剪后的实验鱼在达到Ucrit前, 各速度下的摆尾频率与对照组相比均显著增加(图7B), 由于相应速度下单次摆尾耗能无显著差异, 摆尾频率越快耗能越高, 致使相应速度下的整体耗能增加、效率降低; 又由于实验鱼处理前后的最大耗氧率保持不变(表1), 实验鱼的最大游泳运动能力则出现大幅下降(40%)。
鳊鱼幼鱼尾鳍缺失导致运动能力有所下降并存在行为补偿的现象; 然而不同程度的尾鳍缺失所造成的运动能力下降及其对应的行为补偿方式(A或A与TBF)均不尽相同。而且补偿方式的不同与各自所付出的能量代价之间还存在紧密关联。
[1] Gage H D, Daniel S, Kristen A B. Body shape, burst speedand escape behavior of larval anurans [J]. Oikos, 2005, 111(3): 582—591
[2] Yan G J, Cao Z D, Peng J L, et al. The effect of exercise training on the morphology parameter of juvenile common carp [J]. Journal of Chongqing Normal University (Natural Science), 2011, (3): 18—21 [闫冠杰, 曹振东, 彭姜岚, 等.运动锻炼对鲤鱼幼鱼形态参数的影响. 重庆师范大学学报(自然科学版), 2011, (3): 18—21]
[3] Lucas B P, Scott G H, Glenn N W, et al. Swimming performance and morphology of juvenile sockeye salmon, Oncorhynchus Nerka: comparison of inlet and outlet fry populations [J]. Environmental Biology of Fishes, 2006, (78): 257—269
[4] Jeffrey A W. Ecological morphology of lacustrine threespine stickleback Gasterosteus aculeatus L. (Gasterosteidae) body shape [J]. Biological Journal of the Linnean Society, 1997, (61): 3—50
[5] Theagarten L S. Caudal fin in the white shark, Carcharodon carcharias (Lamnidae): a dynamic propeller for fast, efficient swimming [J]. Journal of Morphology, 2005, 264(2): 233—252
[6] Moutou K A, McCarthy I D, Houlihan D F. The effect of ration level and social rank on the development of fin damage in juvenile rainbow trout [J]. Journal of Fish Biology, 1998, 52(4): 756—770
[7] MacLean A, Metcalfe N B, Mitchell D. Alternative competitive strategies in juvenile Atlantic salmon (Salmo salar): evidence from fin damage [J]. Aquaculture, 2000, 184(3-4): 291—302
[8] Noble C, Mizusawa K, Suzuki K, et al. The effect of differing self-feeding regimes on the growth, behavior and fin damage of rainbow trout held in groups [J]. Aquaculture, 2007, (264): 214—222
[9] Richard B. Caudal fin and body movement in the propulsion of some fish [J]. The Journal of Experimental Biology, 1963, (40): 23—56
[10] Alexandral B, Williame W J. Covariation between predation risk, body size and fin elaboration in the green swordtail, Xiphophorus helleri [J]. Biological Journal of the Linnean Society, 2004, 83(1): 87—100
[11] Kirk O W. Caudal eyespots as deterrents against fin predation in the Neoptropical Cichlid Astronotus ocellatus [J]. Copeia, 1990, (3): 665—673
[12] Böckelmann P K, Ochandio B S, Bechara I J. Histological study of the dynamics in epidermis regeneration of the carp tail fin (Cyprinus carpio, Linnaeus, 1758) [J]. Brazilian Journal of Biology, 2010, 70(1): 217—223
[13] Webb P W. Effects of partial caudal-fin amputation on the kinematics and metabolic rate of underyearling sockeye salmon (Oncorhnchus nerka) at steady swimming speeds [J]. The Journal of Experimental Biology, 1973, (59): 565—581
[14] Webb P W. Effects of caudal-fin amputation on fast-start performance of rainbow trout (Salmo gairdneri) [J]. The Journal of Experimental Biology, 1977, (68): 123—135
[15] Itai P. Effects of fin size on swimming performance, swimming behavior and routine activity of zebrafish Danio rerio [J]. The Journal of Experimental Biology, 2000, 203(4): 813—820
[16] Timothy E H, Brett M, Bruce C J, et al. Constraints on starting and stopping: behavior compensates for reduced pectoral fin area during braking of the bluegill sunfish Lepomis macrochirus [J]. The Journal of Experimental Biology, 2005, 208(24): 4735—4746
[17] Zeng L Q, Cao Z D, Fu S J, et al. Effect of temperature on swimming performance in juvenile southern catfish (Silurus meridionalis) [J]. Comparative Biochemistry and Physiology, Part A, 2009, 153(2): 125—130
[18] Pang X, Cao Z D, Fu S J. The effects of temperature on metabolic interaction between digestion and locomotion in juveniles of three cyprinid fish (Carassius auratus, Cyprinus carpio and Spinibarbus sinensis) [J]. Comparative Biochemistry and Physiology, Part A, 2011, 159(3): 253 —260
[19] Zhang W, Cao Z D, Peng J L, et al. The effects of dissolved oxygen level on the metabolic interaction between digestion and locomotion in juvenile southern catfish (Silurus meridionalis Chen) [J]. Comparative Biochemistry and Physiology, Part A, 2010, 157(3): 212—219
[20] Brett J R, Glass N R. Metabolic rates and critical swimming speeds of sockeye salmon (Oncorhynchus nerka) in relation to size and temperature [J]. Journal of the Fisheries Research Board of Canada, 1973, (30): 379—387
[21] Herbing I H V. Effects of temperature on larval fish swimming performance: the importance of physics to physiology [J]. Journal of Fish Biology, 2002, 61(4): 865—876
[22] Fu S J, Xie X J, Cao Z D. Effect of meal size on postprandial metabolic response in southern catfish (Silurus meridionalis) [J]. Comparative Biochemistry and Physiology, Part A, 2005, 140(4): 445—451
[23] Bainbridge R. The speed of swimming of fish as related to size and to the frequency and amplitude of the tail beat [J]. The Journal of Experimental Biology, 1958, (35): 109—133
[24] Kathryn A D, Jeanine M D, Chugey S, et al. Effects of temperature on sustained swimming performance and swimming kinematics of the chub mackerel Scomber japonicas [J]. The Journal of Experimental Biology, 2002, 205(7): 969—980
[25] Ohlberger J, Staaks G, Holker F. Estimating the active metabolic rate(AMR) in fish based on tail beat(TBF) frequency and body mass [J]. The Journal of Experimental Zoology, 2007, 307(5): 296—300
[26] Webber D M, Boutilier R G, Kerr1 S R, et al. Caudal differential pressure as a predictor of swimming speed of cod (Gadus morhua) [J]. The Journal of Experimental Biology, 2001, 204(20): 3561—3570
[27] Fu S J, Cao Z D, Peng J L. Effect of repetitive bouts of ex-haustive exercise with different interval on oxygen consumption in juvenile southern catfish [J]. Journal of Chongqing Normal University (Natural Science), 2009, 26(1): 13—16 [付世建, 曹振东, 彭姜岚. 不同时间间隔重复力竭运动对南方鲇幼鱼耗氧率的影响. 重庆师范大学学报(自然科学版), 2009, 26(1): 13—16 ]
[28] Guy C, Christine C, Anne-Laure G. Effect of temperature on maximum swimming speed and cost of transport in juvenile European sea bass (Dicentrarchus labrax) [J]. The Journal of Experimental Biology, 2006, 209(17): 3420—3428
[29] Lee C G, Farrell A P, Lotto A, et al. Excess post-exercise oxygen consumption in adult sockeye (Oncorhynchus nerka) and coho (O. kisutch) salmon following critical speed swimming [J]. The Journal of Experimental Biology, 2003, 206 (18): 3253—3260
[30] Donley J M, Dickson K A. Swimming kinematics of juvenile kawakawa tuna (Euthynus affinis) and chub mackerel (Scomber japonicus) [J]. The Journal of Experimental Biology, 2000, 203(20): 3103—3116
[31] Li D, Lin X T, Zhu Z M, et al. Effects of flow rate on swimming states and activity metabolism in juvenile hybrid sturgeon [J]. Acta Hydrobiologica Sinica, 2011, 35(4): 578—585 [李丹, 林小涛, 朱志明, 等. 不同流速下杂交鲟幼鱼游泳状态与活动代谢研究. 水生生物学报, 2011, 35(4): 578—585]
[32] Derek H A, Chris M W. The interactive effects of feeding and exercise on oxygen consumption, swimming performance and protein usage in juvenile rainbow trout (Oncorhynchus mykiss) [J]. The Journal of Experimental Biology, 1997, (200): 2337—2346
[33] Randall D. The control of respiration and circulation in fish during exercise and hypoxia [J]. The Journal of Experimental Biology, 1982, (100): 275—288
[34] Graham J B, Dewar H, Lai N C, et al. Aspects of shark swimming performance determined using a large water tunnel [J]. The Journal of Experiment Biology, 2004, (151): 175—1921
[35] Li K G, Cao Z D, Fu S J. Effect of feeding on excess post-exercise oxygen consumption in juvenile Chinese catfish (Silurus asotus Linnaeus) [J]. Acta Hydrobiologica Sinica, 2012, 36(6): 1035—1040 [李可贵, 曹振东, 付世建. 摄食对鲇鱼幼鱼力竭性运动后过量耗氧的影响. 水生生物学报, 2012, 36(6): 1035—1040]
[36] Arendt J, Hoang L. Effect of food level and rearing temperature on burst speed and muscle composition of western spadefoot toad (Spea hammondii) [J]. Functional Ecology, 2005, 19(6): 982—987
[37] Macnutt M J, Hinch S G, Farrell A P, et al. The effect of temperature and acclimation period on repeat swimming performance in cutthroat trout [J]. Journal of Fish Biology, 2004, 65(2): 342—353
[38] Pedro RP-N, Pierre M. The influence of swimming demand on phenotypic plasticity and morphological integration: a comparison of two polymorphic charr species [J]. Oecologia, 2004, (140): 36—45
[39] Fitzgibbon Q P, Strawbridge A, Seymour R S. Metabolic scope, swimming performance and the effects of hypoxia in the mulloway, Argyrosomus japonicus (Pisces: Sciaenidae) [J]. Aquaculture, 2007, 270(1—4): 358—368
[40] Myrick C A, Cech J J. Temperature influences on California rainbow trout physiological performance [J]. Fish Physiology and Biochemistry, 2000, 22(3): 245—254
[41] Fu S J, Zeng L Q, Li X M, et al. The behavioural, digestive and metabolic characteristics of fishes with different foraging strategies [J]. The Journal of Experimental Biology, 2009, (212): 2296—2302
[42] Pang X, Cao Z D, Peng J L, et al. The effects of feeding on the swimming performance and metabolic response of juvenile southern catfish, Silurus meridionalis, acclimated at different temperatures [J]. Comparative Biochemistry and Physiology Part A, 2010, 155(2): 253—258
[43] Li X M, Cao Z D, Peng J L, et al. The effect of exercise training on the metabolic interaction between digestion and locomotion in juvenile darkbarbel catfish (Peltebagrus vachelli) [J]. Comparative Biochemistry and Physiology, Part A, 2010, 156(1): 67—73
[44] Pang X, Yuan X Z, Cao Z D, et al. The effect of dissolived oxygen levels on resting oxygen consumption and swimming performance in juvenile darkbarbel catfish peltebagrus vachelli [J]. Acta Hydrobiologica Sinica, 2012, 36(2): 255—261
[45] Ohlberger J, Staaks G, Hölker F. Effects of temperature, swimming speed and body mass on standard and active metabolic rate in vendace (Coregonus albula) [J]. Comparative Biochemistry and Physiology, 2007, 177(8): 905—916
[46] Fitzgibbon Q P, Strawbridge A, Seymour R S. Metabolic scope, swimming performance and the effects of hypoxia in the mulloway, Argyrosomus japonicus (Pisces: Sciaenidae) [J]. Aquaculture, 2007, 270(1—4): 358—368
EFFECT OF CAUDAL AMPUTATION ON SWIMMING CAPACITY, ENERGY EXPENDITURE AND BEHAVIOR OF JUVENILE PARABRAMIS PEKINENSIS
YANG Han, CAO Zhen-Dong and FU Shi-Jian
(Laboratory of Evolutionary Physiology and Behavior, Chongqing Key Laboratory of Animal Biology, Chongqing Normal University, Chongqing 400047, China)
鳊鱼幼鱼; 运动能力; 能量效率; 行为补偿
Juvenile Parabramis pekinensis; Swimming capacity; Energy expenditure; Behavior compensation
S965
A
1000-3207(2013)01-0157-07
10.7541/2013.157
2011-10-18;
2012-11-08
国家自然科学基金项目(No. 31172096)资助
杨晗(1988—), 女, 重庆人; 硕士研究生; 主要研究方向为鱼类生理。E-mail: 11yanghan1@163.com
曹振东, 教授; E-mail: z.d.cao@hotmail.com
