急性热应激对西伯利亚鲟HSP70 mRNA表达、血清皮质醇和非特异性免疫的影响
2013-04-19田照辉徐绍刚胡红霞马国庆
田照辉 徐绍刚 王 巍 胡红霞 马国庆
(国家淡水渔业研究中心暨北京市水产科学研究所, 北京 100068)
急性热应激对西伯利亚鲟HSP70 mRNA表达、血清皮质醇和非特异性免疫的影响
田照辉 徐绍刚 王 巍 胡红霞 马国庆
(国家淡水渔业研究中心暨北京市水产科学研究所, 北京 100068)
为研究西伯利亚鲟(Acipenser baerii)对急性热应激的抗逆机理, 将体质量为(155.47±19.50) g的鱼从17.5 ℃迅速转至27.5 ℃水中, 在1h和3h取样测定HSP70 mRNA表达变化、血清皮质醇和非特异性免疫指标。结果显示: 急性热应激时鳃、脾和脑的HSP70 mRNA表达量升高, 具有组织特异性, 热应激1h时鳃的表达量升高最快(P<0.05), 3h时保持1h时的表达水平; 脾和脑热应激1h时表达量变化不显著, 在1h至3h时升高较快, 并且脑组织的表达量升高最快(P<0.05)。热应激1h时血清皮质醇(Cortisol)含量迅速升高(P<0.05), 之后快速回落。脾脏巨噬细胞呼吸暴发在热应激1h时显著升高(P<0.05), 3h时降低。血清补体C3在1h时略有升高, 3h时显著性降低(P<0.05)。血清溶菌酶活性(LZM activity)先升高后降低差异不显著。血清超氧化物歧化酶(SOD)活力随热应激时间延长逐渐降低, 3h时显著降低(P<0.05)。血清丙二醛(MDA)含量随热应激时间延长逐渐降低, 差异不显著。以上结果表明: 1h的短暂急性应激增强了西伯利亚鲟的非特异性免疫, 3h的应激使免疫力和抗氧化能力显著下降; 在热应激过程中,HSP70表达升高, 其中鳃组织最快, 起到应激保护作用, 提高了机体热耐受力。
西伯利亚鲟; 急性热应激;HSP70 mRNA表达; 皮质醇; 非特异性免疫
我国20世纪90年代成功开展鲟鱼养殖并迅速推广, 1998年到2002年鲟鱼养殖增加了50倍[1], 鲟鱼已成为山区流水和网箱养殖的重要品种。西伯利亚鲟(Acipenser baerii), 隶属于鲟科, 鲟属, 为软骨硬鳞类, 是《濒危动植物种国际贸易公约》附录Ⅱ物种, 具有重要的科研和经济价值。西伯利亚鲟为亚冷性鱼类, 适宜生长水温16.7—24.7℃[2]。鱼类是变温动物, 易受水温变化的影响, 适应低温的鱼类,对热更敏感[3], 高水温抑制生长, 损害鱼体健康甚至死亡[4]。西伯利亚鲟在高温下难以存活或生长缓慢[5—7], 养殖条件受到限制, 夏季持续高温应激造成鲟鱼死亡现象时有发生。
适度的应激对机体有利, 过强和持续时间过长的应激对机体有害, 应激能打破鱼类与环境间的平衡, 产生皮质类固醇浓度升高为特征的系列反应,进而引起其他生理和免疫反应的变化。鱼类适应水温变动的过程中, 显著影响体内抗氧化体系[5,6]。热休克蛋白(HSPs)可根据分子量分类, 其中HSP70家族高度保守, 研究最为深入, 对热应激更敏感[8]。HSP70能提高细胞的应激耐受性[9—11], 增强抗氧化作用。鲟鱼环境应激研究多为遭遇拥挤、氨氮、缺氧等时, 皮质醇和葡萄糖等生理指标的变化[12—15],但重要环境胁迫因子高水温对西伯利亚鲟影响研究较少。本文系统研究了急性热应激时西伯利亚鲟血清皮质醇、非特异性免疫和HSP70 mRNA表达变化,旨在阐明西伯利亚鲟对热应激的抗逆机理, 为其耐高温品种选育和提高耐高温能力提供理论依据。
1 材料与方法
1.1 实验鱼和取样
试验用西伯利亚鲟由北京市水产科学研究所国家级鲟鱼良种场提供。挑选体质健壮的西伯利亚鲟15尾, 平均体质量为(155.47±19.50) g, 17.5℃暂养一周后, 5尾鱼设为0h组, 其余迅速转入27.5℃水中,进行热应激。观察鱼的行为反应, 鳃盖的张开闭合视为一次呼吸, 统计呼吸频率。在热应激后1h、3h分别迅速取5尾鱼转入1 g/L的丁香酚水中, 麻醉后尾静脉取血, 4℃静置2h, 4℃ 3000 r/min离心10min,取血清−20℃保存, 用于测定免疫指标和皮质醇。迅速取鳃、脾脏、全脑液氮速冻, −80℃保存, 用于提取RNA。取新鲜脾脏用于测定呼吸暴发。
1.2 试剂、引物合成
RNeasy Mini Kit, RNase-Free DNase Set为Qiagen公司产品。RT-PCR试剂盒购于Invitrogen公司。实时定量试剂为AB公司的2×Sybrgreen PCR Master Mix。克隆菌株DH10B由北京市水产科学研究所生物技术与育种研究室保存。
根据西伯利亚鲟HSP70 cDNA全序列(GenBank: HM348777), 使用软件Primer 5.0设计实时定量PCR引物4f: GTTACCCGAAGGACCCAATC, 4r: GT ATCCAGCATCACAAACAGAA, 由北京擎科生物工程有限公司合成。
1.3 HSP70 mRNA的实时定量
使用Qiagen RNA试剂盒提取总RNA, RNase-Free DNase set柱上处理基因组, 伯乐紫外分光光度计测定RNA的浓度和OD值, 保证OD值为1.9—2.0, 琼脂糖凝胶电泳检验RNA完整性。采用SYBR Green法, 将待测样品cDNA系列稀释后作为标准品, 构建相对标准曲线, 按照田照辉等[16]方法进行实时定量。
1.4 皮质醇含量测定
取−20℃保存的血清, 由北方生物技术研究所使用皮质醇放射免疫分析药盒(北方生物技术研究所生产, 国药准字S10940097)测定: 标准或样品中的皮质醇(简称Cor.)和加入的125I-Cor.共同与一定量的特异性抗体产生竞争性免疫反应。具体步骤见试剂盒说明书。
1.5 溶菌酶活力测定
参照宋超等[17]方法, 以溶壁微球菌(Micrococcus lysoleikticus)冻干粉为底物, 将底物用0.1 mol/L、pH 6.4的PBS缓冲液配成A540=0.3—0.5的悬液。取3 mL该悬浊液于试管内并置于冰浴中, 再加入50 μL待测血清, 混合, 测A0值。然后将试液移入37 ℃温浴30min, 取出后立刻置于冰浴内10min, 以终止反应,测其A值。溶菌酶活力计算公式为: ΜL= (A0−A)/A。
1.6 呼吸暴发测定
参照Couso, et al.[18]方法, 采用NBT(氯化硝基四氮唑啉蓝)还原法测定: 在无菌条件下取新鲜脾脏,加入RMPI 1640培养基制备单细胞悬液, 台盼兰染液显微计数活细胞, 将活细胞浓度调整至107cell/mL, 取100 μL此悬液加入96孔板, 每个样品3个平行, 空白对照加100 μL RMPI1640培养基。将96孔板置于细胞培养箱, 18℃培养1h, 弃掉培养液(此时细胞已贴壁), 加入100 μL NBT继续培养1h。弃掉NBT, 用PBS缓冲液冲洗后加2倍体积甲醇固定10min。弃掉甲醇, 加入2mol/L KOH 120 μL和DMSO140 μL, 在匀速振荡器上300 r/min振荡10min后, 用酶标仪测630nm吸光值。
1.7 SOD、MDA和补体C3测定
取−20℃保存的血清由北京华英生物技术研究所测定。其中SOD、MDA分别使用南京建成生物工程研究所超氧化物歧化酶(SOD)测试盒与微量丙二醛(MDA)测试盒, SOD采用黄嘌呤氧化酶法, MDA采用硫代巴比妥(TBA)法。C3采用潍坊三维生物工程集团有限公司试剂盒, 采用免疫比浊法。所用仪器均为日本日立7160全自动生化仪。
1.8 数据统计分析
实验数据使用Spss11.5中One-way和Duncan’s进行单因素方差分析和多重比较。
2 结果
2.1 行为反应
西伯利亚鲟从17.5℃转至27.5℃水中, 有明显趋避行为, 剧烈游动, 呼吸频率加快, 平均达210次/min, 0.5h后稳定在180次/min, 0h保持在80—90次/min。
2.2 HSP70 mRNA表达
在西伯利亚鲟遭受热应激时, 鳃的HSP70 mRNA表达量升高最快, 1h 后升高为0h组的1.63倍, 差异显著(P<0.05), 直到3h时仍然保持在这一水平; 脾和脑热应激1h后HSP70 mRNA表达量没有变化, 但3h时升高较快, 差异显著(P<0.05), 并且在热应激后1h至3h时, 脑的HSP70 mRNA表达量升高最快, 3h时为1h时的1.77倍(P<0.05), 但低于鳃1h和3h时的表达量, 且差异显著(P<0.05) (图1)。
2.3 血清皮质醇含量
在急性热应激状态下, 血清皮质醇含量迅速升高, 1h时为0h时的5.14倍(P<0.05), 随着热应激时间延长, 皮质醇含量快速回落, 3h时为0h时的2.1倍(图2)。

图1 急性热应激对西伯利亚鲟HSP70 mRNA表达的影响(n=5)Fig.1 The effect of acute thermal stress on HSP70 mRNA expression in Acipenser baerii (n=5)

图2 急性热应激对血清皮质醇变化Fig.2 The effect of acute thermal stress on serum cortisol content
2.4 非特异性免疫指标
在3h急性热应激时间内, 脾脏巨噬细胞呼吸暴发(NBT反应强度)在1h时最高, 差异显著(P<0.05), 3h时稍低于0h组水平, 差异不显著(图3)。血清补体C3在1h时有所升高, 但差异不显著, 3h时显著降低, 低于0h组水平(P<0.05)(图4)。血清溶菌酶活性先升高后降低但差异不显著(图5)。血清超氧化物歧化酶SOD活性随热应激时间延长逐渐降低, 3h时显著降低(P<0.05)(图6)。血清丙二醛MDA含量随热应激时间延长逐渐降低, 差异不显著。(图7)

图 3 急性热应激对脾脏巨噬细胞呼吸暴发的影响Fig.3 The effect of acute thermal stress on respiratory burst of spleen macrophage

图4 急性热应激对血清C3含量的影响Fig.4 The effect of acute thermal stress on serum C3
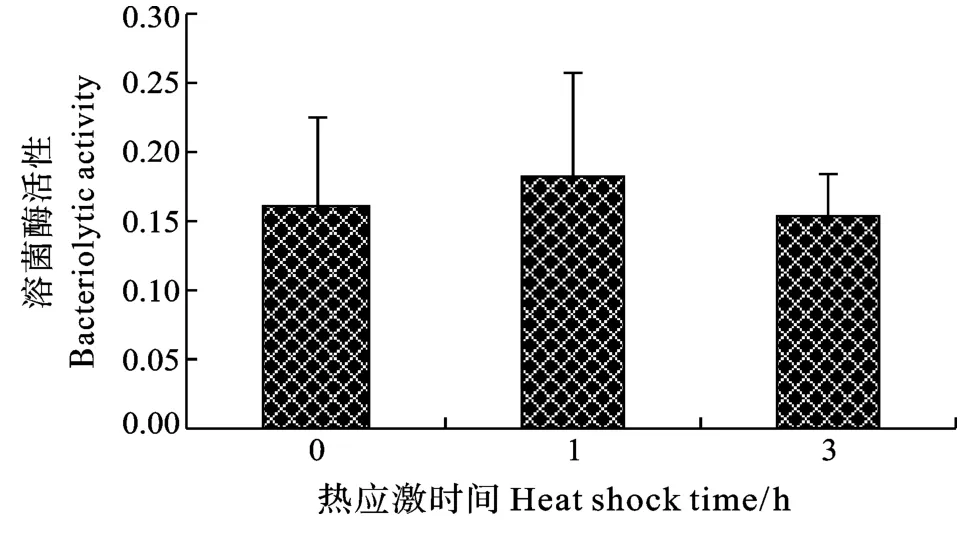
图5 急性热应激对血清溶菌酶活性的影响Fig.5 The effect of acute thermal stress on serum lysozyme activity
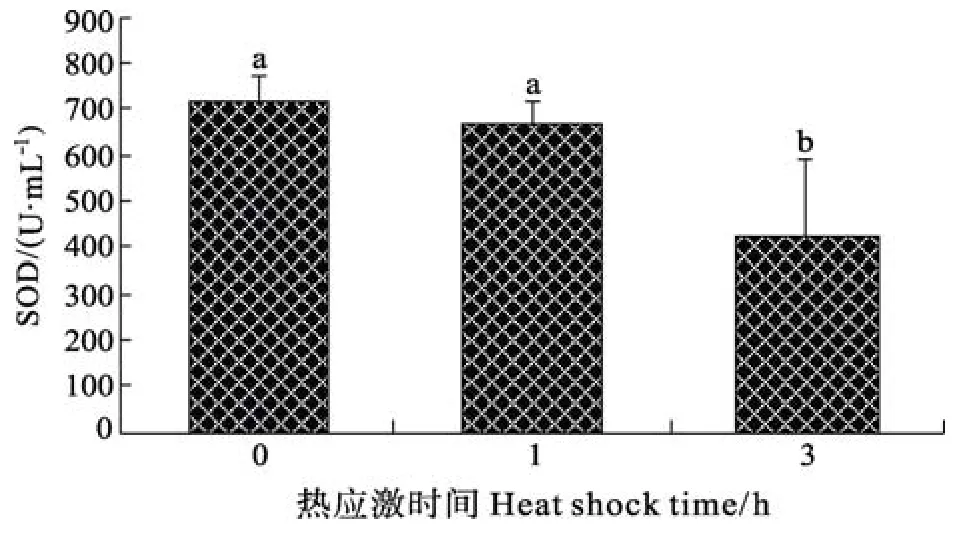
图6 急性热应激对血清SOD活性的影响Fig.6 The effect of acute thermal stress on serum SOD content
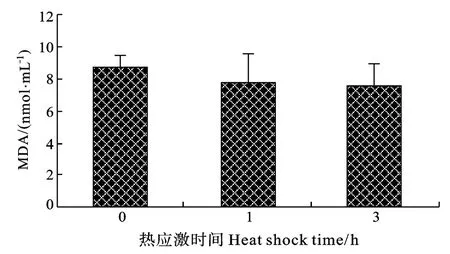
图7 急性热应激对血清MDA含量的影响Fig.7 The effect of acute thermal stress on serum MDA content
3 讨论
3.1 热应激对HSP70 mRNA表达的影响
27.5℃水温超出了鲟鱼的适温范围[2], 是鲟鱼养殖中夏季经常遭遇的高水温。急性热应激使西伯利亚鲟呼吸频率加快, 增加了呼吸代谢, 行为适应不能保证内环境的稳定时, 开始出现生理性应激反应[19]。上调热休克蛋白表达是机体细胞对应激做出的反应之一[20], 使细胞免受变性蛋白的损害。在急性热应激状态下, 西伯利亚鲟鳃、脾、脑的HSP70 mRNA表达均有不同程度的上调, 呈现出组织特异性[11]: 1h内鳃HSP70 mRNA表达量升高最快; 1h至3h时脑组织的HSP70 mRNA升高最快, 3h时为1h时的1.77倍(P<0.05)。同扇贝(Chlamys farrer)、牡蛎(Ostrea edulis)等水生动物一样[21]鳃组织比其他组织对水环境的改变更敏感, 这可能是鳃直接与水环境接触造成的。黑头呆鱼(Pimephales promelas)脑引起应激的温度高于鳃[20], 西伯利亚鲟脑组织在1h时的表达量基本没有变化, 说明西伯利亚鲟脑组织较鳃组织难以引起热应激, 这与黑呆头鱼较一致。脑内HSP70的过度表达与神经保护作用有关, 是神经元损伤的标志[22], 急性热应激3h时西伯利亚鲟脑HSP70 mRNA表达量迅速增高, 说明脑组织已经出现了变性蛋白。
热休克蛋白的诱导表达一般呈现先升高后降低的趋势, 健康人中性粒细胞热应激诱导后4—6h HSP70表达至高峰水平[23], 团头鲂(Megalobrama amblycephala)34℃热应激下肝脏组织HSP70基因表达量6h达最大值[24]。文中西伯利亚鲟3种组织3h时HSP70 mRNA表达量呈上升趋势, 不能判定已达高峰水平。HSP70诱导温度和表达变化受鱼的种类、组织特异性、饲育历史等因素影响[25—27], 在使用HSP70评价应激状态时应予以考虑。
3.2 热应激对血清皮质醇含量的影响
鲟鱼在遭遇胁迫时最先产生、最主要的类固醇激素是皮质醇[12]。虽然西伯利亚鲟血清皮质醇含量个体之间差异较大, 亚得利亚鲟(Acipenser naccarii)也存在此现象[28], 但血清皮质醇对温度骤升反应迅速而强烈, 同其他硬骨鱼一样, 鲟鱼血清皮质醇水平升高是应激反应初始指示器[28]。种属、年龄、季节和水温等均影响血清皮质醇水平[29], 亚得利亚鲟皮质醇含量25℃时是17℃时的2.5倍多, 根据Maxime, et al.[15]的观点17℃静息状态是亚得利亚鲟鱼的生理水平[28], 据此观点西伯利亚鲟17.5℃时的皮质醇含量12.43 ng/mL可视为其生理水平, 高于3龄1.5 kg西伯利亚鲟的5 ng/mL[15]。Webb, et al.归纳了多种鲟鱼皮质醇含量[12], 其中俄罗斯鲟鱼(Acipenser guldenstadti)含量最高, 为33.5 ng/mL,高于文中西伯利亚鲟。
皮质醇具有促进葡萄糖异生作用, 适度和短时增高, 帮助机体对抗环境压力[30]。但较高浓度和较长作用时间, 对头肾巨噬细胞呼吸暴发产生抑制作用[31]。温度突然升高时超过一般生理水平的皮质醇会引起胸腺、脾脏和淋巴组织萎缩, 抑制免疫[32]。每克体重50 μg皮质醇抑制虹鳟(Oncorhynchus mykiss)HSP70诱导产生[33]。实验中西伯利亚鲟皮质醇在热应激1h时迅速升高, 起到对抗环境压力的作用, 在3h时已迅速回落, 各组织HSP70 mRNA的表达并没有受到1h时皮质醇升高的抑制, 可能是因为皮质醇升高的时间较短。
3.3 热应激对非特异性免疫的影响
呼吸暴发产生大量活性氧自由基, 发挥杀菌功能, 但过多的自由基会造成组织损伤。SOD酶最先与活性氧自由基发生作用, 清除自由基[19], 当SOD酶活性降低时, 体内会出现自由基过多, 免疫水平下降[34]。MDA为脂质过氧化产物, 反映机体受氧化损伤程度。中华鲟 (Acipenser sinensis Gray)低温和适温时血清活性氧含量随水温显著升高[5], 西伯利亚鲟呼吸暴发在温度骤升1h时显著增加, 之后迅速降低, 可能因为27.5℃已超出了其适温范围, 并且HSP70表达增加可以抑制呼吸暴发功能[23]。西伯利亚鲟血清SOD在抗氧化过程中发挥重要所用: 在热应激1h内, 呼吸暴发产生大量活性氧, 抗氧化系统通过SOD维持自身的稳定, 随着自由基清除剂消耗增多, 3h时SOD活力显著下降, 标志着机体抗氧化能力显著下降。MDA的含量呈下降趋势但差异不显著, 说明细胞膜还没有受到损伤。
水生动物血清溶菌酶活力是衡量机体免疫状态的指标之一。急性热应激时西伯利亚鲟溶菌酶活性没有受到显著影响。补体是体液中一组具有酶原活性的糖蛋白, 活化后可参与免疫和维护内环境稳定。硬骨鱼类补体替代途径具有比哺乳类补体替代途径更为重要的作用[30], 补体替代途径激活从C3开始。C3含量下降增加对疾病易感性[35]。西伯利亚鲟热应激1h时C3含量显著上升, 3h时含量显著降低, 说明短时的热应激提高了机体的免疫力, 较长时间的应激降低了机体的免疫力。
综上所述, 急性热应激显著影响了西伯利亚鲟非特异性免疫和皮质醇含量, HSP70表达显著升高,起到一定的应激保护作用, 鳃组织反应最快。1h的短暂急性应激使西伯利亚鲟皮质醇含量显著升高,增加了糖异生作用, 呼吸暴发显著升高, 补体C3和溶菌酶活性略有升高, 增强了西伯利亚鲟的抗应激能力和非特异性免疫能力; 3h的急性热应激使西伯利亚鲟补体C3、呼吸暴发和SOD活性显著降低, 西伯利亚鲟抗氧化能力和非特异性免疫显著下降, 此时HSP70的诱导表达已难于维持机体自身的稳态。
[1] Wei Q, He J, Yang D, et al.Status of sturgeon aquaculture and sturgeon trade in China: review based on two recent nationwide surveys [J].Journal of Applied Ichthyology, 2004, 20(5): 321—332
[2] Huang N Y, Xian L J, Yao Z L, et al.Regression biology of Acipenser baeri to western China and its biology [J].Journal of Shanghai Fisheries University, 2005, 14(4): 370—374 [黄宁宇, 夏连军, 么宗利, 等.西伯利亚鲟鱼回归生物学特性研究.上海水产大学学报, 2005, 14(4): 370—374]
[3] Chen Q Z , Zeng J N , Gao A G, et al.Advances in study of temperature of thermal tolerance of fishes [J].Journal of Fisheries of China, 2004, 28(5): 562—567 [陈全震, 曾江宁,高爱根, 等.鱼类热忍耐温度研究进展.水产学报, 2004, 28(5): 562—567]
[4] Huang Z H, Ma A J, Wang X A.The immune response of turbot Scophthalmus maximus (L.) skin to high water temperature [J].Journal of Fish Diseases, 2011, 34(8): 619—627
[5] Li D P, Liu S Y, Xie C X, et al.Effects of water temperature on serum content of reactive oxygen species and antioxidant defense system in Chinese sturgeon Acipenser sinensis [J].Acta Hydrobiologica Sinica, 2008, 32(3): 327—332 [李大鹏,刘松岩, 谢从新, 等.水温对中华鲟血清活性氧含量及抗氧化防御系统的影响.水生生物学报, 2008, 32(3): 327—332]
[6] Feng G P, Zhuang P, Zhang L Z, et al.Effects of water temperature on metabolic enzyme and antioxidase activities in juvenile chinese sturgeon (Acipenser sinensis) [J].Acta Hydrobiologica Sinica, 2012, 36(1): 137—142 [冯广朋, 庄平,章龙珍, 等.温度对中华鲟幼鱼代谢酶和抗氧化酶活性的影响.水生生物学报, 2012, 36(1): 137—142]
[7] Huang Y, Zhu X M, Xie S Q, et al.Compensatory growth in Acipenser baerii, following feed derivation at high temperature: temporal patterns in growth, feed intake and body composition [J].Acta Hydrobiologica Sinica, 2011, 34(6): 1113—1121 [黄莹, 朱晓鸣, 解绶启, 等.西伯利亚鲟在高温下饥饿后的补偿生长.水生生物学报, 2011, 34(6): 1113—1121]
[8] Deng D F, Wang C F, Lee S, et al.Feeding rates affect heat shock protein levels in liver of larval white sturgeon (Acipenser transmontanus) [J].Aquaculture, 2009, 287(1—2): 223—226
[9] Basu N, Todgham A E, Ackerman P A, et al.Heat shock protein genes and their functional significance in fish [J].Gene, 2002, 295(2): 173—183
[10] Feige U, Polla B S.Heat shock proteins: the hsp70 family [J].Cellular and Molecular Life Sciences, 1994, 50(11—12): 979—986
[11] Zhu J L, Wang G L.The research progress on HSP70 in fish species [J].Journals of Ningbo University (NSEE), 2007, 20(4): 446—450 [祝璟琳, 王国良.鱼类HSP70研究进展.宁波大学学报(理工版), 2007, 20(4): 446—450]
[12] Webb M A, Allert J A, Kappenman K M, et al.Identification of plasma glucocorticoids in pallid sturgeon in response to stress [J].General and Comparative Endocrinology, 2007, 154(1—3): 98—104
[13] Warren D E, Matsumoto S, Roessig J M, et al.Cortisol response of green sturgeon to acid-infusion stress [J].Comparative Biochemistry and Physiology-Part A: Molecular & Integrative Physiology, 2004, 137(3): 611—618
[14] Gisbert E, Rodríguez A, Cardona L, et al.Recovery of Siberian sturgeon yearlings after an acute exposure to environmental nitrite: changes in the plasmatic ionic balance, Na+-K+ATPase activity, and gill histology [J].Aquaculture, 2004, 239(14): 141—154
[15] Maxime V, Nonnotte G, Peyraud C, et al.Circulatory and respiratory effects of an hypoxic stress in the Siberian sturgeon respiration physiology [J].Respiration Physiology, 1995, 100(3): 203—212
[16] Tian Z H, Xu S G, Wang W, et al.Molecular cloning, characterization of a HSP70 cDNA from Siberian sturgeon Acipenser baerii and its tissues distribution [J].Journal of Dalian Ocean University, 2012, 27(2): 150—157 [田照辉,徐绍刚, 王巍, 等.西伯利亚鲟热休克蛋白HSP70 cDNA的克隆、序列分析和组织分布.大连海洋大学学报, 2012, 27(2): 150—157]
[17] Song C, Niu C J, Chen X R.The effect of chitosan on some non-specific immune indices of the juvenile soft-shelled turtle Pelodiscus sinensis [J].Acta Zoologica Sinica, 2007, 53(2): 270—277 [宋超,牛翠娟, 陈欣然.壳聚糖对急性氨氮胁迫下中华鳖稚鳖非特异性免疫反应的影响.动物学报, 2007, 53(2): 270—277]
[18] Norma Couso, Rosario Castro, Beatriz Magarin, et al.Effect of oral administration of glucans on the resistance of gilthead seabream to pasteurellosis [J].Aquaculture, 2003, 219(1—4): 99—109
[19] Wang H, Zhuang P, Zhang L Z, et al.Effects of salinity on survival, growth and antioxidant defense system of Siganus guttatus [J].Journal of Fisheries of China, 2011, 35(1): 66—73 [王好, 庄平, 章龙珍, 等.盐度对点篮子鱼的存活、生长及抗氧化防御系统的影响.水产学报, 2011, 35(1): 66—73]
[20] Roberts R J, Agius C, Saliba C, et al.Heat shock proteins (chaperones) in fish and shellfish and their potential role in relation to fish health: a review [J].Journal of Fish Diseases, 2010, 33(10): 789—801
[21] Qu L Y, Xiang J H, Sun X Q, et al.Expression analysis of HSP70 in various tissues of Chlamys farreri under thermal stress [J].High Technology Letters, 2005, 15(5): 96—100 [曲凌云, 相建海, 孙修勤, 等.温度刺激下栉孔扇贝不同组织热休克蛋白HSP70的表达研究.高技术通讯, 2005, 15(5): 96—100]
[22] Fos, HSP-70, CCK and PRL immunoreactiyity, and H-MRS in situ studies of metabolic changes in weanling rats following heat stress and febrile convulsions [D].Thesis for Doctoral Degree, Zhejiang University, Hangzhou.2003 [倪宏.急性热应激与热惊厥幼龄大鼠脑内Fos、HSP-70、CCK和PRL的免疫反应性及MRS波谱研究.博士学位论文, 浙江大学, 杭州.2003]
[23] Miao L J, Ying L, Wang B B, et al.Effect of heat stress response on the activity of NADPH oxidase and respiratory burst in neutrophils [J].Journal of Southeast University (Medical Science Edition), 2007, 26(6): 430—433 [缪丽君,应玲, 王蓓蓓, 等.热应激反应对中性粒细胞NADPH氧化酶活性及呼吸暴发功能的影响.东南大学学报(医学版), 2007, 26(6): 430—433]
[24] Ming J H, Xie J, Liu B, et al.Cloning, sequence analysis of HSP70 cDNA and effects of heat stress on its mRNA expression in Megalobrama amblycephala [J].Journal of Fishery Sciences of China, 2009, 16(5): 635—647 [明建华,谢骏, 刘波, 等.团头鲂HSP70 cDNA的克隆、序列分析以及热应激对其mRNA表达的影响.中国水产科学, 2009, 16(5): 635—647]
[25] Werner I, Viant M R, Rosenblum E S.Cellular responses to temperature stress in steelhead trout (Onchorynchus mykiss) parr with different rearing histories [J].Fish Physiology Biochemistry, 2006, 32(3): 261—273
[26] Brun N T, Bricelj V M, MacRae T H, et al.Heat shock protein responses in thermally stressed bay scallops, Argopecten irradians, and sea scallops, Placopecten magellanicus [J].Journal of Experimental Marine Biology and Ecology, 2008, 358(2): 151—162
[27] Currie S, Moyes C D, Tufts B L.The effects of heat shock and acclimation temperature on hsp70 and hsp30 mRNA expression in rainbow trout: In vivo and in vitro comparisons [J].Journal of Fish Biology, 2000, 56(2): 398—408
[28] Cataldi E, Marco P D, Mandich A, et al.Serum parameters of Adriatic sturgeon Acipenser naccarii (Pisces: Acipenser iformes): effects of temperature and stress [J].Comparative Biochemistry and Physiology Part A, 1998, 121(4): 351—354
[29] Belanger J M, Son J H, Laugero K D, et al.Effects of short-term management stress and ACTH injections on plasma cortisol levels in cultured white sturgeon, Acipenser transmontanus [J].Aquaculture, 2001, 203(1—2): 165—176
[30] Xiao K Y.Aquatic Animal Immune and Application [M].Beijing: Academic Press.2007, 145, 182-186 [肖克宇.水生动物免疫与应用.北京: 科学出版社.2007, 145, 182—186]
[31] Liu X L, Ge H Y, Tian Z, et al.Effects of cortisol on respiratory burst of head kidney macrophages in Pelteobagrus fulvidraco [J].Journal of Huazhong Agricultural University, 2008, 27(6): 749—754 [刘小玲, 葛海燕, 田珍, 等.皮质醇对黄颡鱼头肾巨噬细胞呼吸暴发活动的影响.华中农业大学学报, 2008, 27(6): 749—754]
[32] Zhou A J, Luo H J, Lu X C, et al.Effect of L-arginine on concentration of serum cortisol under heat stress in rats [J].Chinese Journal of Public Health, 2005, 21(5): 594—595 [周爱军, 罗海吉, 卢晓翠, 等.L-精氨酸对热应激大鼠血清皮质醇变化的影响.中国公共卫生, 2005, 21(5): 594—595]
[33] Basu N, Nakano T, Grau E G, et al.The effect of cortisol on heat shock protein 70 levels in two fish species [J].General Comparative Endocrinology, 2001, 124(1): 97—105
[34] Liu C B, Wang J X, Liu C R, et al.Effects of non-biologic environmental factors on Penaeus chinensis infected by the explosive epidemic disease virus [J].Journal of Fisheries of China, 2001, 25(1): 58—63 [刘昌彬, 王金星, 刘存仁, 等.非生物环境因子对暴发性流行病病原感染的中国对虾发病的影响.水产学报, 2001, 25(1): 58—63]
[35] Zhou X Q, Niu C J, Sun R Y.Effects of vitamin C and acid stress on serum complement C3 and C4 level in juvenile soft-shelled turtles (Pelodiscus sinensis) [J].Acta Zoologica Sinica, 2003, 49(6): 769—774 [周显青, 牛翠娟, 孙儒泳.维生素C和酸应激对中华鳖幼鳖血清补体C3和C4含量的影响.动物学报, 2003, 49(6): 769—774]
EFFECTS OF ACUTE THERMAL STRESS ON HSP70 MRNA, PHYSIOLOGY AND NONSPECIFIC IMMUNITY IN SIBERIAN STURGEON (ACIPENSER BAERII)
TIAN Zhao-Hui, XU Shao-Gang, WANG Wei, HU Hong-Xia and MA Guo-Qing
(National Engineering Research Center for Freshwaters(Beijing)and Beijing Fisheries Research Institute,Beijing100068,China)
The effect of acute thermal stress onHSP70 mRNA expression, physiology and nonspecific immunity were investigated in Siberian sturgeon.In the experiment, ten fish were transferred from17.5℃ to 27.5℃ water, then data were measured at 1h and 3h.Fish in 17.5℃ water were taken as 0h group.Respiratory rate increased from 80—90 breaths/min to 210 breaths/min, then decreased to 180 breaths/min after 0.5h.Among the three tissues including gill, spleen and brain, theHSP70 mRNA expression in gill rose most quickly after 1h stress, and was about 1.63 fold compared with the 0h group (P<0.05), then remained this level to 3h; TheHSP70 mRNA expression in spleen and brain had nearly no change in 1h thermal stress, then rose quickly from 1h to 3h in the two tissues, especially in brain at 3h rose most quickly to about 1.77 fold compared with the 1h group (P<0.05).Compared with the 0h group, serum cortisol increased quickly and was 5.14 fold (P<0.05) at 1h, then decreased quickly to 2.1 fold at 3h.Spleen macrophage respiratory burst achieved the maximum (P<0.05) at 1h, then reduced to the 0h group level.Serum complement C3 increased at 1h and decreased significantly at 3h (P<0.05).Serum lysozyme activity firstly elevated then decreased but had no significant differences.Serum SOD activity decreased when thermal stress time prolonged, and achieved the minimum at 3h (P<0.05).Serum MDA content decreased when thermal stress time prolonged and had no significant difference.The results showed that 1h acute thermal stress promoted the nonspecific immunity and tolerance, but 3h acute thermal stress decreased it.
Siberian sturgeon (Acipenser baerii); Acute thermal stress;HSP70 mRNA expression; Coritsol; Nonspecific immunity
S917.4
A
1000-3207(2013)02-0344-07
10.7541/2013.25
2012-06-05;
2013-01-06
农业部公益性行业科研专项(201003055-05); 北京市科技计划(D121100003712002); 北京市农林科学院青年基金(QNJJ 201015)资助
田照辉 (1973—), 女, 河北保定人; 高级工程师, 硕士; 主要从事生物技术与育种研究。E-mail: tzhhui@126.com
胡红霞(1972—), 女, 博士, 高级工程师; E-mail: huhongxia1@yahoo.com.cn
