低蛋白水平饲料对黄鳝血清雌二醇和睾酮含量的影响
2013-04-14王淳懿袁汉文杨代勤长江大学动物科学学院湖北荆州434025
王淳懿,袁汉文,杨代勤 (长江大学动物科学学院,湖北 荆州434025)
黄鳝 [Monopterusalbus(Zuiew)]是一种雌性先熟雌雄同体鱼类,第一次性成熟都为雌性,产卵后经过间性最终逆转为雄性,并且这一发育过程是单向的,即发生性转变后不再由雄性个体逆转为雌性个体;而且间性个体在较长的一段时间内均可发现[1]。黄鳝在自然条件下转变为功能性雄鱼至少需要3a的时间,在自然条件下也发现有超过6龄以上的雌性个体[2]。自从发现黄鳝自然性逆转特性以来,很多学者对其分别从生理生化[3]、细胞水平[4]和分子水平[5-6]等方面对其逆转机制进行了研究,但至今还没弄清楚。宋平等[7]研究了黄鳝雌雄两性中性类固醇激素的周年变化规律,到目前为止,关于低蛋白饲料对黄鳝血清性类固醇激素含量的影响报道很少。本研究通过探讨低蛋白饲料对黄鳝血清中雌二醇和睾酮含量的影响,以为进一步探索黄鳝性逆转机制提供依据。
1 材料与方法
1.1 试验饲料
试验共设5个组,每组饲料的蛋白含量分别为100、150、200、250g/kg和400g/kg,饲料中各成分含量及营养水平见表1。所有饲料均以鱼粉和大豆粉作为蛋白源,鱼油作为脂肪源,α-淀粉作为能量来源;以其中饲料蛋白含量为400g/kg组作为对照[8]。饲料中各种原料经过60目的筛子后充分混匀,鱼油根据配比逐渐加入到饲料中,每千克饲料约加水400ml,经过约30min的搅拌后,将饲料制成直径为2.0mm的圆柱状,在室温下烘干,然后储存在-20℃的冰箱中备用。
1.2 试验鱼饲养与管理
整个养殖试验均在室外池塘的网箱中进行。所用试验鱼为同批孵化出来的苗种 (均由长江大学黄鳝研究所提供),分别投放到15个网箱中 (5个处理3个平行),每个试验网箱中投放50条,试验鱼的初始体重为 (13.50±1.10)g,试验网箱的规格为2m×1m×1.5m。在试验网箱中经过2周的驯养后开始进行正式养殖试验,每个网箱中投喂对应的试验饲料。网箱中投放水花生作为黄鳝的栖息环境。
养殖试验从2011年5月到2012年7月共15个月。整个试验期间,每天18:00时投喂,投喂量为鱼体重的2%~6%,第2天早晨将残饵进行清理。在水温低于10℃或超过38℃时和遇到雷雨天气则不进行投喂。从养殖开始后的第4个月取样,每个月月底取样1次,取样时每个网箱中随机挑选3条,迅速带回实验室检测相关指标。

表1 试验饲料配方组成及营养水平
1.3 血清雌二醇和睾酮含量的测定
采用断尾法采血。所取血样盛放在事先用肝素钠润洗过的1.5ml的离心管中,采血500~3000μl,平均为 (1200±200)μl。血样采取后放于离心机中以3500r/min离心25min,收集血清后存放在-20℃的冰箱中备用。
按照北京北方生物技术研究所生产的雌二醇放射免疫分析试剂盒和北京科美东雅生物技术有限公司所生产的睾酮放射免疫分析试剂盒说明书的方法和步骤分别测定雌二醇和睾酮的含量,采用中国科学技术大学创新股份有限公司中佳分公司生产的Gc-911γ放射免疫计数器计数。其中,雌二醇的可检测范围是0~4000pg/ml,睾酮的可检测范围是0~2000pg/ml。试剂盒主要技术参数:标准范围:5~4000pg/ml;灵敏度:≤2pg/ml;精密度:批内CV<10%,批间CV<15%。
1.4 数据分析及处理
试验数据采用SPSS 15.0进行方差分析、显著性及相关性检验,结果以平均数±标准差 (mean±SD)表示。以P<0.05表示有显著性差异。
2 结果与分析
2.1 饲料中不同蛋白水平对黄鳝血清雌二醇含量的影响
试验期间,黄鳝血清雌二醇含量的变化如图1所示。由图1可见,繁殖季节后,从8月份开始,各试验组中雌二醇的含量都呈下降趋势,并且刚开始时下降的速率较快随后减慢。雌二醇含量在第二年1月份达到最低值,越冬后雌二醇含量开始上升,在繁殖季节前迅速上升,在第二年5月份达到最大峰值,随后开始下降。
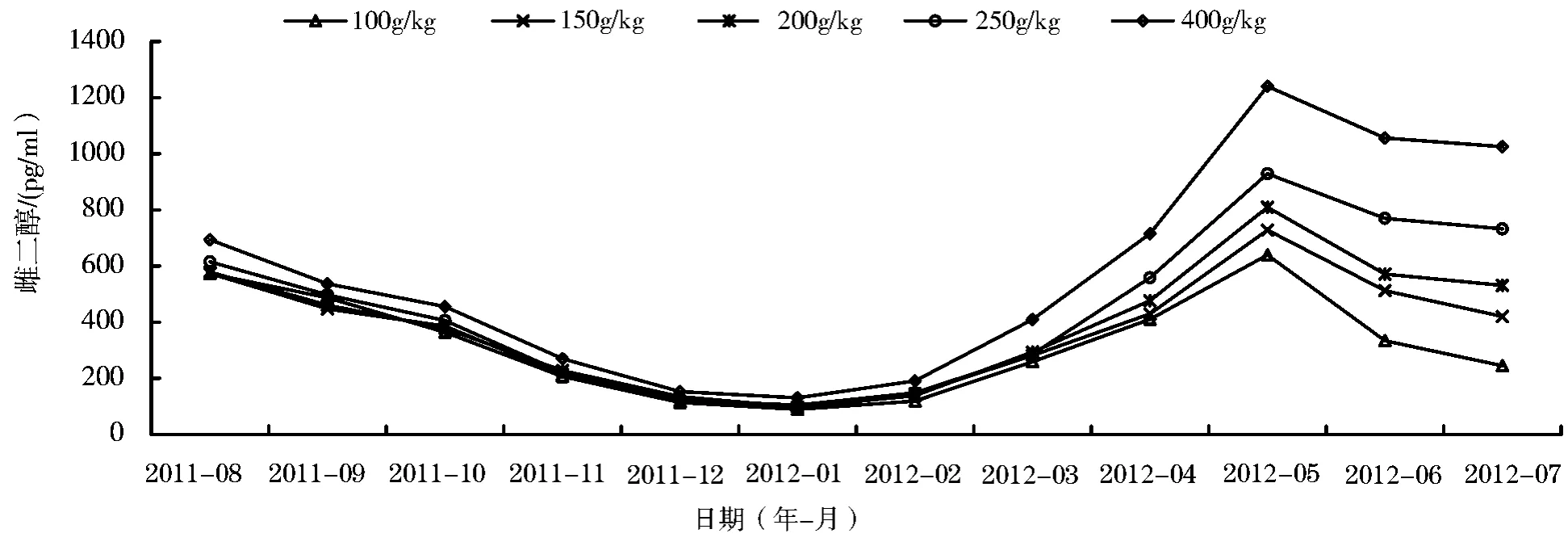
图1 不同月份不同饲料蛋白水平下的黄鳝血清雌二醇含量
2.2 不同蛋白水平对黄鳝血清睾酮含量的影响
试验期间,黄鳝血清睾酮含量的变化如图2所示。有图2可见,繁殖季节后,从8月份开始,各试验组中睾酮的含量呈下降趋势,刚开始时下降的速率较快随后减慢。在越冬季节睾酮含量达到最低值,并且12月和第二年1月份血清中睾酮的含量都检测不到,越冬后睾酮含量开始上升,在繁殖季节前上升迅速,在第二年6月份达到最大峰值,随后迅速下降。

图2 不同月份不同饲料蛋白水平下的黄鳝血清睾酮含量
不同蛋白水平的饲料对黄鳝血清雌二醇和睾酮都有显著的影响 (表2)。对照组中黄鳝血清雌二醇含量显著性地高于其他各试验组,而投喂蛋白含量为100、150g/kg 和 200g/kg 的 3 组 与150、200g/kg和250g/kg的3组间血清雌二醇均没有显著性差异;对照组中睾酮含量显著性低于各处理组,蛋白含量为100g/kg组的睾酮含量显著性地高 于 200、250g/kg 和 400g/kg 处 理组,但是蛋白含量为200g/kg和250g/kg的2组间没有统计学差异。
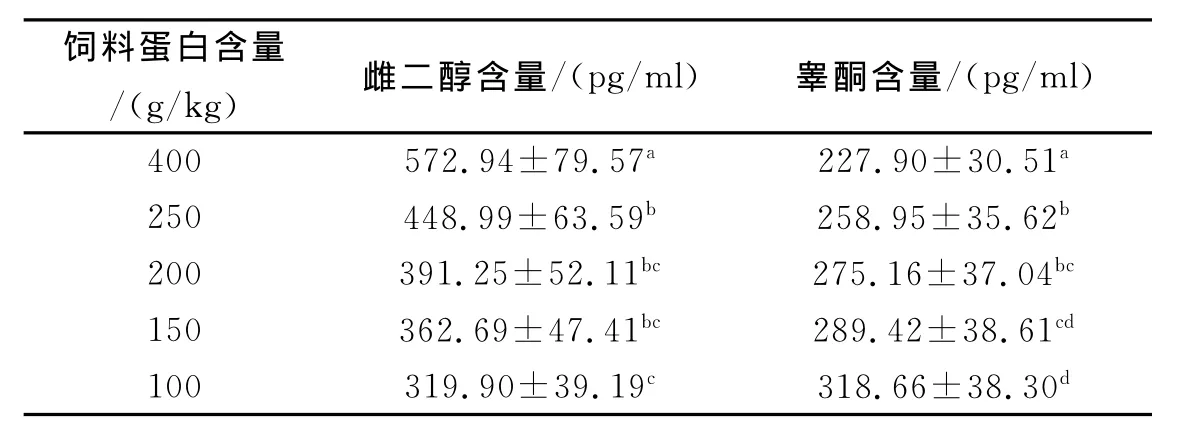
表2 不同蛋白水平对雌二醇和睾酮含量的方差分析
2.3 不同蛋白水平和月份交互作用对黄鳝血清雌二醇和睾酮含量的影响
鉴于黄鳝雌二醇和睾酮具有季节性差异,本研究对不同蛋白水平和不同月份的对黄鳝血清雌二醇和睾酮的交互作用进行了分析 (表3)。结果表明,不同蛋白水平对雌二醇和睾酮含量都有显著性影响。不同蛋白水平、不同月份和两者的交互作用,三者均对黄鳝血清雌二醇和睾酮含量的影响均呈显著性。
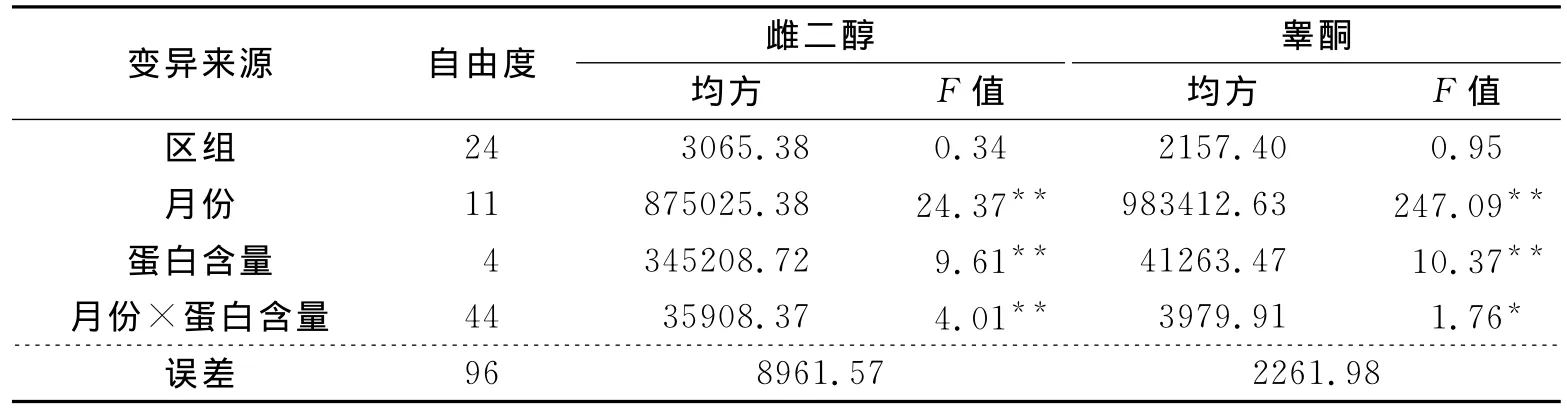
表3 蛋白含量和月份交互作用对黄鳝血清雌二醇和睾酮含量的影响分析
3 讨论
本研究结果表明,黄鳝血清雌二醇和睾酮含量在繁殖周期内有着相似的变化规律。繁殖季节后,各试验组中雌二醇和睾酮的含量都呈下降趋势,并且刚开始时下降的速率较快随后减慢,并在越冬期间达到低谷;越冬期之后,两者含量开始上升,在繁殖季节达到高峰,这与宋平等[7]报道的结果相似。本研究结果表明,饲料的蛋白水平影响黄鳝血清雌二醇和睾酮的含量,雌二醇含量随着饲料中蛋白水平的升高而升高,而睾酮的含量则随着蛋白含量的升高而降低。
性类固醇激素在鱼类的性别分化过程中起着十分重要和特殊的作用。很多关于性类固醇激素调节硬骨鱼的配子生成的研究表明,卵巢产生的雌激素主要调节卵母细胞的生长发育,而精巢产生的雄激素主要调节精子发生[9]。睾酮是11-氧睾酮和雌二醇的前体,在性别分化过程中起着十分重要的作用,也可以反映性别分化的过程;雌二醇被认为是雌鱼中重要的性类固醇激素,在脊椎动物的胚胎发育特别是性别分化过程中起着十分重要的作用[10-11]。雌二醇还被认为是控制性腺发育生理过程和诱导卵黄蛋白质合成的物质[12]。
本研究结果表明,黄鳝血清雌二醇含量随着蛋白质水平的升高而增加,而睾酮含量则降低;二者在繁殖季节前和繁殖期都快速升高。这意味着类固醇激素作为内源性物质在配子发生过程中起着重要作用,类固醇激素在配子形成时瞬间升高反映了类固醇激素作为内源性调节物质在繁殖过程中起着重要的作用。Bogart[13]认为性别分化是由雄性激素和雌性激素的比例决定的,这个比例高则发展为雄性,反之则发展为雌性。性别分化在其他一些物种中也与这个比例有关[14]。
[1]Liem K F.Geographical and taxonomic variation in the pattern of natural sex reversal in the teloest fish order Synbranchiformes[J].Journal of Zoology,1968,156:225-238.
[2]杨代勤,陈 芳,阮国良,等.黄鳝性转变与体重、年龄的关系 [J].长江大学学报 (自然科学版)农学卷,2008,5(4):45-47.
[3]Tao Y X,Lin H R,Kraak G V D,et al.Hormonal induction of precocious sex reversal in the ricefield eel,Monopterusalbus[J].Aquaculture,1993,118:131-140.
[4]肖亚梅,刘 筠.黄鳝由间性发育转变为雄性发育的细胞生物学研究 [J].水产学报,1995,19(4):297-304.
[5]Huang X,Guo Y Q,Shui Y,et al.Multiple alternative splicing and differential expression ofdmrt1during gonad transformation of the rice field eel[J].Biology of Reproduction,2005,73:1017-1024.
[6]Song H J,Zhou F,Xia L X,et al.Construction of a BAC library and identification ofDmrt1gene of the rice field eel,Monopterusalbus[J].Biochemical and Biophysical Research Communications,2006,348:775-780.
[7]宋 平,熊全沫.黄鳝血清睾酮和雌二醇含量周年变化规律的研究 [J].武汉大学学报 (自然科学版),1993,(2):115-119.
[8]杨代勤.黄鳝营养需要与消化酶的研究 [D].武汉:华中农业大学,2002.
[9]Nagahama Y.17α,20β-Dihydroxy-4-pregnen-3-one,a maturation-inducing hormone in fish oocytes:Mechanisms of synthesis and action [J].Steriods,1997,62:190-196.
[10]Chang C F,Hung C Y,Chiang M C,et al.The concentrations of plasma sex steroids and gonadal aromatase during controlled sex differentiation in grey mullet,Mugilcephalus[J].Aquaculture,1999,177,37-45.
[11]Piferrer F.Endocrine sex control strategies for the feminization of teleost fish[J].Aquaculture,2001,197 (1-4):229-281.
[12]Blaise C,GagnéF,Pellerin J,et al.Determination of vitellogenin-like properties inMyaarenariahemolymph(Saguenay Fjord,Canada):apotential biomarker for endocrine disruption [J].Environmental toxicology,1999,14:455-465.
[13]Bogart M H.Sex determination:A hypothesis based on steroid ratios[J].Journal of Theoretical Biology,1987,128:349-357.
[14]Rougeot C,Krim A,Mandiki S N M,et al.Sex steroid dynamics during embryogenesis and sexual differentiation inEurasian perch,Percafluviatilis[J].Theriogenology,2007,67:1046-1052.Eel,Monopterusalbus(Zuiew)
