马铃薯皮中黄酮类物质测定及含量
2013-04-13张薇赵杰郭家骏文志勇
张薇,赵杰,郭家骏,文志勇
(1.湖南农业大学理学院,湖南长沙410128;2.东方科技学院,湖南长沙410128)
栽培生理
马铃薯皮中黄酮类物质测定及含量
张薇1*,赵杰1,郭家骏2,文志勇1
(1.湖南农业大学理学院,湖南长沙410128;2.东方科技学院,湖南长沙410128)
以马铃薯皮为试验材料,研究了黄酮类化合物提取方法,获得了提取马铃薯皮中黄酮类化合物的最佳条件,测量了马铃薯皮中体现抗氧化性的黄酮类化合物的含量。试验中,对马铃薯皮中黄酮类化合物进行了提取、分离,以1,1-二苯基-2-三硝基苯肼(1,1-Diphenyl-2-picrylhydrazyl radical 2,2-Diphenyl-1-(2,4,6-trinitrophenyl) hydrazyl,DPPH)的清除率作为马铃薯皮中提取的黄酮类化合物含量及抗氧化活性的评价指标。通过单因素试验,确定提取溶剂、温度、时间、料液比等对提取结果的影响程度。并在单因素试验的基础上设计4因素3水平的正交试验,从而确定马铃薯皮中黄酮类化合物的最佳提取条件。结果表明,马铃薯皮中黄酮类抗氧化物的提取最佳条件为50℃的温度下用80%丙酮溶液按照料液比1∶10的比例提取,提取时间为3 h。在此条件下测得DPPH的清除率为84.62%。在最佳提取条件下提取马铃薯皮中黄酮类化合物,并测得每克烘干后的马铃薯皮中含有约10.95 mg的黄酮类物质,与其它类果实果皮中具有相似的抗氧化活性的黄酮类物质的含量相比明显较高。
马铃薯皮;DPPH;黄酮类;提取方法;抗氧化物质
马铃薯皮中含有丰富的抗氧化物质。其中抗氧化物质主要为黄酮类、多酚类和原花青素等,其中主要的抗氧化物质为黄酮类抗氧化物质,它是一种天然的抗氧化剂,对人体具有抗肿瘤、延缓衰老、增强心血管功能,能治疗慢性前列腺炎,增强免疫力,调解内分泌系统,并有护肝、抗炎、抗过敏、抑菌、抗病毒等重要的生理保健功效[1-14]。是广泛用于生物制药工业的廉价天然抗氧化剂,可取代部分目前常用的合成抗氧化剂。若是将皮中的黄酮类物质加以开发和利用,不但可以减少资源的浪费,还可以为马铃薯的加工业提供新的出路。
本研究主要进行马铃薯皮中黄酮类化合物提取、分离、测定及其抗氧化活性的测定。在单因素试验的基础上,以溶剂浓度、提取温度、料液比、提取时间为因素,通过正交试验确定马铃薯皮中黄酮类化合物提取的最佳条件,用丙酮溶液对马铃薯皮中的黄酮类化合物进行提取,用聚酰胺柱层析法对其进行分离和纯化,用紫外可见分光光度法进行定性定量分析,获得马铃薯皮中黄酮类化合物的含量。马铃薯皮中黄酮类化合物抗氧化测试,以1,1-二苯基-2-三硝基苯肼(1,1-Diphenyl-2-picrylhydrazyl radical 2,2-Diphenyl-1-(2,4,6-trinitrophenyl) hydrazyl,DPPH)的清除率作为马铃薯中黄酮类化合物抗氧化活性的评价指标进行抗氧化活性测定。本研究为实现对马铃薯皮中黄酮类化合物深度开发和产业化研究打下基础,将产生巨大的经济效益。黄酮类化合物的研究还需要关注生物利用度、代谢动力学、体内的氧化损伤、长期服用产生的慢性后果等。本研究为开发出可靠的、令人信服的系统以精确评估其在人体内的代谢作用是十分必要的。因此,研究马铃薯皮中抗氧化物质具有重要的意义和广阔的发展前景。
1 材料与方法
1.1 材料
马铃薯块茎购自湖南省长沙市马王堆菜市场。
1.2 主要仪器与试剂
主要仪器:UV-2100紫外分光光度计(德国莱伯泰科(北京)有限公司)。
主要试剂:芦丁(标样,AR,湖南省药品检验局)、DPPH(AR,美国Sigma公司)、无水乙醇(AR)、丙酮(AR)、甲醇(AR)、氢氧化钠(AR)、亚硝酸钠(AR)、九水硝酸铝(AR)、聚酰胺树脂等。
5%亚硝酸钠的制备:取0.535 g的99%亚硝酸钠,加入10 mL蒸馏水制得。
10%硝酸铝的制备:取2.175 g的99%九水硝酸铝,加入10 mL蒸馏水制得。
10%氢氧化钠的制备:取11.554 g的96%氢氧化钠,加入100 mL蒸馏水制得。
1.3 方法
1.3.1 马铃薯皮黄酮类物质提取
取马铃薯块茎皮(厚2 mm)22 g,切块,破碎,称取10 g于三角瓶中,然后用80%丙酮溶液于50℃下浸提黄酮类物质,提取3 h,再于50℃下超声波提取30 min后,过滤,滤液在旋转蒸发仪中浓缩至约23 mL,用200 mL水溶解上聚酰胺柱,先用5倍柱体积的水洗脱,弃去,再用60%的乙醇溶液5倍体积进行洗脱,收集并浓缩至干,得马铃薯皮总黄酮粗样品。
1.3.2 抗氧化试验
DPPH分子式C18H12N5O6,分子量394.32,是暗紫色大棱柱形晶体。DPPH是一种稳定的自由基,在517 nm处有一强吸收,其乙醇溶液呈深紫色。当有自由基清除剂存在时,由于与其单电子配对而使其吸收逐渐消失,其褪色程度与其接受的电子数量成定量关系,因而可用分光光度法进行定量分析。以对DPPH的清除率作为马铃薯提取物抗氧化活性的评价指标。DPPH清除率的计算:

式中(DPPH)t:t时刻体系中DPPH的浓度;(DPPH)0:0时刻体系中DPPH的起始浓度。
DPPH标准曲线的制作:准确称取DPPH 0.0075 g用甲醇定容至10 mL的容量瓶中,得浓度为0.75 mg/mL的DPPH溶液。分别移取0.40,0.80,1.20,1.60,2.00和2.40 mL浓度为0.75 mg/mL的DPPH溶液,用甲醇溶解定容至100 mL,得浓度为0.003(1号),0.006(2号),0.009(3号),0.012(4号),0.015(5号)和0.018 mg/mL(6号)DPPH溶液。在517 nm处分别测吸光度,以标准品浓度为横坐标,以吸光度A为纵坐标作标准曲线见图1,得出其回归方程为y=26.324x+0.0076,r2=0.9998。
分别对不同提取溶剂、不同提取温度、不同提取时间、不同料液比和不同提取次数提取得到的抗氧化物质进行清除DPPH的活性测定。以对DPPH的清除率作为马铃薯提取物抗氧化活性的评价指标。
马铃薯皮中抗氧化物质提取正交试验在单因素试验的基础上,以溶剂浓度、提取温度、料液比、提取时间为因素,DPPH的清除率为指标,正交试验确定马铃薯中抗氧化物质提取的最佳组合。
1.3.3 黄酮类物质含量的测定

图1 DPPH标准曲线Figure 1 DPPH standard curve
黄酮类化合物广泛存在于生物界,分子中含有酚羟基及吡喃酮环,由于这些结构单元,使得黄酮类化合物可以与铝盐、铅盐、镁盐、锆盐等试剂反应,产生有色络合物,可采用紫外可见分光光度法定性定量测定黄酮类化合物。本试验在最佳提取方案下提取马铃薯皮中黄酮类化合物,以芦丁为标准样品,用紫外可见分光光度法测出马铃薯皮中黄酮类物质的含量。
芦丁标准曲线的绘制:准确称取芦丁标样0.0120 g用95%乙醇溶液溶解后转移至100 mL容量瓶中,定容,摇匀,得对照试液B。准确吸取0.00,1.00,2.00,3.00,4.00和5.00 mL,分别置于10 mL的容量瓶中加入5%亚硝酸钠溶液0.3 mL,混匀,放置6 min加入10%硝酸铝溶液0.3 mL,摇匀,放置6 min,加入10%氢氧化钠溶液4 mL,用蒸馏水定容至刻度(浓度分别为0.000,0.012,0.024,0.036,0.048和0.060 mg/mL),摇匀,静置15 min后,在波长513 nm处测吸光度,以标准品浓度为横坐标,以吸光度A为纵坐标做标准曲线见图2,得出其回归方程为:y=10.275 x-0.0471,r2=0.9931
2 结果与分析
2.1 样品抗氧化活性测定
称取0.0060 g DPPH用甲醇溶解定容至250 mL的容量瓶中的,得浓度为0.024 mg/mL的溶液。取样品0.0097 g用甲醇溶解,过滤,将滤液用甲醇定容至10 mL。取样品的甲醇溶液0.2 mL,加入7.8 mL浓度为0.024 mg/mL DPPH甲醇溶液,立即混匀,用分光光度计于517 nm处测定吸光度,分别测定0 min和5 min时的吸光度,其后每隔15 min测一次吸光度直到读数稳定为止(表1)。

图2 芦丁的标准曲线Figure 2 Rutin standard curve

表1 在不同时间段测得DPPH的浓度和吸光度Table 1 Concentration and absorbance of DPPH measured at different times
测定结果表明,在0~20 min测定较好。
2.2 提取液的选择
按表2、表3进行提取液的选择试验。
测定结果表明,用不同的提取液DPPH清除率不同,用80%丙酮提取时DPPH清除率最大。
2.3 温度的选择
按表4、表5进行提取温度的选择试验。
测定结果表明,随着温度变化DPPH清除率在变化,温度60~80℃时DPPH清除率达最大。
2.4 时间的选择
按表6、表7进行提取时间的选择试验。
测定结果表明,用不同的提取时间DPPH清除率不同,用80%丙酮提取2 h DPPH清除率最大。
2.5 料液比的选择
按表8、表9进行提取料液比的选择试验。

表2 提取液的选择Table 2 Extract selection
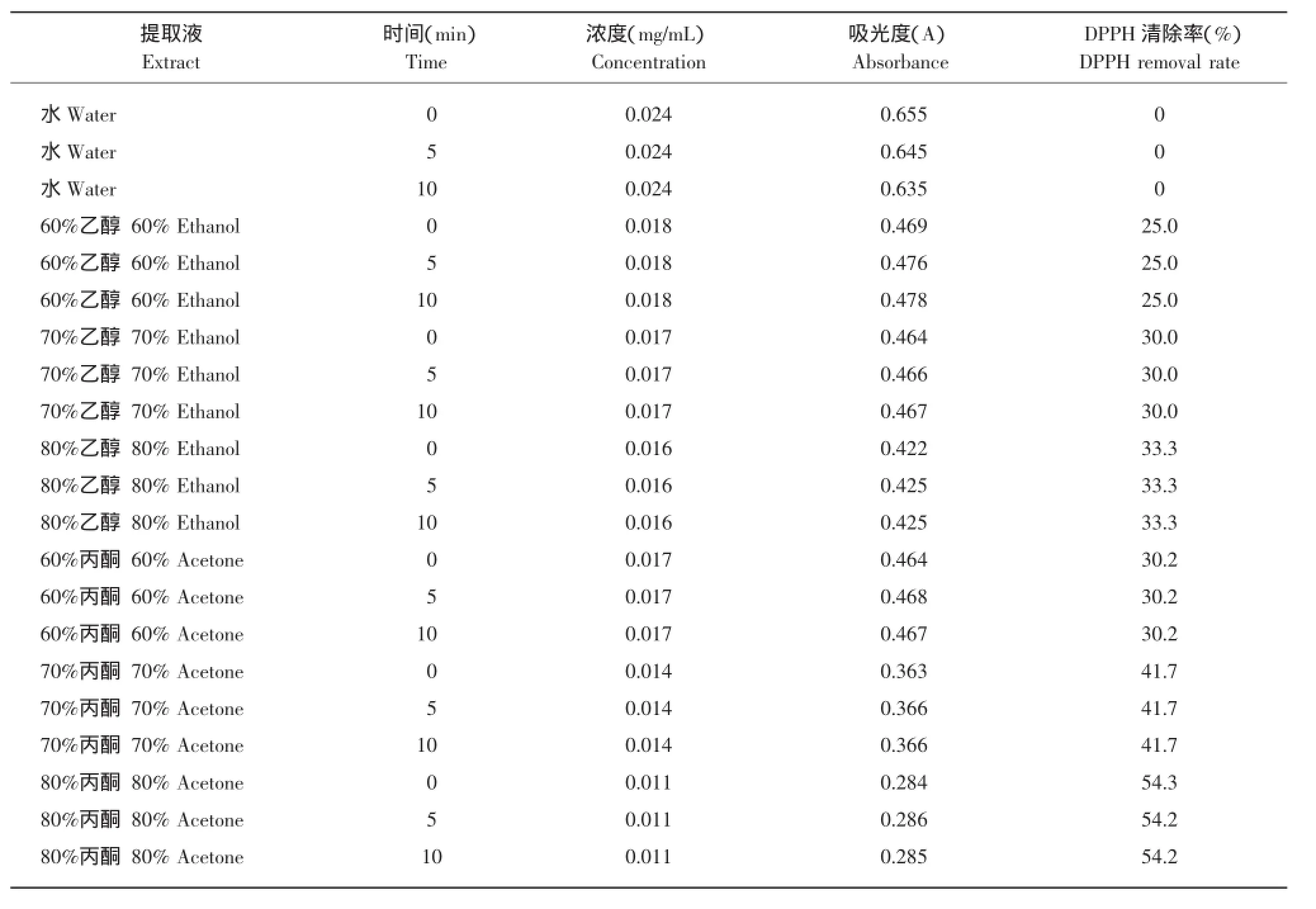
表3 不同提取液在不同时间段测得DPPH的浓度和吸光度Table 3 Concentration and absorbance of DPPH for different extracts measured at different times
测定结果表明,用不同的料液比提取DPPH清除率不同,用80%丙酮料液比为1:20或1:25提取时间2 h DPPH清除率最大。
2.6 提取次数的选择
按表10、表11进行提取次数的选择试验。
测定结果表明,不同的提取次数DPPH清除率变化不大。
2.7 正交试验
在考查了各单因素对马铃薯皮提取物抗氧化性影响的基础上,为了找出各工艺参数的最佳组合,设计了四因素三水平的正交试验(表12)。
根据正交试验确定最佳提取条件为A3B2C1D3,即用80%丙酮、温度50℃、料液比1:10下提取3 h(表13)。

表4 温度的选择Table 4 Temperature selection
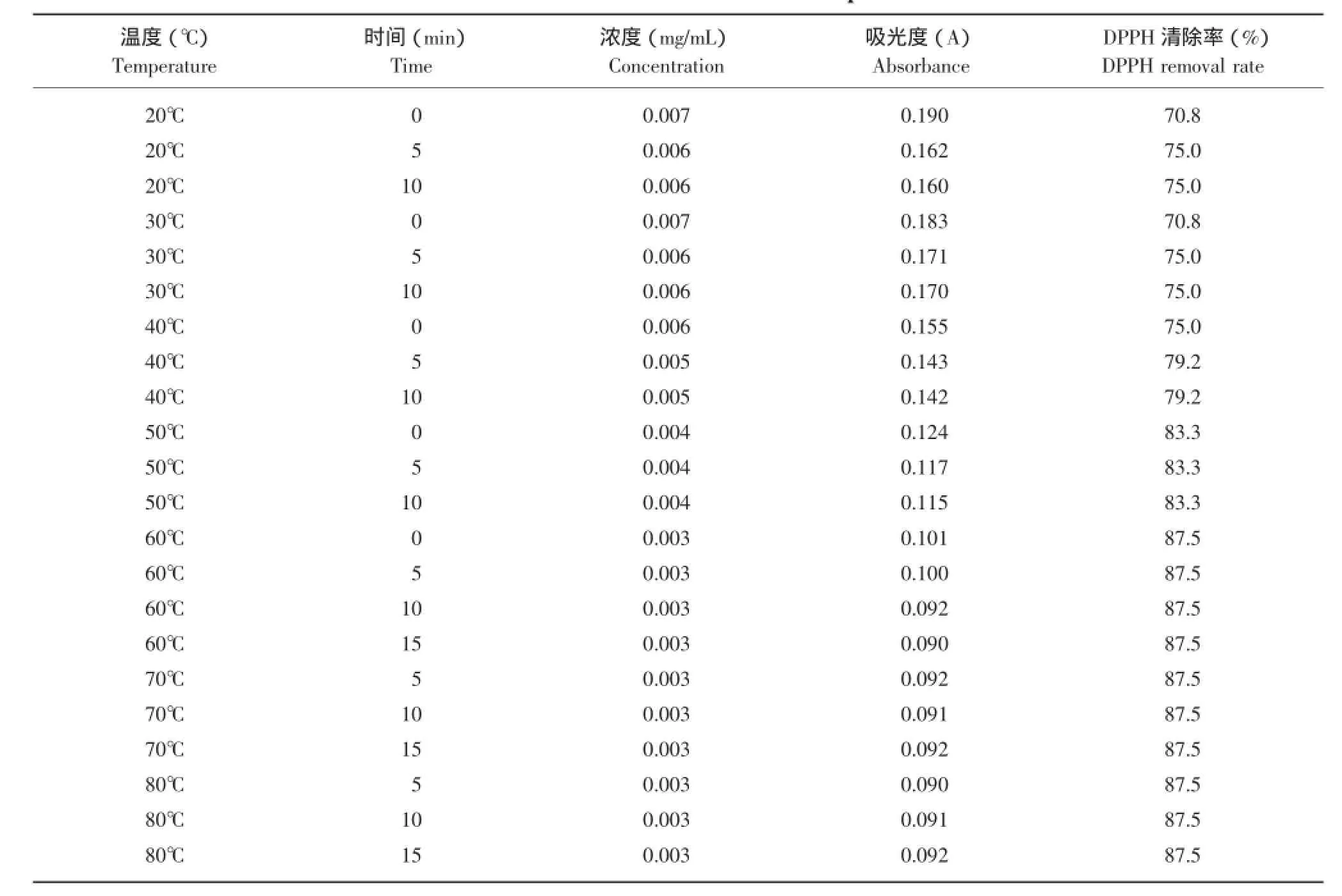
表5 不同温度在不同时间段测得DPPH的浓度和吸光度Table 5 Concentration and absorbance of the DPPH for different temperatures measured at different times

表6 时间的选择Table 6 Time selection
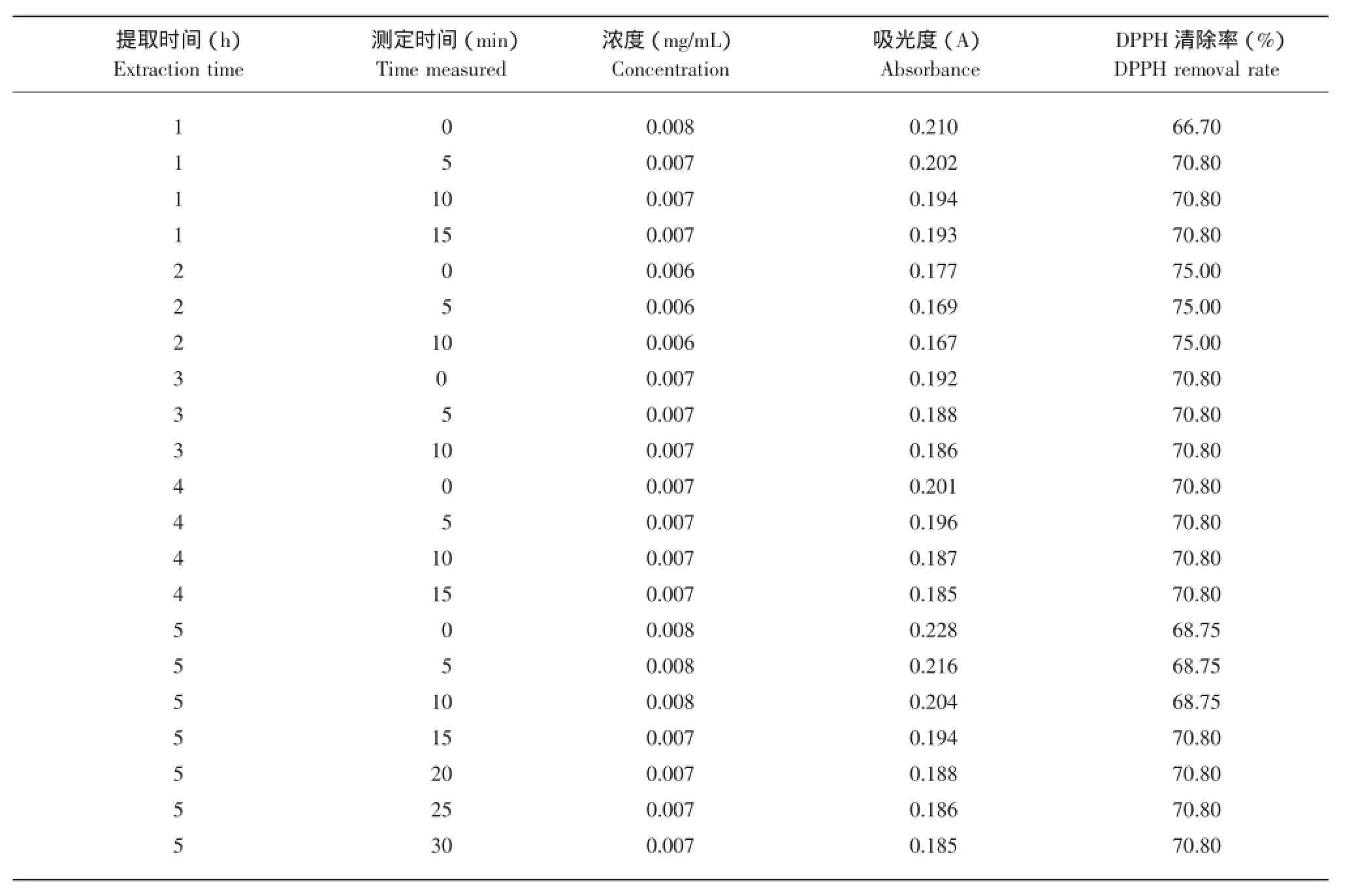
表7 不同提取时间在不同时间段测得DPPH的浓度和吸光度Table 7 Concentration and absorbance of the DPPH for different extraction times measured at different times
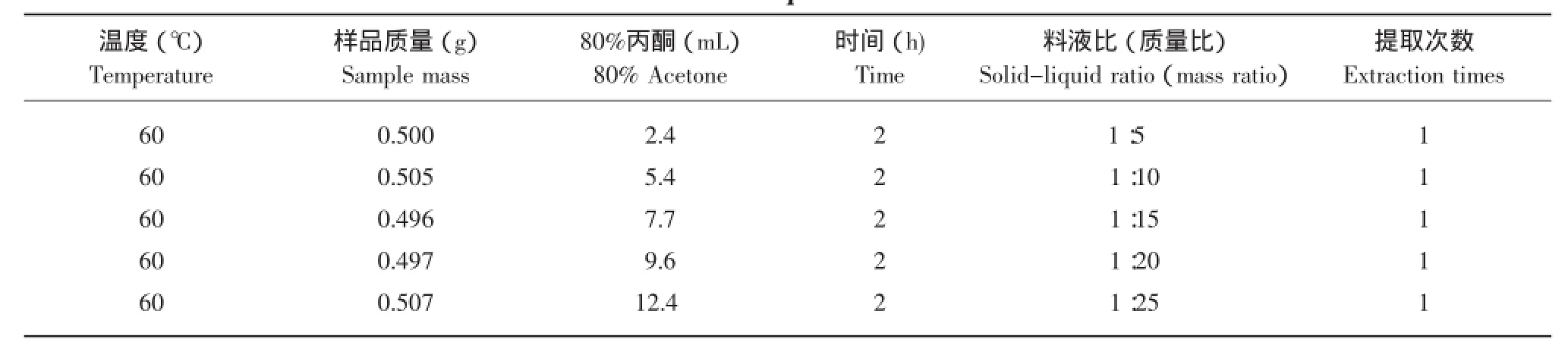
表8 料液比的选择Table 8 Solid-liquid ratio selection

表9 不同料液比在不同时间段测得DPPH的浓度和吸光度Table 9 Concentration and absorbance of DPPH for different soid-liquid ratios measured at different times

续表9:
表10 提取次数的选择Table 10 Extraction times selection

表11 不同提取次数在不同时间段测得DPPH的浓度和吸光度Table 11 Concentration and absorbance of DPPH for different extraction times measured at different times
2.8 马铃薯皮中黄酮类物质含量的测定
2.8.1 马铃薯皮中黄酮类物质的提取
取烘干后的马铃薯皮10.058 g,用100.037 mL的80%丙酮,在温度50℃的条件下超声提取3 h后过滤。将滤液放入旋转蒸发仪中旋干后,再用95%的乙醇溶液定容到250 mL的容量瓶中。得备用液A。
2.8.2总黄酮含量的测定
准确吸取3.00 mL马铃薯提取液A于10 mL容量瓶,加蒸馏水至刻度线。分别精确量取2.00 mL,于3个10 mL容量瓶中,分别再加入5%亚硝酸钠溶液0.3 mL,混匀,放置6 min加入10%硝酸铝溶液0.3 mL,摇匀,放置6 min,加入10%氢氧化钠溶液4 mL,用蒸馏水定容至刻度,摇匀,静置15 min,在513nm处测定吸光度。测得1号浓度为0.018 mg/ mL,吸光度为0.134;2号浓度为0.017 mg/mL,吸光度为0.132;3号浓度为0.019 mg/mL,吸光度为0.147。平均浓度为0.018 mg/mL。每克烘干后的马铃薯皮中含有10.95 mg的黄酮类物质。
3 讨论
本试验通过单因素试验和正交试验,确定了马铃薯皮中抗氧化物提取的最佳工艺。最佳工艺为在50℃下用80%丙酮溶液按照料液比1:10的比例提取时间3 h,并在此条件下测得DPPH的清除率为84.62%。在最佳提取条件下提取马铃薯皮中的黄酮类物质,测得每克烘干后的马铃薯皮中含有10.95 mg的黄酮类物质。较苹果皮中的黄酮类物质的含量1.884 mg/g要高很多,根据其抗氧化性,说明提取马铃薯中的黄酮类物质更有实用价值。而且较苹果皮中的抗氧化物质的抗氧化能力也要高很多[14]。

表12 正交试验因素水平Table 12 Factors and levels in an orthogonal experiment

表13 正交试验结果和极差分析Table 13 Results and range analysis of orthogonal experiment
[1]赵艳红,李建科,赵维,等.常见药食植物提取物体外抗氧活性的评价[J].食品科学.2009,30(3):104-108.
[2]王卓,顾正彪,洪雁.马铃薯渣的开发与利用[J].中国粮油学报, 2007,22(2):138-141.
[3]金莹,孙爱东.苹果多酚清除DPPH自由基活性的研究[J].中国酿造,2006(5):48-51.
[4]李磊,王岳飞,粱燕,等.天然抗氧化物质的保健功能及抗氧化活性研究进展[J].茶叶,2008,34(2):70-74.
[5]龙云飞,龙丽群,杨克迪.山竹果皮提取物抗氧化活性的研究[J].食品工业科技,2010,31(6):127-128.
[6]吴琼英,贾俊强.柚皮黄酮的超声辅助提取物及其抗氧化性研究[J].食品科学,2009,30(2):29-33.
[7]王将,郑亚军,冯翠萍.杏仁皮中黄酮类化合物抗氧化件的研究[J].中国粮油学报,2010,25(1):78-81.
[8]塔娜,李蜀眉,田维甲,等.桔皮中黄酮类化合物抗氧化活性的研究[J].内蒙古农业大学学报,2003,24(2):96-98.
[9]吴琼英,贾俊强.柚皮黄酮的超声辅助提取物及其抗氧化性研究[J].食品科学,2009,30(2):29-33.
[10]徐贵华,胡玉霞,叶兴乾,等.桠柑、温州蜜桔果皮中酚类物质组成及抗氧化能力研究[J].食品科学,2007,28(11):171-175.
[11]龙云飞,龙丽群,杨克迪.山竹果皮提取物抗氧化活性的研究[J].食品工业科技,2010,31(6):127-128.
[12]张泽生,赵璐,牟浩,等.山竹果皮中抗氧化活性物质的提取分离[J].食品研究与开发,2009,30(6):1l-15.
[13]李建科,李国秀,赵艳红,等.石榴皮多酚组成分析及其抗氧化活性[J].中国农业科学,2009,42(11):4035-4041.
[14]王萍,梁坤,杨顶成.苹果皮提取物中抗氧化物质的研究[J].食品工业科技,2007,22(1):27-29.
Determination and Content of Flavonoids in Potato Peel
ZHANG Wei1*,ZHAO Jie1,GUO Jiajun2,WEN Zhiyong1
The procedure for flavonoid extraction from potato peel was studied and optimal conditions determined using potato as experimental material.In the experiment,flavonoids in potato peel was extracted,separated,and evaluated by clearance of 1,1-Diphenyl-2-picrylhydrazylradical2,2-Diphenyl-1-(2,4,6-trinitrophenyl)hydrazyl(DPPH).Through single factor experiments,extraction efficiency was studied under different extraction solvents,temperatures,times,as well as the ratios of solid to liquid.An orthogonal experiment was designed based on changes in 4 factors and 3 levels to determine the best conditions forflavonoid extraction in potato peel.The experimentshowed thatextracted flavonoids in potato peelin 80%acetone solution with the ratio of 1:10 of solid to liquid at 50°C for 3 h could get the ideal result.Under these conditions,the DPPH clearance rate was 84.62%and the contentofflavonoids in dried potato peelwas 10.95 mg/g DW.Potato peelcontained higher flavonoids than otherfruitpeels whichhas a similarantioxidantactivity.
potato peel;DPPH;flavonoid;extraction approach;antioxidant
S532
B
1672-3635(2013)05-0265-08
2013-10-16
湖南省科学技术厅科技计划项目(2012NK3083)。
张薇(1962-),女,教授,主要从事应用化学研究。
张薇,E-mail:zhangwei6261@hotmail.com。
(1.College of Science,Hunan Agricultural University,Changsha,Hunan 410128,China; 2.Oriental Institute of Science and Technology,Changsha,Hunan 410128,China)
