药用百合组织培养快繁技术研究
2013-04-10金亚征俞凤芳车瑞香张荣梅丁丽梅
金亚征,俞凤芳,车瑞香,张荣梅 ,丁丽梅 ,方 华
(1.河北北方学院,河北 张家口 075000;2.廊坊市农业局,河北 廊坊 065000;3.河北省衡水市园林管理局,河北 衡水 053000;4.北京市农业广播电视学校顺义区分校,北京 101300)
药用百合属于百合科Liliaceae百合属LiliumL.植物,是集观赏、食用、药用为一体的多年生草本植物。其花美丽清雅,芳香宜人;其鳞茎是一种极具营养价值的保健品,具有很高的药用价值,可以活血祛瘀、消肿止痛、养血安神,养阴润肺止咳,还能治疗和预防糖尿病等疾病[1]。常规的百合繁殖方法为分球繁殖,因其存在繁殖系数低、种球数量有限、再次感染病毒的机率高等问题,远远不能满足药用百合商品化生产的需求。而利用组织培养技术进行繁殖,既能缩短繁殖周期,增加繁殖系数,又能减少病毒侵害机率。目前对食用和观赏性百合来说,以其鳞片、叶片、茎段、珠芽、花柱、子房和花丝等组织和器官作为外植体进行组织培养的研究均有报道[2-3],其中以鳞片离体培养的繁殖效果最好,成功率最高,所以应用最为广泛[4-7]。文中利用药用百合鳞片作为外植体进行离体培养,研究了药用百合组织培养中鳞茎的诱导、增殖、生根等关键性技术问题,以求找到最佳的离体培养配方,大幅度提高繁殖系数,为药用百合的商品化快繁生产提供理论依据。
1 材料与方法
1.1 试验材料和地点
试验材料:药用百合的当年生子鳞茎。
试验地点:河北北方学院园艺组织培养研究中心。
1.2 研究方法
1.2.1 培养基
采用MS培养基,再添加不同种类、不同浓度配比的激素。
鳞茎诱导培养基:MS+6-BA 0.2~1.0 mg·L-1+NAA 0.2~0.8 mg·L-1。
增殖培养基:MS+6-BA 0.2 mg·L-1+NAA 0.2~1.0 mg·L-1,MS+6-BA 0.2 mg·L-1+ 2,4-D 0.2 ~ 1.0 mg·L-1。
生根培养基:1/2MS+IAA 0.1~0.5 mg·L-1,1/2MS+NAA 0.1~0.5 mg·L-1。
1.2.2 培养条件
培养温度为(25±2)℃,光照强度为1 000~2 000 lx,光照时间为每天12 h。
1.2.3 鳞茎的诱导培养
选择新鲜、洁白、无病斑的当年生子鳞茎(直径为1.5~2.0 cm),洗净泥土,剥取中间层鳞片作为试材。将鳞片用流动的清水洗净泥土,并冲洗5 h,再放入无菌操作室的超净工作台,用药物进行消毒处理,具体的处理方法[2]如下:将洗净的鳞片用75%的酒精浸泡40 s,用无菌水冲洗5 次,再用0.1%的升汞灭菌处理10 min,然后用无菌水冲洗5 次,用灭过菌的滤纸吸干表面水分;小鳞片不进行切割处理,直接进行接种,且将小鳞茎的内侧朝上,成45°角插入培养基中,插入的深度为小鳞片的1/3~1/2。
激素配方采用NAA和6-BA的完全随机设计,共15个处理,处理1到处理15培养基BA的浓度分别是:0.2、0.4、0.6、0.8、1.0、0.2、0.4、0.6、0.8、1.0、0.2、0.4、0.6、0.8、1.0 mg·L-1,处理1到处理15培养基NAA的浓度分别是:0.2、0.2、0.2、0.2、0.2、0.5、0.5、0.5、0.5、0.5、0.8、0.8、0.8、0.8、0.8 mg·L-1;每个处理设4 次重复,每个重复8瓶培养基,每瓶接入3个小鳞片。培养45 d后统计试验结果并按如下公式计算诱导率:
小鳞茎诱导率(%)=分化鳞茎的鳞片总数/接种鳞片总数×100。
1.2.4 鳞茎的增殖培养
待诱导出的小鳞茎芽长到2.0~4.0 cm时,将其分为单株进行增殖培养。基本培养基为MS,激素配方采用BA和2,4-D;6-BA和NAA的完全随机设计,共10个处理,处理1到处理10的培养基里BA的浓度均为0.2 mg·L-1;处理1到处理5的培养基不加2,4-D,NAA的浓度分别为:0.2、0.4、0.6、0.8、1.0 mg·L-1;处理 6到处理10的培养基不加NAA,2,4-D的浓度分别为0.2、0.4、0.6、0.8、1.0 mg·L-1。每个处理4个重复,每个重复8瓶培养基,每瓶接入单株3株。然后在无菌条件下进行增殖试验,45 d后统计试验结果并按如下公式计算增殖率:
鳞茎增殖率(%)=增殖的芽数/接种的总芽数×100。
1.2.5 鳞茎的生根培养
待增殖培养所得的鳞茎长至4.0 cm左右时,分成单株进行生根培养。基本培养基为1/2MS,激素配方采用IAA和NAA的完全随机设计,共10个处理,处理1到处理5的培养基不加NAA,IAA的浓度分别为0.1、0.2、0.3、0.4、0.5 mg·L-1;处理6到处理10的培养基不加IAA,NAA的浓度分别为0.1、0.2、0.3、0.4、0.5 mg·L-1。每个处理4个重复,每个重复8瓶培养基,每瓶接入单株3株。然后在无菌条件下进行生根培养,30 d后统计生根率。
结果调查:鳞茎生根率(%)=生根的株数/接种的总株数×100。
2 结果与分析
2.1 不同培养基配方对药用百合鳞茎诱导分化的影响
经观察,接种15 d后鳞片渐渐变绿,鳞片内侧分化出一些黄绿色的凸起,20 d后这些小凸起便分化成了小鳞茎,50 d后长出小叶,小鳞茎生长很快,60 d后可长成小苗。不同培养基配方对药用百合鳞茎诱导分化的影响如表1 所示。从表1可以看出,BA和NAA对药用百合鳞茎诱导有显著的促进作用,15种培养基均可诱导出鳞茎,经方差分析表明,配方10即MS+1.0 mg·L-1BA+0.5 mg·L-1NAA的诱导率显著高于其他处理,且诱导率达78.1%,每块鳞片的平均鳞茎数最多,达3.6个。图1显示了药用百合鳞茎诱导分化的情况。
2.2 不同培养基配方对药用百合鳞茎增殖的影响
待初代培养的鳞茎长到2.0~4.0 cm时,将其分为单株,移入表2所列培养基中,13 d后芽基部开始出现新生小芽,逐渐形成芽丛,45 d后统计试验结果。不同培养基配方对药用百合鳞茎增殖的影响如表2所示。从表2可以看出,BA加NAA或BA加2,4-D对药用百合小鳞茎增殖有显著促进作用,10种培养基均可增殖,经方差分析,配方3(MS+0.2 mg·L-16-BA+0.6 mg·L-1NAA)和配方7(MS+0.2 mg·L-16-BA+0.4 mg·L-12,4-D)的芽增殖率显著高于其他处理,且增殖率达到了90.6%和93.7%。图2显示了药用百合鳞茎的增殖情况。
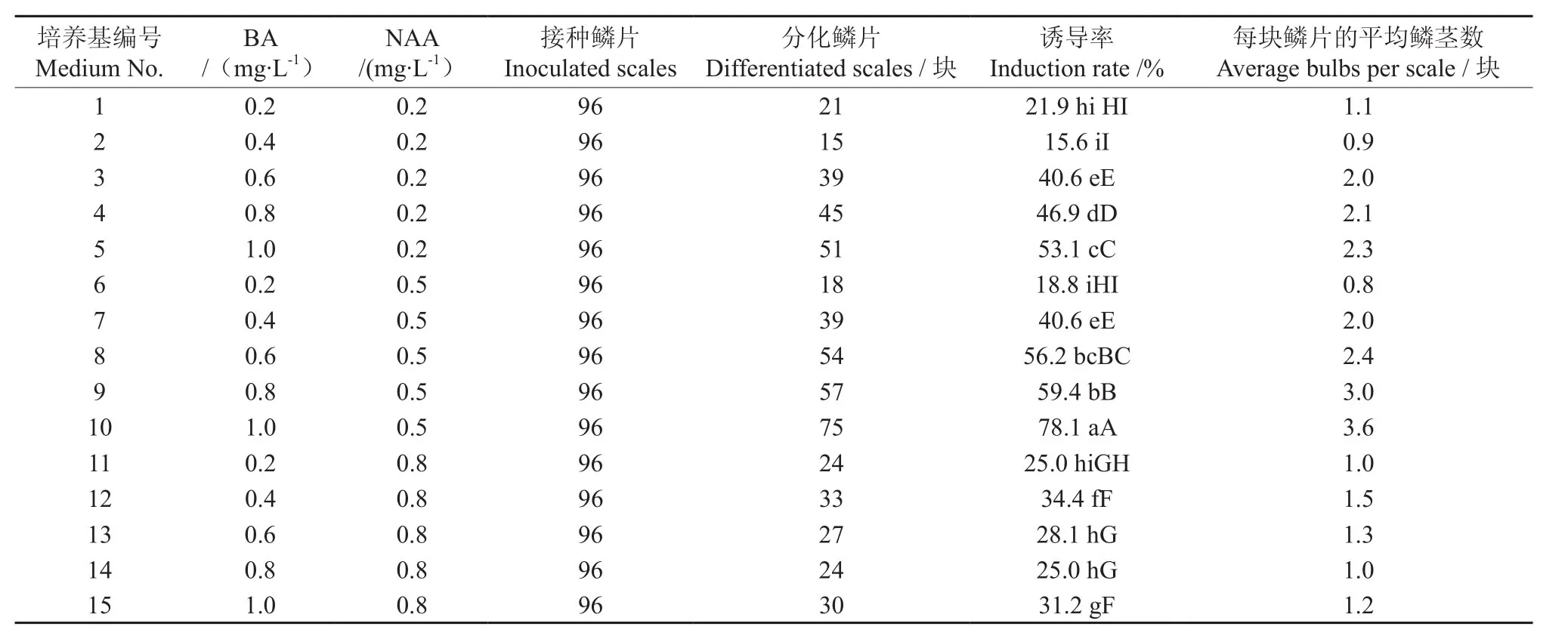
表1 不同培养基配方对药用百合鳞茎诱导分化的影响†Table 1 Effect of different medium formulations on bulb induction and differentiation in medicinal lily
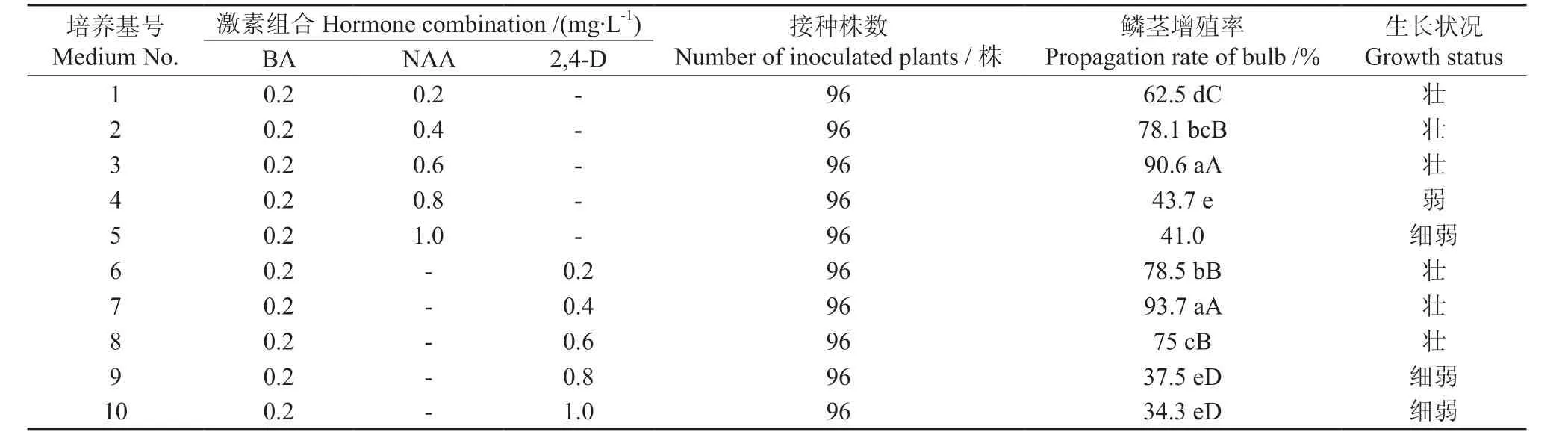
表2 不同培养基配方对药用百合鳞茎增殖的影响†Table 2 Effect of different medium formulations on bulb propagation in medicinal lily

图1 鳞茎诱导分化情况Fig.1 Bulb formation and differentiation status in medicinal lily

图2 鳞茎增殖情况Fig.2 bulblet proliferation status of medicinal lily
由表2还可以看出,在6-BA浓度不变的情况下,相同浓度的2,4-D较NAA更有利于小鳞茎的增殖,且增殖鳞茎的质量也好。故认为最适的鳞茎增殖培养基为7号。
2.3 不同培养基配方对药用百合鳞茎生根的影响
待增殖培养所得的鳞茎长至4.0 cm左右时,分成单株,接入生根培养基中,观察不同培养基配方对生根的影响,不同培养基配方对药用百合鳞茎生根的影响如表3所示。从表3可以看出:10种培养基配方的生根率均都很高,但根系生长情况不同,1/2MS+0.1~0.5 mg·L-1IAA根系生长都很细弱,无根毛产生。1/2MS+0.1~0.5 mg·L-1NAA,不但生根率高而且根系比较壮,大部分有根毛产生。配方7(1/2MS+0.2 mg·L-1NAA)的生根效果最好,其平均生根数达6.3条,且根粗壮,根毛较多,适于移栽。总之,较高浓度的生长素不利于根的诱导,NAA诱导药用百合生根的平均时间较IAA短7.5 d左右,相同浓度的NAA较IAA更有利于根的诱导。图3、图4为药用百合根系的分化、生长情况。
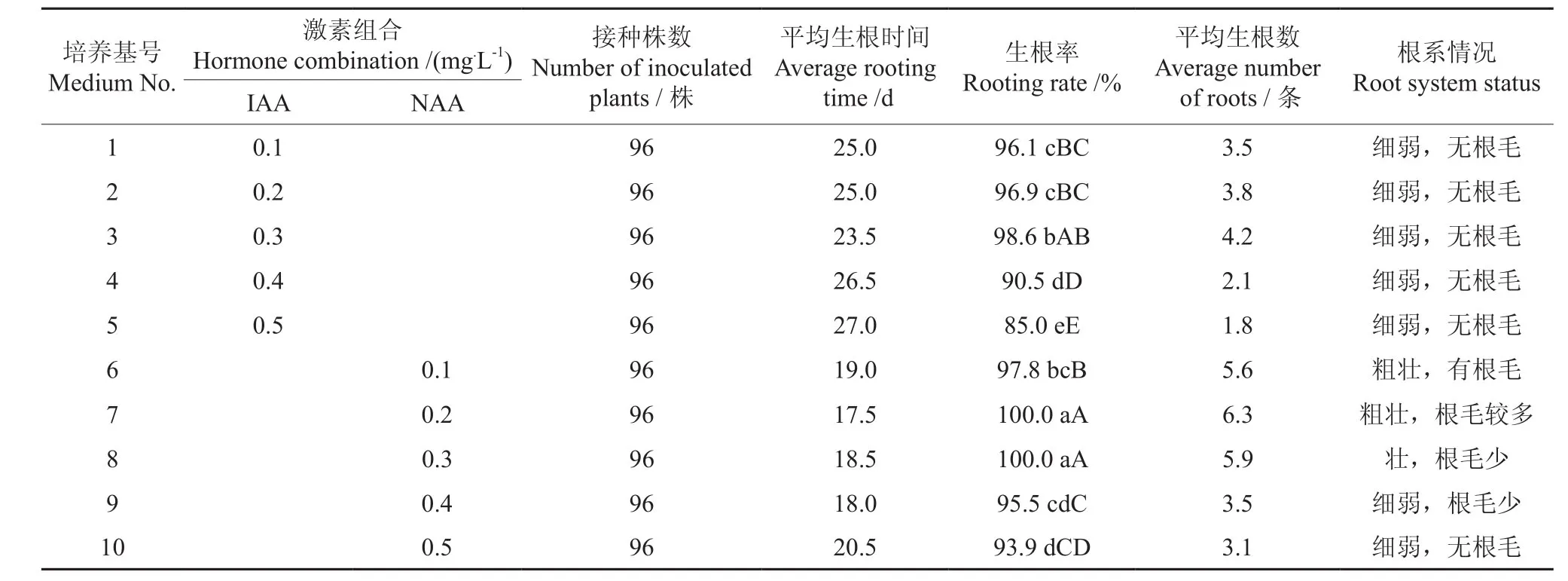
表3 不同培养基配方对药用百合鳞茎生根的影响†Table 3 Effect of different medium formulations on bulb rooting in medicinal lily

图3 根系分化情况Fig.3 Root system differentiation status

图4 根系生长情况Fig.4 Root system growth status
3 结论与讨论
本试验结果1即试验一的配方10(MS+1.0 mg·L-16-BA+0.5 mg·L-1NAA)是药用百合最适宜的鳞茎诱导培养基配方。前人研究中所用的鳞片大都是成熟的鳞茎[8],并经过低温处理解除休眠的,切取鳞片的中下部作为外植体[9],本试验所用的外植体是从正在生长的植株上采集的当年生子鳞茎(直径约1.5~2.0 cm)上的小鳞片,不经过切块,直接插入培养基。这种方法省去了鳞茎低温处理过程,不用切割,操作简单,而且新生的子鳞茎非常干净,消毒容易。
本试验结果2即试验二的配方3(MS+6-BA 0.2 mg·L-1+NAA 0.5 mg·L-1)或试验二的配方7(MS + 6-BA 0.2 mg·L-1+ 2,4-D 0.4 mg·L-1)是药用百合鳞茎增殖最适宜的培养基配方。本试验结果与前人研究具有相似之处,即NAA和2,4-D对小鳞茎的增殖具有明显的促进作用,但随着浓度的不断升高,小鳞茎增殖率明显下降[10]。
本试验结果3即试验三的配方7(1/2MS+NAA 0.2 mg·L-1)是药用百合芽生根的最适宜的培养基配方。与前人也有相似之处:一般的生根培养用1/2MS 培养基,并附加NAA[11]。本试验用1/2MS 培养基并附加NAA,诱导出的根短且粗壮,有根毛,移栽后易成活;而用1/2MS 培养基并附加IAA的培养基诱导出的根长且细弱,无根毛,移栽后成活率低,说明NAA诱导生根的效果要好于IAA。
综上所述,药用百合鳞茎诱导的最佳培养基配方是 MS+6-BA1.0 mg·L-1+ NAA0.5 mg·L-1;药用百合小鳞茎增殖最佳的培养基配方是MS+6-BA 0.2 mg·L-1+ NAA 0.6 mg·L-1和 MS +6-BA 0.2 mg·L-1+ 2,4-D 0.4 mg·L-1;药用百合小鳞茎生根的最佳的培养基配方是1/2MS+NAA 0.2 mg·L-1。
参考文献:
[1]郭朝晖,蒋生祥.中药百合的研究和应用[J].中医药学报,2004,(3):85-88.
[2]蒋细旺,司怀军.百合的组织培养技术综述[J].湖北农业科学,2004(1):78-82.
[3]关文灵,李叶芳,杨 德,等.云南大百合花器官的组织培养技术研究[J].西部林业科学,2009,38(2):12-16.
[4]李冰华,金晓玲,刘雪梅,等.香水百合鳞片组织培养再生体系的建立[J].江苏农业科学,2008(4):83-85.
[5]邹迎春,覃大吉,魏代俊,等.东方百合组培快繁技术研究[J].湖北民族学院学报(自然科学版),2009,27(4):448-451.
[6]张利萍.新铁炮百合的组织快繁技术研究[J].防护林科技,2010,(6):29-30.
[7]PAN You-zhao,ZHAO Yu-ying. Different Explants ofLilium lancifoliumHave Different Potential to Differentiate and Regenerate in Tissue Culture[J]. Agricultural Science &Technology,2011,12(10):1437-1440.
[8]陈为民,宋为民.卷丹和青岛百合的组织培养及植株分化[J].植物生理,1982,(2):352-358.
[9]王 刚,杜 捷. 兰州百合和野百合组织培养及快速繁殖研究[J].西北师范大学学报,2002,38(1):692-695.
[10]孟 杨,潘佑找,贾姗姗,等.湖北百合的组织培养技术研究[J].安徽农业科学,2006,34(17):447- 450.
[11]赵祥云,程 谦,邢尤美,等. 百合珠芽组培及脱毒研究[J].园艺学报,1993,20(3):284-288.
