茚三酮参与的多组分反应合成螺杂环化合物的研究进展
2013-04-08孙立科
孙立科
(中国石化股份有限公司 北京燕山分公司,北京 102500)
茚三酮参与的多组分反应合成螺杂环化合物的研究进展
孙立科
(中国石化股份有限公司 北京燕山分公司,北京 102500)
茚三酮代替芳香醛参与多组分反应合成螺杂环化合物的研究进展还未见文献报道.鉴于此,为了更好地了解这方面的最新动态,综述了2005年以来利用茚三酮代替芳香醛参与多组分反应来合成相关螺吡喃化合物的研究进展,主要涉及茚三酮与丙二腈和环酮的多组分反应、茚三酮与两分子β-二酮的多组分反应、茚三酮、茚二酮与萘胺的多组分反应、茚三酮、肌氨酸与其它底物的多组分反应以及茚三酮与苯肼和芳香醛的三组分反应。同时对其发展方向加以展望。
茚三酮;多组分反应;螺杂环化合物
前言
螺(杂)杂环化合物表现出相当高的生物活性[1~3],是许多药物和天然生物碱的重要片段[4~5]。在这方面,丁研等综述了近年来具有抗菌活性的螺环化合物的研究进展[6]。鉴于此,设计合成各式具有螺环结构的分子一直是有机合成化学的一个热点[7~9]。2006年,Pradhan综述了关于螺(杂)环化合物合成的研究进展[10],其中,多组分反应为该类物质的合成提供了一种高效、便捷的途径。
多组分反应合成的研究工作已经开展了近百年,大多数的反应是以芳香醛为底物与各种活性物种之间进行的缩合反应来展开的[11-13],可以描述为一分子醛与几分子含活性氢物种之间发生的缩合反应。最近研究发现,靛红、茚三酮等化合物可以代替芳香醛发生多组分反应合成各种螺杂环化合物。例如,郭红云等[14]综述了靛红代替芳香醛参与的多组分反应合成螺环化合物的研究进展。2012年,Singh和Desta[15]综述了利用靛红分子设计合成螺环稠环基本骨架的研究进展。然而,关于茚三酮代替芳香醛参与多组分反应合成螺杂环化合物的研究进展还未见文献报道。为了更好地了解这方面的最新动态,本文对近几年茚三酮代替芳香醛参与的多组分反应合成相关螺杂环化合物的最新研究进展进行了综述。
1 茚三酮、丙二腈与环酮等活性组分参与的多组分反应
丙二腈分子内含有两个有强吸电子的氰基官能团,使得丙二腈分子中亚甲基位置活性很高,可以和茚三酮发生Knoevenagel缩合,而且氰基的碳氮三键活性也很高,很容易发生亲核加成反应、环化和消去等反应,因此是一个理想的多组分反应底物。
2005年,Shaker等[16]报道了在无溶剂微波辐射条件下茚三酮、丙二腈和1,3-环二酮“三组分一锅反应”,高收率合成了螺环1,3-二氧代茚满吡喃衍生物(式1)。根据这一反应结果,作者探索了反应的机理,具体的合成路径还有待进一步研究。

式1
随后又进行了其它不同活性物质参与的反应,发现在相同条件下1,3-咪唑二酮、2-吲哚酮、3-甲基吡唑酮和巴比土酸衍生物也具有较好的活性,得到相应的螺环1,3-二氧代茚满吡喃衍生物(式2)。此方法具有反应时间短,收率高,绿色环保等优点,扩大了茚三酮在“多组分一锅反应”的应用。
2010年,Ghahremanzadeh等[17]实现了茚三酮,丙二腈和4-羟基-6-甲基-2H-吡喃-2-酮的“三组分一锅反应”合成得到了螺环1,3-二氧代茚满吡喃衍生物,其收率为65%(式3)。该反应也是以p-TSA为催化剂,在水相中进行反应,具有环境友好、操作简便等优点。
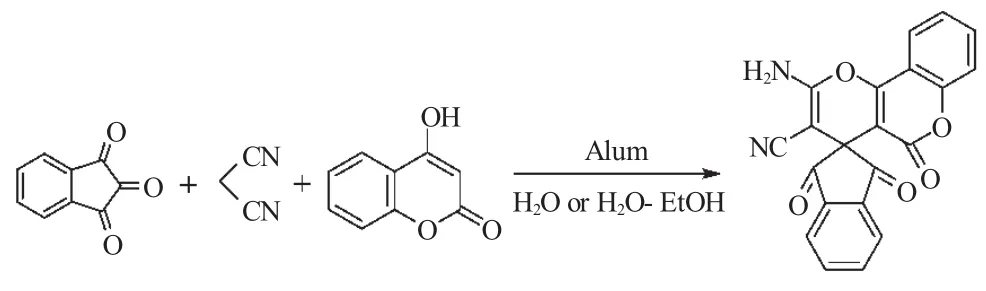
同一年,Karimi等[18]在研究了靛红参与的多组分反应合成螺环化合物的基础上,进一步研究了水合茚三酮、丙二腈与具有反应活性的4-羟基香豆素组成的“三组分一锅反应”合成螺环1,3-二氧代茚满吡喃衍生物(式4)。该反应首次使用明矾(KAl (SO4)2·12H2O)来代替氯化三乙基苄基铵作为有效的催化剂,在以H2O或H2O-EtOH作为溶剂,反应温度25℃条件下,高收率得到了相应的螺环化合物(收率为92%)。这一合成方法具有反应条件温和,污染少等特点。

式2

式3
式4
2011年,He等[19]在前人研究基础上发现用NaHCO3作为催化剂在乙醇回流条件下,茚三酮,丙二腈和一些1,3-环二酮同样可以有效地合成这类螺环1, 3-二氧代茚满吡喃衍生物(式5)。该合成方法具有催化剂廉价易得,操作简单,收率高等优点。

式5
另外,作者也尝试使用4-羟基香豆素作为一种反应组分来进行类似反应的研究(式6)。令人满意的是,4-羟基香豆素也同样适合于这一反应条件,得到相应的螺杂环化合物,其收率为82%。

式6
同年,郭红云等[20]利用碱性离子液体[Bmin][OH]作为催化剂,也进行了上述的茚三酮、丙二腈和1,3-环二酮的“三组分一锅反应”,在较短的反应时间(15~20min)获得了很好的产品收率(81%~94%)(式7)。该方法条件温和,操作简单,后处理方便,反应时间短,对环境友好,且催化剂可以方便地回收,循环使用4次其催化活性并没有显著降低。

式7
在此研究基础上,作者又尝试用2-萘酚和8-羟基喹啉(式8)取代1,3-环二酮参与该反应,结果得到了氰基水解并在醇中酯化后的产物。该反应中,如果是用甲醇为溶剂得到的是甲酯产物,在乙醇中则得到了乙酯的产物。
2012年,Khurana[21]发现在以聚乙二醇(PEG)稳定的镍纳米颗粒(Ni nanoparticles)为催化剂,乙二醇为溶剂的条件下,茚三酮、丙二腈和1,3-环二酮化合物可以在室温下发生“三组分一锅反应”得到了一系列螺环1,3-二氧代茚满吡喃衍生物(4)(式9)。这一新的合成方法具有反应条件温和、收率高(收率均在88%以上)和反应时间短(5~20min)等优点。

式9
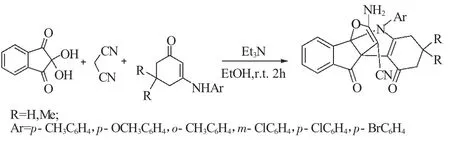
2013年,Zhang和Yan[22]报道了水合茚三酮、丙二腈和3-芳氨基环己酮组成的三组分,在以三乙胺为催化剂,乙醇为溶剂,在室温的条件下反应2h,得到了相应的杂环[3,3,3]螺桨烷(式10)。
式10
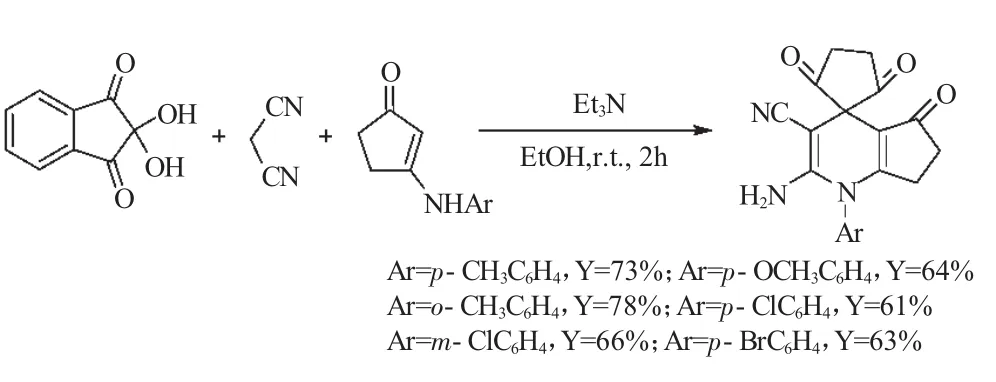
然而,作者发现,在相同的反应条件下,当水合茚三酮、丙二腈与3-芳氨基环戊酮进行“三组分一锅反应”时,却没有生成预期的杂环[3,3,3]螺桨烷类化合物,而是得到了螺环杂环化合物作为主要产物(式11),其收率为61%~78%。
式11

式8
2 茚三酮与两分子β-二酮的多组分反应
2-羟基萘醌是最近几年被发现可用于多组分反应的活性成分。2008年,Bazgir等[23]进行了茚三酮和两分子2-羟基萘醌的三组分反应,合成了结构高度对称的螺吡喃化合物,其收率为62%(式12)。该反应是以p-TSA(对甲苯磺酸)为催化剂,在水相中进行反应,具有环境友好、操作简便等优点。

式12
2010年,Naskar等[24]发现使用蒙脱石K-10(Montmorillonite K-10 clay)作为催化剂,在无溶剂微波辐射条件下,茚三酮可以和两分子3-位未取代的吲哚发生“多组分一锅反应”,得到2,2-双吲哚基-1, 3-茚二酮(式13)。该合成方法同样具有反应时间短,收率高,对环境友好等优点。

式13
在相同的催化反应条件下,茚三酮与两分子3-位取代的吲哚同样也可以发生“多组分一锅反应”,但得到了含有环外烯键双吲哚茚二酮作为唯一产物(式14),其收率均在90%以上。

式14

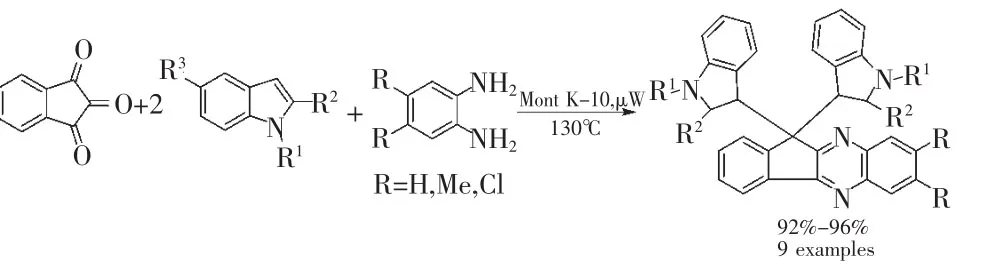
进一步,在该催化反应条件下,尝试茚三酮与两分子3-位未取代的吲哚和邻苯二胺进行“四组分一锅反应”同样也获得了成功,高收率得到了更为复杂的双吲哚基螺环化合物(收率>90%)(式15)。
式15
3 茚三酮、茚二酮与萘胺的“三组分一锅”反应
2012年,Moghadam[25]发现用茚三酮替代靛红组分与茚二酮和萘胺组成的“三组分一锅反应”合成也可以合成四环稠环的螺杂环化合物(式16)。该反应选用离子液体TMGTf(即N,N,N,N-tetramethylguanidinium triflate)作为催化剂溶剂,收率高达94%。所用离子液体起到了有机溶剂和催化剂的双重作用,而且在循环使用多次后,产品的收率仍然没有明显的降低。作者也曾尝试用苯胺代替萘胺,但没有得到预想的结果。
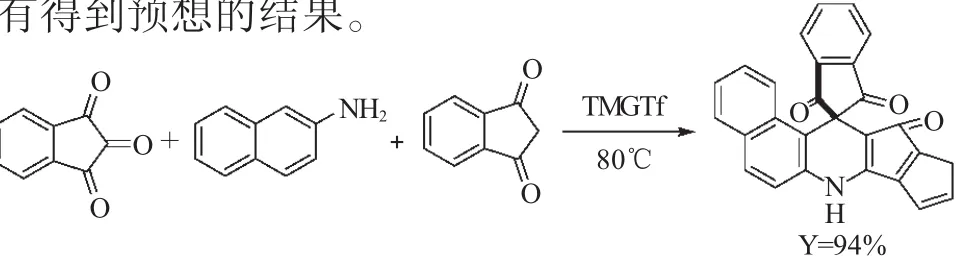
式16
4 茚三酮、肌氨酸与其它底物的“多组分一锅反应”
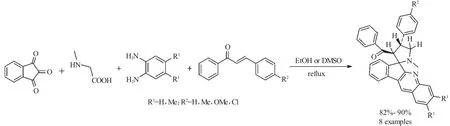
1,3-偶极环加成反应是合成五元杂环常见的方法之一。从现有的文献报道来看,用茚三酮的1,3-偶极环加成反应研究非常少,而靛红的1,3-偶极环加成反应较多。在此方面,2007年,Sridhar等[27]在研究了靛红的多组分反应的基础上,进一步扩展到茚三酮、肌氨酸和2-(杂)芳亚甲基环戊酮的“三组分一锅反应”。当该反应在回流的甲醇溶液中进行,螺环产品的收率仅为8%~20%。而当采用无溶剂微波加热的条件下,反应收率有大幅度提高,最高收率可以达到90%。(式17).
2012年Wei等[26]报道了茚三酮,肌氨酸和2-芳乙烯基茚酮的“三组分一锅反应”,在甲醇回流2~4.5h,得到结构新颖的三环螺杂环化合物(式18)。作者发现当传统的加热方式改为在微波辐射条件下进行这一反应时,反应时间要求仅为2~3min,收率高达85%~96%。因此采用微波辐射方法进行这一反应具有收率高反应时间短等优点。

式18
此外,他们也研究了反应机理,推测茚三酮首先与肌氨酸环合生成噁唑烷(A)中间体,然后脱去二氧化碳得1,3-偶极子的中间产物(B),进一步与查尔
式20
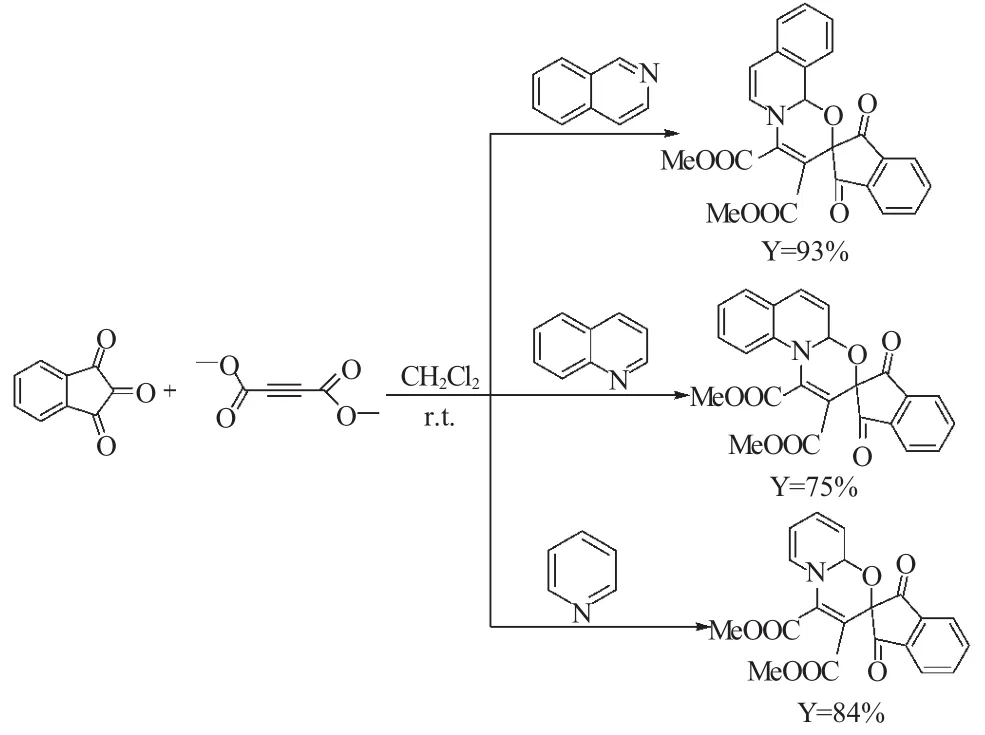
5 茚三酮、丁炔二酸二乙酯与喹啉、异喹啉或吡啶组成的“三组分一锅反应”
2007年,Yavari等[29]发现茚三酮和丁炔二酸乙酯可以分别与喹啉,异喹啉及吡啶在二氯甲烷为溶剂,无需催化剂和加热的条件下就可以发生“三组分一锅反应”。室温反应24h后,以较高的收率得到相应的螺环杂环化合物(式21)。该反应具有反应条件温和,操作简单,收率高等优点。
6 茚三酮与苯肼和芳香醛组成的“三组分一锅反应”
酮发生1,3-偶极环加成反应得最终产物,其可能的机理如下图(式19)所示:

式19
2012年,Moemeni等[28]报道了茚三酮、肌氨酸、邻苯二胺与查尔酮组成的四组分在乙醇回流条件下,进行“四组分一锅反应”,有效合成了喹啉稠环的螺杂环化合物(Eq.20),其收率高达84%~93%。另外,这一反应也可以在回流的二甲基亚砜溶剂中进行,以同等的收率(82%~90%)得到目标化合物(式21)。在二甲基亚砜溶剂中,反应时间为2h,而在乙醇溶剂中,反应时间为5h。但使用二甲基亚砜作为溶剂,反应后处理比较繁琐,产品不易分离提纯。
式21
2012年,Yavari等[30]在前期的工作基础上,又开发了茚三酮、苯肼和芳香醛组成的“三组分一锅反应”。该反应以乙腈为溶剂,在室温条件下反应2~4h,以很好的收率得到三环稠环的吡唑类衍生物4(74%~90%)(式22)。该反应同样具有反应条件温和,操作简单,收率高等优点。

式22
7 结论与展望
综上所述,茚三酮作为一种活泼的羰基化合物在取代醛与多组分反应的研究中取得了很大的成功,是多组分反应研究中的一次重大突破,同时也为螺杂环化合物的合成提供了一种简单的途径。目前该领域的研究还处于初步阶段,需要加以不断深化和完善。我们认为今后该领域的发展方向有以下3个方面:(1)本文讨论的许多反应需要不断开发高效廉价的催化剂和合适溶剂以缩短反应时间提高产率。(2)以茚三酮为基础与其他各种活性组分(如丙二腈、二酮、胺等)组合,研究探索新颖的三组分、四组分以及更多组分的反应类型,合成更加复杂的杂环化合物.(3)寻找与茚三酮结构类似的活性羰基化合物(如蒽醌)代替茚三酮参与多组分反应,合成各种新的螺杂环化合物,为杂环化合物库补充新的成员。
[1]LUNDAHL K,SCHUT J,SCHLATMANN J L M A,et al.Synthesis and antiviral activities of adamantane spiro compounds.1.Adamantane and analogous spiro-3’-pyrrolidines[J].Journal of Medicinal Chemistry,1972,15(2):129~132.
[2]RAPPOSELLI S,BRESCHI M C,CALDERONE V,et al.Synthesis and biological evaluation of 5-membered spiro heterocycle-benzopyran derivatives against myocardial ischemia[J].European Journal of Medicinal Chemistry,2011,46(3):966~973.
[3]BIENAYMÉH,CHËNE L,GRISONI S,et al.New spiro-piperidines as 5-HT2B receptor antagonists[J].Bioorganic&Medicinal Chemistry Letters,2006,16(8):4830~4833.
[4]CHEN X,SHI Q,LIN G,et al.Spirobisnaphthalene analogues from the Endophytic Fungus Preussia sp[J].Journal of Natural Product,2009,72(9):1712~1715.
[5]ROGERS E W,MOLINSKI T F.Highly polar spiroisoxazolines from the Sponge Aplysina fulva[J].Journal of Natural Product, 2007,70(7):1191~1194.
[6]丁研,田喆,朱能.具有抗菌活性的螺环化合物研究进展[J].有机化学,2010,30(8):1156~1163.
[7]CANONNE P,BOULANGER R,ANGERS P.A novel synthesis of unsaturated spiro compounds based on reactions of bifunctional organometallic reagents[J].Tetrahedron Letters,1991,32(42): 5861~5864.
[8]李筱芳,冯亚青,尤旭东,等.喹唑啉稠合螺杂环化合物的合成及晶体结构[J].高等学校化学学报,2005,26:270~272.
[9]SUE D,KAWABATA T,SASAMORI T,et al.Synthesis of Spiro Compounds through tandem oxidative coupling and a framework rearrangement reaction[J].Organic Letters,2010,12(2):256~258.
[10]PRADHAN R,PATRA M,BEHERA A K,et al.A synthon approach to spiro compounds[J].Tetrahedron,2006,62:779~828.
[11]RAMALINGAN C,KWAK Y W.Tetrachlorosilane catalyzed multicomponent one-step fusion of biopertinent pyrimidine heterocycles[J].Tetrahedron,2008,64(22):5023~5031.
[12]田金金,郭红云.多组分反应合成吡喃衍生物的研究进展[J].有机化学,2011,31(12):2009~2018.
[13]BIGGS-HOUCK J E,YOUNAI A,SHAW J T.Recent advances in multicomponent reactions for diversity-oriented synthesis[J].Current Opinion in Chemical Biology,2010,14(3):371~382.
[14]郭红云,田金金.靛红参与的多组分反应在螺杂环化合物合成中的研究新进展[J].有机化学,2011,31(11):1752~1760.
[15]SINGH G S,DESTA Z Y.Isatins as privileged molecules in design and synthesis of spiro-fused cyclic frameworks[J].Chemical Review,2012,112(11):6104~6155.
[16]SHAKER R M,MAHMOUD A F,ABDEL-LATIF F F.Facile one pot microwave assisted solvent-free synthesis of novel spirofused pyran derivatives via the three-component condensation of ninhydrin with malononitrile and active methylene compounds[J].Journal of the Chinese Chemical Society,2005,52(3):563~567.
[17]GHAHREMANZADEH R,AMANPOUR T,BAZGIR A.Clean synthesis of spiro[indole-3,8’-phenaleno[1,2-b]pyran]-9’-carbonitriles and spiro[indole-3,4’-pyrano[4,3-b]pyran]-3’-carbonitriles by one-pot three-component reactions[J].Journal of Heterocyclic Chemistry,2010,47(1):46~49.
[18]KARIMI A R,SEDAGHATPOUR F.Novel mono-and bis(spiro-2-amino-4H-pyrans):Alum-catalyzed reaction of 4-hydroxycoumarin and malononitrile with isatins,quinones,or ninhydrin[J].Synthesis,2010,(10):1731~1735.
[19]HE Y,GUO H,TIAN J.A simple three-component synthesis of spiro-pyran derivatives[J].Journal of Chemical research,2011, 35(9):528~530.
[20]郭红云,田金金.碱性离子液体催化下一锅三组分合成螺环1,3-二氧代茚满吡喃衍生物[J].有机化学,2011,31(12):2151~2155.[21]KHURANA J M,YADAV S.Highly monodispersed PEG-stabilized Ni nanoparticles:Proficient catalyst for the synthesis of biologically important spiropyrans[J].Australian Journal of Chemistry,2012,65(3):314~319.
[22]ZHANG L J,YAN C G.One-pot domino reactions for synthesis of heterocyclic[3.3.3]propellanes and spiro[cyclopenta[b]pyridine-4,20-indenes][J].Tetrahedron 2013,69(24):4915~4921.
[23]BAZGIR A,TISSEH Z N,MIRZAEI P.An efficient synthesiofspiro[dibenzo[b,i]xanthenes-13,3’-indoline]-pentaones and 5H-dibenzo[b,i]xanthenes-tetraones[J].Tetrahedron Letters, 2008,49(35):5165~5168.
[24]NASKAR S,PAIRA P,PAIRA R,et al.Montmorillonite K-10 clay catalyzed solvent-free synthesis of bis-indolylindane-1,3-dione,2-(1’,3’-dihydro-1H-[2,3’]biindolyl-2’-ylidene)-indan-1,3-dione and bisindolylindeno[1,2-b]quinoxaline under mictowave irradiation[J].Tetrahedron,2010,66(27):5196~5203.
[25]MOGHADAM K R,MIRI L Y.Tetramethylguanidinium triflate: An efficient catalyst solvent for the convergent synthesis of fused spiro[1,4-dihydropyridine-oxindole]compounds[J].Journal of Fluorine Chemistry,2012,135:213~219.
[26]WEI A C,ALI M A,YOON Y K,et al.Antimycobacterial activity:A facile three-component[3+2]-cycloaddition for the regioselective synthesis of highly functionalized dispiropyrrolidines[J].Bioorganic and Medicinal Chemistry Letters,2012,22(15): 4930~4933.
[27]SRIDHAR G,GUNASUNDARI T,RAGHUNATHAN R.A greener approach for the synthesis of 1-N-methyl-(spiro[2.3’]oxindolespiro[3.2’]/spiro[2.3’]indan-1,3-dionespiro[2.2’]cyclopentaone-4-aryl pyrrolidines[J].Tetrahedron Letters,2007, 48(2):319~322.
[28]MOEMENI M,ARVINNEZHAD H,SAMADI S,et al.An efficient multicomponent and stereoselective synthesis of new spiro[indeno[1,2-b]quinoxaline-11,2’-pyrrolidine]derivatives[J].Journal of Heterocyclic Chemistry,2012,49(1):190~194.
[29]YAVARI I,HOSSAINI Z,SABBAGHAN M,et al.Reaction of N-heterocycles with acetlenedicarboxylates in the presence of N-alkylisatins or ninhydrin[J].Monatshefte füer chemie,2007, 138(7):677~681.
[30]YAVARI I,SEYFI S,SKOULIKA S.A convenient synthesis of functionalized indenopyrazolones from indan 1,2,3-trione,benzaldehydes,and phenylhydrazine[J].Helvetica Chimica Acta 2012,95:1581~1585.
Progress in the Synthesis of Spiroheterocyclic Compounds via Ninhydrin-Mediated Multicomponent Reactions
SUN Li-Ke
(Beijing Yanshan Branch,China Petroleum&Chemical Corporation,Beijing 102500,China)
To the best of our knowledge,the review on the use of ninhydrin in place of aromatic aldehydes for the synthesis of spiroheterocyclic compounds has never been reported.Thus,it is hoped that this review will demonstrate the synthetic potential of ninhydrin and generate some new ideas in this area.The present review focuses on the development in the use of ninhydrin instead of aromatic aldehyde in multi-component reactions for the synthesis of spiroheterocyclic compounds in the period of 2005~2013,involving the multicomponent reactions of ninhydrin with malononitrile and cyclic ketone,ninhydrin with two β-diketones,ninhydrin with 1,2-indandione and naphthylamine,ninhydrin with sarcosine and other substrates as well as ninhydrin with phenylhydrazine and aromatic aldehyde.Meanwhile,this review also describes its development tendency.
Ninhydrin;multicomponent reaction;spiroheterocyclic compounds
TQ25
A
1001-0017(2013)06-0063-07
2013-07-21
孙立科(1981-),男,辽宁大连人,工程师,主要研究方向:精细化工。
