重铬酸铵清洁生产新工艺
2013-04-08刘昌见
刘昌见
[中国石油大学(北京)CNPC催化重点实验室,北京 102249]
环境·健康·安全
重铬酸铵清洁生产新工艺
刘昌见
[中国石油大学(北京)CNPC催化重点实验室,北京 102249]
摘要:将铬酸钠碳氨转化得到的NaNH4CrO4·2H2O复盐结晶,经低温热分解得到铬酸钠和重铬酸铵,以这2个产物为原料经重结晶可以制备重铬酸铵产品。测定了Na2CrO4-(NH4)2Cr2O7-H2O体系的溶解度和相图,并以此为依据对热分解产物的重结晶分离制备重铬酸铵过程进行分析。结果表明:铬酸钠和重铬酸铵混合物经高温(100℃)溶解-冷却(50℃)结晶可以制备得到高纯度的重铬酸铵产品,收率为76.8%,母液可以蒸氨制备重铬酸钠,氨可在工艺中循环。该工艺具有清洁、环保的特点。
关键词:重铬酸铵;清洁工艺;溶解度;相图分析
重铬酸铵[(NH4)2Cr2O7]是铬盐产品中附加值较高的产品之一,主要用于催化剂、磁性材料、合成染料、鞣革和陶瓷釉料等。目前,国内外铬盐工业一般采用重铬酸钠氯化铵(Na2Cr2O7)复分解反应生成重铬酸铵。每生产1t重铬酸铵产品消耗氯化铵450kg,同时副产氯化钠600 kg。即生产中的纯碱转化为比它价值更低的副产品氯化钠,同时还要消耗大量的氯化铵,且氯化钠中通常还残留0.5%(质量分数)左右的重铬酸钠。这一方面造成铬的损失,另外含Cr6+的氯化钠的处理及利用也是一大难题[1]。
针对铬盐工业的重污染难题,中科院过程工程研究所开发了熔盐液相氧化-碳氨转化铬盐清洁生产新工艺。该工艺是在不添加其他辅料的条件下将铬铁矿与熔融烧碱进行液相氧化反应,得到中间产品为铬酸钠晶体,再经碳氨转化过程生产其他铬盐产品,钠、氨与二氧化碳完全实现工艺内循环,基本不产生污染[2]。前期研究工作中发现铬酸钠碳铵转化反应过程析出的是铬酸铵钠复盐结晶NaNH4CrO4·2H2O[3-4],进一步研究发现NaNH4CrO4·2H2O在低温条件下热分解产物为铬酸钠和重铬酸铵,高温条件下分解产物为三氧化二铬、重铬酸钠和铬酸钠的混合物[5]。笔者据此研究了利用NaNH4CrO4·2H2O低温热分解、重结晶制备重铬酸铵产品的清洁生产新过程。
1 实验
1.1溶解度的测定
以铬酸钠(AR)和重铬酸铵试剂(AR)为原料,采用等温合成复体法测定体系各组分的溶解度[6]。精确称量各组分,在250 mL的高压聚乙烯瓶中配制成溶液与固相混合体系,置入超级水浴恒温槽内(±0.5℃),从溶液中取样分析,待其组成基本不变时,测定溶液中各组成离子浓度,采用化学分析和X射线衍射分析以确定平衡固相的组成。
1.2Na+、NH4+、Cr6+的分析
Na+采用原子吸收分光光度法测定[7];CrO42-的浓度采用硫酸亚铁铵-硫酸标准溶液滴定法测定;NH4+采用甲醛法测定。
1.3重铬酸铵的制备
以重铬酸钠试剂(AR)为原料,与氨水(AR)按1∶1(物质的量比)反应,冷却结晶得到NaNH4CrO4· 2H2O,在控温180℃(±1℃)的烘箱中热分解至恒重。
2 结果与讨论
2.1NaNH4CrO4·2H2O的热分解
含铵铬酸盐受热容易分解,铬酸铵在低于180℃条件下首先分解为重铬酸铵。与铬酸铵的热分解相似,在低于180℃的条件下,NaNH4CrO4·2H2O首先发生结晶水的脱除和铵的部分分解,生成铬酸钠和重铬酸铵,二者物质的量比为2。
2.2Na2CrO4-(NH4)2Cr2O7-H2O体系溶解度与相图
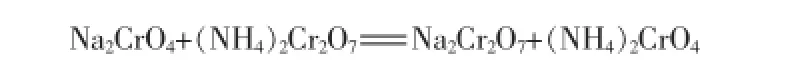
热分解产物为铬酸钠与重铬酸铵的混合物,将此混合物溶解在水溶液中,可能会发生复分解反应,反应式为:标准状态下该反应的吉布斯自由能ΔG=(-431.18-209.3)-(-299.15-348.9)=7.57>0,上述复分解反应不能够自发进行。表明Na2CrO4和(NH4)2Cr2O7是稳定的盐对,可以通过溶解度差异进行重结晶分离得到重铬酸铵产品。
表1是50℃时Na2CrO4-(NH4)2Cr2O7-H2O体系的溶解度,并根据溶解度数据绘制出该体系的相图(图1)。同时还测定了不同温度下Na2CrO4-(NH4)2Cr2O7共饱和时体系溶液的组成(表2)。
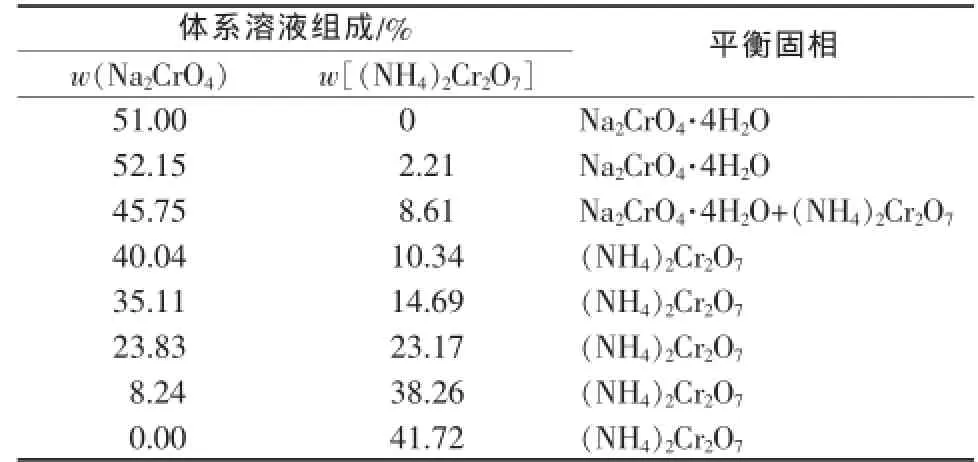
表150 ℃时Na2CrO4-(NH4)2Cr2O7-H2O体系溶解度
由表1和图1可以看出,体系中铬酸钠的溶解度略有偏高,在部分区域内超过铬酸钠单独存在的溶解度。这是由于在测定体系溶解度时,取样或密封不严使体系中少量的氨挥发所致,体系达到平衡时,部分重铬酸铵会转化为重铬酸钠。由图1可见,Na2CrO4结晶区较小,(NH4)2Cr2O7的结晶区较大。
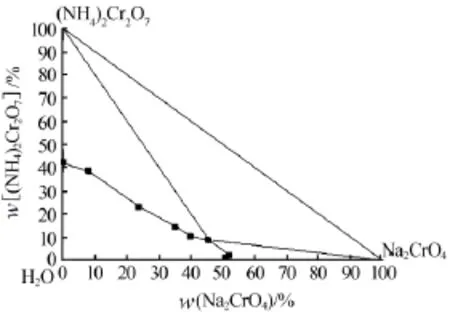
图1 Na2CrO4-(NH4)2Cr2O7-H2O体系相图
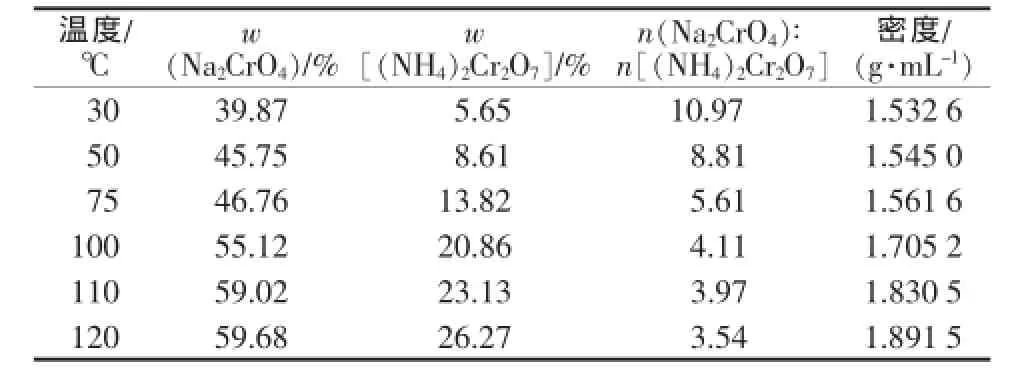
表2 Na2CrO4、(NH4)2Cr2O7共饱和时体系中溶液的组成
由2.1节可知,铬酸铵钠复盐结晶热分解得到的混合物中,铬酸钠与重铬酸铵的物质的量比为2∶1。由表2可以看出,在30~120℃时溶液中铬酸钠与重铬酸铵物质的量比都远大于2,这表明热分解产物溶解时,铬酸钠更多地溶解进入溶液中,而重铬酸铵则留在固相中。而且随着温度降低,这种趋势更加明显,在30℃溶解达到饱和时,溶液中铬酸钠与重铬酸铵的物质的量比达到10.97,因此在较低的温度时将铬酸钠和重铬酸铵分离较为便利。但是在较低温度下制备的重铬酸铵产品晶形较差,且粒度较小,纯度不高,影响产品质量。直接在50℃溶解分离、2次洗涤、80℃干燥得到的重铬酸铵产品经分析纯度为95.6%,只能作为工业级产品。如果先在较高的温度下使铬酸钠和重铬酸铵全部溶解,再降温重结晶析出重铬酸铵,这样可以得到质量好的重铬酸铵产品。
图2为重铬酸铵低温热分解制备相图,根据图2对其制备过程进行具体分析。图2中E1JG1F1、E2KG2F2分别为50℃和100℃时铬酸钠重铬酸铵三元体系的溶解度曲线,CE2G2、BG2F2分别为100℃时重铬酸铵、铬酸钠的结晶区,G2BC为100℃时重铬酸铵和铬酸钠的结晶区,CE1G1、BG1F1分别为50℃时重铬酸铵、铬酸钠的结晶区,G1BC为50℃时重铬酸铵和铬酸钠的结晶区。
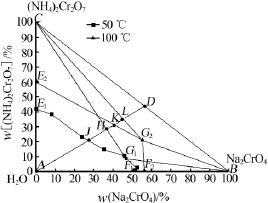
图2 重铬酸铵制备的相图分析
铬酸铵钠复盐晶体热分解产物中铬酸钠和重铬酸铵的质量分数分别为56.25%和43.75%,在相图中为D点。先在100℃下向100 g该热分解产物中加入水,铬酸钠和重铬酸铵会溶解进入溶液相中,系统点沿DA线向A点移动,与重铬酸铵的结晶区边线CG2交于L点(44.8%、35%,前后分别为铬酸钠和重铬酸铵的质量分数,下同),此时铬酸钠全部溶解,加入的水量为25.36 g,如继续加水,体系继续向A点移动,与E2G2线交于K点(40.5%、31%),此时重铬酸铵和铬酸钠均全部溶解,需要加入的水量为40.22 g。如在50℃下加水溶解,体系点沿DA向A点移动,与CG1交于H点(36.5%、28.5%),此时铬酸钠全部溶解,要求加入的水量为53.94 g,大于100℃时铬酸钠和重铬酸铵全部溶解所要求的水量。因此向100 g热分解产物中加入53.94 g水,在100℃时铬酸钠和重铬酸铵可全部溶解冷却至50℃析出的重铬酸铵结晶,体系沿HG1向G1(46.76%、8.61%)点移动,到达G1点重铬酸铵刚好饱和,重铬酸铵不再析出,此时析出的重铬酸铵晶体质量:100×43.75%-[8.61/(100-46.76-8.61)]×53.94=33.36 g。100 g铬酸铵钠的低温热分解产物中重铬酸铵为43.75 g。经结晶析出重铬酸铵占热分解产物中全部重铬酸铵的质量分数:(33.36/43.75)×100%=76.8%。
先在100℃下溶解,再冷却结晶、二次洗涤、80℃干燥得到的重铬酸铵产品经分析纯度为98.7%,达到照相级产品的要求。剩余含铬酸钠和重铬酸铵的母液经蒸氨浓缩可以制备重铬酸钠产品,蒸发产生的氨和热分解产生的氨可以返回铬酸钠的碳氨转化工序中循环使用。
3 结论
铬酸铵钠复盐晶体的低温热分解产物铬酸钠和重铬酸铵混合物经高温(100℃)溶解、冷却结晶可以制备高附加值的重铬酸铵产品,结晶率达76.8%,母液可以蒸氨浓缩制备重铬酸钠,整体工艺中氨实现循环,无其他副产物产生,工艺清洁、环保。
参考文献:
[1]成思危,丁翼,杨春荣.铬盐生产工艺学[M].北京:化学工业出版社,1988:153.
[2]张懿,李佐虎,王志宽,等.绿色化学与铬盐工业的的新一代产业革命[J].化学进展,1998,10(2):172-178.
[3]刘昌见,张懿.铬酸钠碳氨转化过程的相图分析[J].物理化学学报,2004,20(11):1335-1338.
[4]刘昌见,张懿.铬酸钠碳氨转化过程中铬的析出形式[J].无机盐工业,2003,35(6):20-21,48.
[5]刘昌见,张懿.铬酸铵钠复盐结晶的热分解[J].物理化学学报,2005,21(2):218-220.
[6]顾函珍,叶于浦.相平衡与相图基础[M].北京:北京大学出版社,1991:164.
[7]穆加鹏.原子吸收分析方法手册[M].北京:原子能出版社,1989:65.
联系方式:chjliu@cup.edu.cn
一种连续碳化反应装置及应用其制备超细碳酸钙的方法
本发明公开了一种连续碳化反应装置及超细碳酸钙的连续碳化制备方法,超细碳酸钙的合成是在连续碳化反应装置中进行,控制初始进入碳化器浆料的流量和窑气进入各碳化器的流量,通过多级的碳化反应釜(器),从最后一级碳化反应器出口流出的浆料完成碳化反应,并获得超细碳酸钙浆料,控制浆料和窑气的流量,氢氧化钙浆料通过4~5级碳化反应器的碳化反应,合成的超细碳酸钙粒径分布均匀,质量稳定,同时整个碳化过程实现了连续碳化反应,产品的质量稳定,操作方便,可实现自动化操作。
CN,102849771
中图分类号:TQ113.7
文献标识码:A
文章编号:1006-4990(2013)05-0041-03
收稿日期:2012-12-06
作者简介:刘昌见(1969—),男,副教授,博士,主要从事清洁生产新工艺和萃取分离工程研究,已公开发表文章20余篇。
New clean process for ammonium dichromate production
Liu Changjian
[CNPC Key Lab.of Catalysis,China University of Petroleum(Beijing Campus),Beijing 102249,China]
Abstract:A new clean process for production of ammonium dichromate was developed by recrystallizing the low-temperature thermal decomposition products of sodium chromate(Na2CrO4)and ammonium dichromate from a double salt crystal,NaNH4CrO4·2H2O obtained from the carbonation process of Na2CrO4in ammonia solution.The solubility and phase diagram of Na2CrO4-(NH4)2Cr2O7-H2O system were determined.According to the solubility data and phase diagram,the recrystallizing separation process of thermal decomposition products to prepare ammonium dichromate was analyzed.Results showed that the high purity ammonium dichromate could be obtained by dissolving and cooling crystallizing the thermal decomposition products at 100℃and 50℃,respectively,and the yield of ammonium dichromate was 76.8%.Through ammonia still process,the mother solution could be reused,and the ammonia could be recycled in the process.Therefore,the process was cleaner and more environmentally friendly.
Key words:ammonium dichromate;clean process;solubility;phase diagram analysis
