改进硫脲法浸出含硫铁矿炼锌渣中银的工艺*
2013-04-08张玉苏静龙云飞吕小艳文衍宣
张玉,苏静,龙云飞,吕小艳,文衍宣
(1.广西大学化学化工学院,广西 南宁 530004;2.广西大学教务处)
环境·健康·安全
改进硫脲法浸出含硫铁矿炼锌渣中银的工艺*
张玉1,苏静1,龙云飞1,吕小艳2,文衍宣1
(1.广西大学化学化工学院,广西 南宁 530004;2.广西大学教务处)
摘 要采用硫脲为络合剂、双氧水为氧化剂,研究了在硝酸介质中浸出含硫铁矿炼锌渣中银的工艺。考察了搅拌速率、反应时间、反应温度、硝酸初始浓度、双氧水浓度、硫脲浓度等因素对银浸出率的影响。结果表明,银的浸出率随着搅拌速率的增大和反应时间的延长先增大然后保持不变,随反应温度、硫脲浓度、双氧水浓度和硝酸初始浓度的增加先增大后减小。当搅拌速率为200 r/min、硝酸浓度为4.11 mol/L、双氧水浓度为0.82 mol/L、硫脲浓度为3.25 mol/L、反应温度为50℃、反应时间为1 h时,银浸出率可达82.0%。
关键词:硫脲;炼锌废渣;银
随着现代工业的兴起和发展,银作为重要的工业金属被广泛用于电子电气、银基合金和钎焊料、感光材料、抗菌等领域。银的主要来源是铜铅锌矿冶炼过程的矿渣或副产物,其次是再生银和独立银矿[1]。回收矿渣中银的传统方法氰化法,由于存在浸出剂含剧毒、易污染环境等缺陷,已经逐渐被淘汰。现在用于替代氰化法的有硫代硫酸盐法、酸性硫脲法、卤化物法等。其中酸性硫脲法应用最为广泛,该方法具有浸出剂毒性小、环境友好、浸出速度快、选择性优等优点[2-4]。矿渣中的银矿物常以银、氧化银和硫化银的形式存在,因此酸性硫脲法常用硫酸介质中的三价铁化合物作氧化剂来氧化硫化银,以提高银的浸出率[5-9]。然而,当矿渣中硫铁矿含量较高时,硫铁矿等矿物就会包覆在银及其化合物的表面,形成包覆层。如果是致密包覆层,就必须在氧化脱除硫铁矿致密包覆层后,硫脲才能与矿渣中的银化合物反应,浸出矿渣中的银。由于目前酸性硫脲法中的三价铁化合物不能有效地氧化硫铁矿包覆层,因此需要开发新的工艺,提取含硫铁矿矿渣中银。
笔者以广西某炼锌厂炼锌废渣(硫质量分数为8%)为原料,以氧化性较强的硝酸和双氧水分别作为酸性介质和氧化剂,研究了改进酸性硫脲法浸出含硫铁矿炼锌废渣中银的浸出工艺,并优化了工艺参数。
1 实验
1.1 实验原料
原料在120℃下烘干2 h后粉碎,至粒径小于74 μm。其物相组成和主要成分如图1和表1所示。
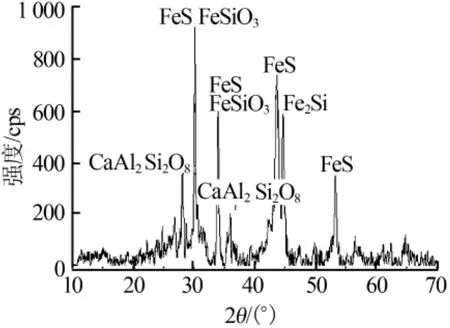
图1 炼锌渣XRD谱图

表1 炼锌渣主要化学成分%
从图1和表1可见,矿渣的银含量为2.02×10-4(质量分数)、硫质量分数高达8%,矿物的主要物相为硫铁矿、硅酸钙和硅酸铁,硫铁矿含量较高。
图2为浸出前后矿渣的SEM照片。由图2可以看出,反应前矿渣颗粒结构质密,硫铁矿、硅酸钙和硅酸铁包覆在银矿物表面,形成了致密的包覆层(图2a);反应后则变得比较疏松(图2b)。

图2 炼锌渣浸出前后的SEM照片
1.2 实验条件
浸出反应在三口瓶中常压进行。称取一定量矿渣放入三口瓶中,再依次加入HNO3、蒸馏水、H2O2、硫脲;将三口瓶置于已恒温的水浴中,待达到反应温度后开始计时,反应达到设定时间后立即停止实验,趁热过滤,用蒸馏水清洗滤渣;将滤液用容量瓶定容,分析银离子浓度。
1.3 分析方法及仪器
浸出液中银的含量用原子吸收光谱法测定,所用仪器为AAS6000型原子吸收分光光度计。用标准空白溶液和4种不同浓度(0.5、1.0、1.5、2.0 mol/L)的硝酸银标准溶液绘出标准曲线,利用该标准曲线即可得到该浸出液的浓度[10]。
2 结果与讨论
2.1 搅拌速率和浸出时间的影响
1)搅拌速率。在液固比(mL/g,下同)为6∶1、HNO3初始浓度(c0)为4.11 mol/L、H2O2浓度为0.82 mol/L、硫脲浓度为3.25 mol/L、浸出温度为50℃、浸出时间为1 h的条件下,考察搅拌速率对银浸出率的影响,结果如图3a所示。由图3a可见,当搅拌速率低于200 r/min时,银的浸出率随搅拌速率的增大而迅速增大;当搅拌速率高于200 r/min后浸出率几乎不再变化。这是因为当搅拌速率小时,反应物的接触不充分,体系的湍动程度小,银的浸出率也较小;当搅拌速率增大到一定程度,传质边界层的厚度不再减小,浸出率几乎不变;若继续增大搅拌速率,除了能耗增大,另外搅拌速率过大会使部分矿石黏附在反应器壁上,导致参与反应的矿渣量减少,浸出率降低。
2)浸出时间。在液固比为6∶1、HNO3浓度为4.11 mol/L、H2O2浓度为0.82 mol/L、硫脲浓度为3.25 mol/L、反应温度为50℃、搅拌速率为200 r/min的条件下,考察了浸出时间对银浸出率的影响,结果如图3b所示。由图3b可见,当浸出时间小于1 h时,随着时间的延长浸出率呈增加的趋势,这是由于随着浸出时间的延长反应物充分接触所致;但当浸出时间超过1 h时,随着时间的延长,浸出率并未有明显的提高。从节约能源角度考虑,浸出时间以1 h为宜。
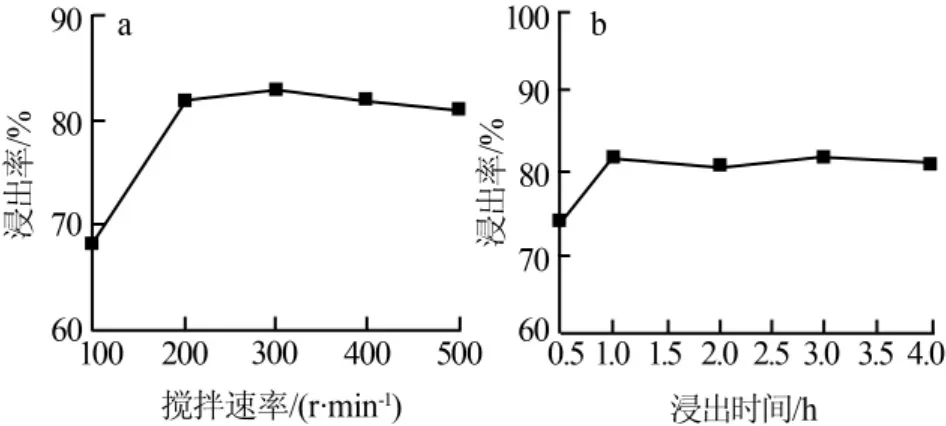
图3 搅拌速率和浸出时间对银浸出率的影响
2.2 浸出温度和硫脲浓度的影响
1)浸出温度。在搅拌速率为200 r/min、液固比为6∶1、HNO3浓度为4.11 mol/L、H2O2浓度为0.82 mol/L、硫脲浓度为3.25 mol/L、浸出时间为1 h的条件下,考察浸出温度对银浸出率的影响,结果如图4a所示。由图4a可见,当温度低于50℃时,银浸出率随着浸出温度的升高不断增加,这是由于温度增加可提高反应速率和扩散速率;当高于50℃后,浸出率开始呈下降趋势,这是由于浸出温度过高使硫脲发生强烈水解,使得实际参加反应的硫脲浓度降低,造成银浸出率的降低。从浸出率角度考虑,浸出温度取50℃为宜。
2)硫脲浓度。在液固比为6∶1、HNO3浓度为4.11mol/L、H2O2浓度为0.82mol/L、浸出温度为50℃,浸出时间为1 h、搅拌速率为200 r/min的条件下,考察了硫脲浓度对银浸出率的影响,结果如图4b所示。由图4b可见,当硫脲浓度低于3.25 mol/L时,浸出率随硫脲浓度增大而增大;但当硫脲浓度超过3.25 mol/L时,浸出率开始呈下降趋势。当介质pH<1.78时,高浓度的硫脲易氧化分解[5],从而导致银浸出率降低。因此从浸出率角度考虑,硫脲浓度取3.25 mol/L为宜。
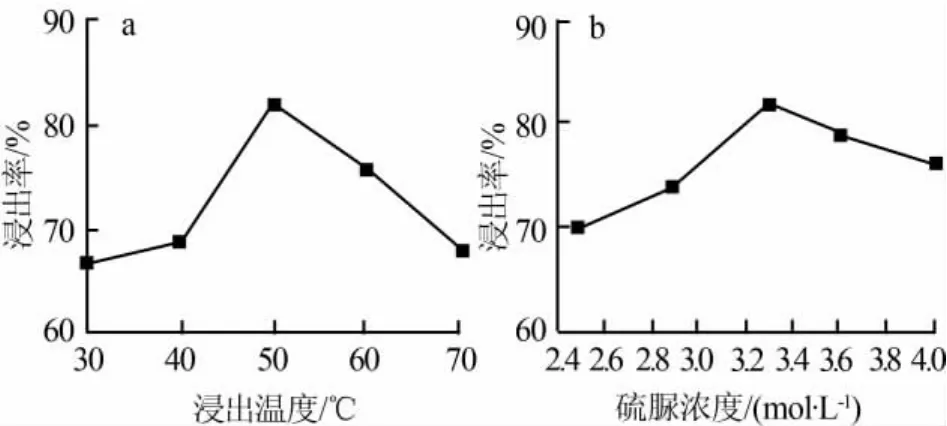
图4 浸出温度和硫脲浓度对银浸出率的影响
2.3 H2O2浓度和HNO3初始浓度的影响
1)H2O2浓度。在硫脲浓度为3.25 mol/L、反应温度为50℃、浸出时间为1 h、搅拌速率为200 r/min的条件下,考察了H2O2浓度对银浸出率的影响,如图5a所示。由图5a可见,当H2O2浓度低于0.82mol/L时,银浸出率随双氧水浓度的增大而增大;当H2O2浓度超过0.82 mol/L后,银浸出率随其浓度的增大而减小。H2O2在该实验中起氧化剂的作用,用于氧化矿石中的单质银以及硫化银中的硫,从而使其中的银能够以离子的形式与硫脲形成络合物。但是在浸出过程中硫脲易被氧化生成二硫甲脒等氧化产物,这就使得氧化剂浓度的选择非常重要。当H2O2浓度超过0.82 mol/L后,过量的H2O2氧化用于络合银的硫脲从而使银浸出率呈现下降的趋势[7]。从浸出率角度考虑,H2O2浓度取0.82 mol/L为宜。
2)HNO3初始浓度。在H2O2浓度为0.82 mol/L、硫脲浓度为3.25 mol/L、浸出温度为50℃、浸出时间为1 h、搅拌速率为200 r/min的条件下,考察了HNO3初始浓度对银浸出率的影响,结果如图5b所示。由图5b可见,当HNO3浓度低于4.11 mol/L时,银浸出率随其浓度的增大而增大;当HNO3浓度超过4.11mol/L后,银浸出率随其浓度的增大而减小。这是由于当HNO3初始浓度过高时,过量的硝酸可能消耗H2O2以及硫脲,使实际参加反应的H2O2和硫脲减少,从而使得银的浸出率降低。从浸出率角度考虑,HNO3浓度取4.11 mol/L为宜。
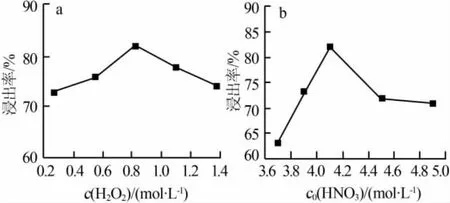
图5 H2O2浓度和HNO3初始浓度对银浸出率的影响
3 结论
研究了改进酸性硫脲法浸出含硫铁矿炼锌废渣中银的浸出工艺,通过研究搅拌速率、浸出时间、浸出温度、硫脲浓度、H2O2浓度、HNO3初始浓度对浸出率的影响得出:1)银浸出率随着搅拌速率的增大,浸出时间的延长均呈现先增大后保持不变的趋势,随浸出温度、硫脲浓度、H2O2浓度、HNO3初始浓度的增大均呈现先增大后减小的趋势;2)影响银浸出率的主要因素为浸出温度、HNO3初始浓度、H2O2浓度、硫脲浓度,各因素影响的大小依次为:HNO3初始浓度>浸出温度>硫脲浓度>H2O2浓度;3)酸性硫脲法浸出炼锌渣中银的最佳工艺条件:液固比(mL/g)为6∶1、HNO3浓度为4.11 mol/L、H2O2浓度为0.82 mol/L、硫脲浓度为3.25 mol/L、浸出温度为50℃、浸出时间为1 h、搅拌速率为200 r/min。在此条件下,银的浸出率可达82.0%。
参考文献:
[1]曾术兵.利用铅锌废渣生产活性氧化锌和钼铬红[J].无机盐工业,1995,27(6):29-32.
[2]何剑,童雄,崔毅琦.银浸出技术的研究现状[J].云南冶金,2004,33(5):6-9,15.
[3]吴阳红.硫代硫酸盐法提取银[J].有色矿冶,2000,16(5):28-30.
[4]周国华,薛玉兰,蒋玉仁,等.湿法炼锌浸出渣中回收银的研究及实践[J].矿产综合利用,2001(1):23-27.
[5]黄开国,胡天觉.硫脲法从锌的酸浸渣中回收银[J].中南工业大学学报,1998,29(6):538-541.
[6]程德平,夏式均.硫脲浸出银及其机理的探讨[J].杭州大学学报,1996(1):39-44.
[7]胡天觉,曾光明,陈维平,等.硫脲法浸出回收炼锌废渣中的银[J].化工环保,1999,19(3):175-180.
[8]卓见东.酸性硫脲法提金的研究[J].广西化工,2000,29(1):15-16.
[9]张箭,黄晓平.用酸性硫脲法处理含银物料的新工艺研究[J].黄金,1985,6(1):45-49.
[10]薛光,姚万林,刘永生,等.封闭溶样-硫脲介质原子吸收法测定矿石中的银[J].黄金,2000,21(5):46-49.
联系人:文衍宣
联系方式:wenyanxuan@vip.163.com
中图分类号:TQ131.22
文献标识码:A
文章编号:1006-4990(2013)08-0039-03
收稿日期:2013-02-15
作者简介:张玉(1985—),女,硕士,主要从事湿法冶金研究。
*基金项目:国家自然科学基金(21166003);教育部博士点基金项目(20114501110004)。
Leaching process of silver from zinc-smelting slag of sulfur-bearing pyrite by modified thiourea method
Zhang Yu1,Su Jing1,Long Yunfei1,Lü Xiaoyan2,Wen Yanxuan1
(1.School of Chemistry and Chemical Engineering,Guangxi University,Nanning 530004,China;2.Educational Administration Department,Guangxi University)
Abstract:The leaching process of silver from zinc-smelting slag of sulfur-bearing pyrite with thiourea as chelating agent and H2O2as oxidant in HNO3was studied.The effects of stirring speed,reaction time,reaction temperature,HNO3initial concentration,H2O2concentration,and thiourea concentration etc.on the leaching efficiency of silver were investigated.Results showed that the leaching ratio of silver first increased and then kept constant with the increase of the stirring speed and the reaction time,while it first increased and then decreased with the increase of reaction temperature,HNO3initial concentration,H2O2concentration,and thiourea concentration.The optimal conditions for leaching of silver with thiourea were found as follows:the stirring speed was 200 r/min,HNO3initial concentration was 4.11 mol/L,H2O2concentration was 0.82 mol/L,thiourea concentration was 3.25 mol/L,reaction temperature was 50℃,and reaction time was 1.0 h.Under these conditions,the leaching ratio of silver was up to 82.0%.
Key words:thiourea;zinc-smelting slag;silver
