家蝇幼虫消化器官中纤维素酶的组成及酶活性分析
2013-04-04吴建伟
张 姝,胡 蓉,吴建伟,国 果,付 萍
(贵阳医学院人体寄生虫学教研室,贵阳 550004)
纤维素酶是水解纤维素及其衍生物生成葡萄糖的三种酶的组合酶系,包括内切β-1,4-葡聚糖酶 (endo-β-1,4 glucanase,EC 3.2.1.4,EG),外切β-1,4-葡聚糖酶 (exo-β-1,4-glucanase,EC3.2.1.91,CBH)和β-葡萄糖苷酶(β-glucosidase,EC 3.2.1.21,BG),这三种酶各有专一性又能相互协调,通常只有在这三种酶的协同作用下,才能把纤维素分子降解为葡萄糖(Duan and Feng,2010;Clarke,1997)。目前已有研究表明天牛 (殷幼平等,2000;Wei YD,et al.,2006;索风梅等,2007)和白蚁 (曾文慧等,2011;Nathan, etal., 2011;Tokuda, etal.,2012)等昆虫的消化器官内均有完整的纤维素酶系,并以此获得生存所需的能量。家蝇 Musca domestica是一种分布广泛、数量众多的双翅目昆虫,人工养殖的家蝇幼虫通常在富含纤维素的麦麸中进行喂养,家蝇的消化器官内是否也含有纤维素酶引起我们的关注。本研究通过DNSA法(Miller,1959),以滤纸为底物检测家蝇各消化器官是否具有纤维素酶活性,并通过纤维素酶复合酶系3种酶的特异性底物检测家蝇纤维素酶的组成,同时初步探讨温度、反应时间对家蝇纤维素酶活性的影响,为今后纤维素酶的来源增加新的家族和类型。
1 材料与方法
1.1 实验材料
1.1.1 实验昆虫
家蝇由贵阳医学院人体寄生虫教研室保存。养蝇房恒温25℃,光周期12L∶12D,成虫以水、奶粉和白糖喂食,幼虫以麦麸和水为食料。
1.1.2 主要试剂
水杨苷、羧甲基纤维素钠、微晶纤维素(Sigma),定性滤纸 (杭州特种纸业有限公司),3,5-二硝基水杨酸 (DNSA,Genview),SK3071非干扰型蛋白浓度检测试剂盒 (上海生工生物工程有限公司)。
1.1.3 主要仪器
SZ61立体显微镜 (OLYMPUS),CT15RE高速冷冻离心机 (HITACHI),超低温电冰箱(Thermo scientific),752N紫外分光光度计 (上海精密科学仪器有限公司),电子天平 (北京赛多利斯系统仪器有限公司),超纯水器 (艾柯公司),移液器 (Eppendorf)。
1.2 方法
1.2.1 粗酶液的制备
新鲜3龄家蝇幼虫洗净体表上的饲料残渣后用超纯水浸泡2~3 h,使其吐净体内污物,用75%乙醇对家蝇3龄幼虫表面消毒30 min,超纯水清洗2次,滤纸吸干体表水分,20℃预冻10 min,解剖显微镜下分离家蝇3龄幼虫的唾液腺、前肠、中肠、后肠。按0.15 g组织加入1 mL 0.1M醋酸-醋酸钠缓冲液 (pH=5.6),冰浴研磨,在12000 rpm,4℃,离心10 min,取上清液即为纤维素酶的粗酶液,置于-80℃冰箱中待用。
1.2.2 粗酶液蛋白定量
采用BCA蛋白浓度测定法进行测定(Smith et al.,1985)。取10 μL家蝇粗酶液和6种不同浓度的蛋白质标准溶液加入2 mL的BCA工作液,在480 nm波长处测定其吸收值,计算出粗酶液的蛋白浓度。
1.2.3 滤纸酶活性测定
采用DNSA法测定,每个离心管中放入10 mg定量滤纸片,再加入0.3 mL 0.1 M醋酸-醋酸钠缓冲液 (pH5.6)将其浸润。加入粗酶液0.1 mL混匀后在50℃水浴条件下反应60 min,立即加入0.3 mL DNSA显色剂终止反应,在沸水浴显色5 min,冷却至室温后,用0.1M醋酸-醋酸钠缓冲液定容至5 mL。设阴性对照 (以缓冲液代替粗酶液)。于紫外分光光度计测OD540值,每一个样品3个生物重复,每组做3个重复。从葡萄糖标准曲线计算葡萄糖含量。在 pH=5.6、50℃反应60 min的条件下,以每分钟产生1 umoL葡萄糖所需的酶量定义为1个酶活性单位 (IU)。纤维素酶活性大小用比活力 (Willis et al.,2010),即每mg蛋白中的酶单位数量来表示。纤维素酶比活力(IU/mg)=(m×5.56)/(V×C×t)。m:产生的葡萄糖含量 (mg);C:粗酶液蛋白浓度(mg/mL);V:反应液中加入的粗酶液体积(mL);t:反应时间 (min)。
1.2.4 β-葡萄糖苷酶、内切β-1,4-葡聚糖酶、外切β-1,4-葡聚糖酶活力的测定
采用DNSA法测定,在离心管中分别加入1%水杨苷、1%羧甲基纤维素钠、1%微晶纤维素0.3 mL后加入粗酶液0.1 mL,混匀后在50℃水浴条件下反应60 min,立即加入0.3 mL DNSA显色剂终止反应,在沸水浴显色5 min,冷却至室温后,用0.1M醋酸-醋酸钠缓冲液定容至5 mL。设阴性对照 (以缓冲液代替粗酶液)。于紫外分光光度计测OD540值,每一个样品3个生物重复,每组做3个重复。计算方法同1.2.3。
1.2.5 纤维素酶特性初步研究
1.2.5.1 最适反应时间的测定取0.1 mL粗酶液分别与0.3 mL的1%羧甲基纤维素钠、1%水杨苷和1%微晶纤维素充分混合,分别温浴10 min,20 min,40 min,60 min,80 min,100 min,120 min后,按1.2.5所述方法分别测定EG、BG和CBH的酶活性,确定最适反应时间。
1.2.5.2 最适反应温度和热稳定性的测定
取0.1 mL粗酶液分别与0.3 mL的1%羧甲基纤维素钠、1%水杨素和1%微晶纤维素充分混合,分别在 20℃,30℃,40℃,50℃,60℃,70℃,80℃温度下水浴,按1.2.5所述方法分别测定EG、BG、CBH的酶活性,以温度为为横坐标,纤维素酶活力为纵坐标建立反应影响曲线。热稳定性测定的方法 (Teng et al.,2010;Liu et al.,2011)。将粗酶液在 20℃,30℃,40℃,50℃,60℃,70℃和80℃温浴1 h后,分别与不同底物在50℃、pH5.6条件下反应1 h,检测3种酶的活性。以最适温度和最适反应时间条件下粗酶液的酶活性(设为T0)为对照。
1.2.5.3 家蝇纤维素酶的混合底物实验将粗酶液与纤维素酶3种底物 (1%羧甲基纤维素钠、1%水杨素和1%微晶纤维素)混匀后,按1.2.5所述方法测定在相同条件下EG、BG和CBH的综合作用。
1.2.6 统计学分析
所得数据用SPSS11.5软件进行统计学分析,不同组织样本中各种纤维素酶活性皆用均数±标准差()表示,并用单因素方差分析检验,组间比较用q检验,P<0.05为有统计学差异。
2 结果与分析
2.1 家蝇粗酶液蛋白浓度测定
根据蛋白定量试剂盒说明书,读取不同浓度的蛋白标准品BSA吸光度值,绘制蛋白标准曲线(图1),根据标准曲线,得到各待测粗酶液蛋白浓度 (图1,表1)。

图1 蛋白标准曲线Fig.1 Protein standard curve

表1 家蝇3龄幼虫不同组织粗酶液蛋白含量 (mg/mL)Table 1 The protein content in different organizations from Musca domestica larvae(mg/mL)
2.2 滤纸酶活性测定
葡萄糖标准曲线如图2所示。吸光度 (x)与葡萄糖浓度 (y)之间呈良好的线性关系。通过FPA滤纸酶活性 (filter paper activity,FPA)检测,家蝇3龄幼虫唾液腺、前肠、中肠、后肠粗酶液均具有降解滤纸产生葡萄糖的能力,滤纸酶活性见图3。如图3所示,家蝇3龄幼虫消化器官皆具有滤纸酶活性,在消化器官中,中肠的滤纸酶活性最高,其次是唾液腺,前肠和后肠较低。
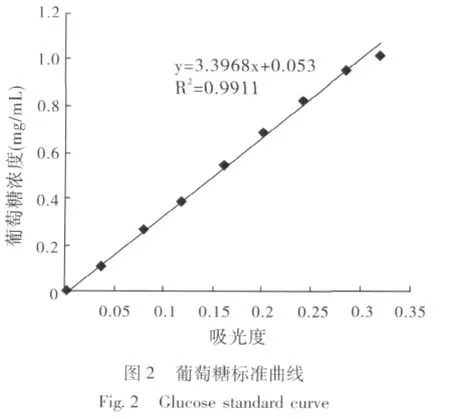

2.3 β-葡萄糖苷酶、内切β-1,4-葡聚糖酶、外切β-1,4-葡聚糖酶活性的测定
通过DNSA显色法检测到家蝇3龄幼虫唾液腺、前肠、中肠、后肠粗酶液均具有纤维素复合酶系中的3种酶,即CBH、EG和BG。这3种酶在不同消化器官中的配比关系和活性表现存在一定的差异。在相同的条件下,3种纤维素酶中,CBH在家蝇3龄幼虫各组织中酶活性都是最高的,EG除了在前肠和后肠的酶活性比列比BG的略高以外,其它组织中BG酶活性较EG的高。(图4,表2)。
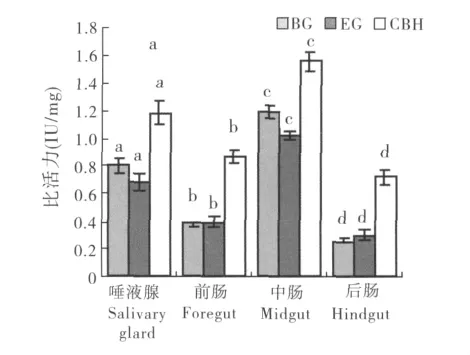
图4 家蝇3龄幼虫不同组织纤维素酶活性Fig.4 Distribution of three enzymes in digestive organs from Musca domestica larvae
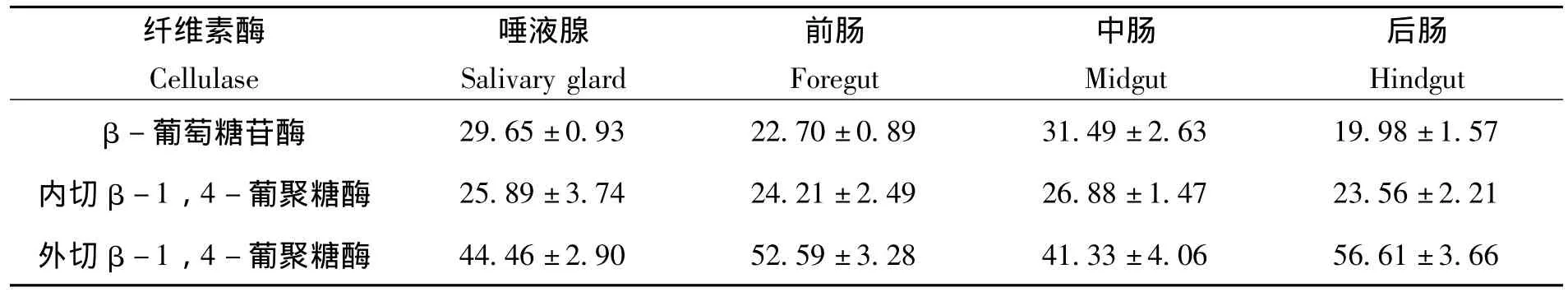
表2 家蝇3龄幼虫各组织3种纤维素酶活性所占比例 (%)Table 2 Proportion of activity of three enzymes in digestive organs from Musca domestica larvae
2.4 家蝇消化道内纤维素酶特性初步研究
2.4.1 最适反应时间的测定
在不同反应时间下测定EG、CBH和BG的酶活性,结果如图5所示.粗酶液与底物反应10 min至60 min后,3种纤维素酶随反应时间的增加,其酶活性也逐渐增强,在60 min时活性到达最高。而后随着反应时间的延长酶活性逐渐降低。据此确定家蝇纤维素酶活最适反应时间为60 min。
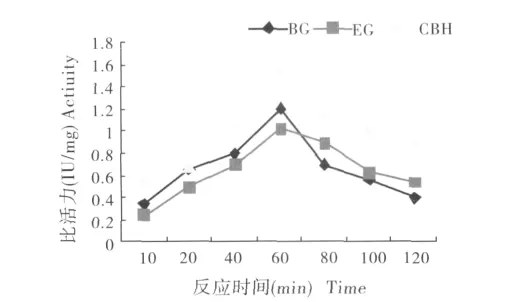
图5 不同反应时间下3种纤维素酶的活性Fig.5 Activities of the cellulases at different time
2.4.2 最适反应温度和热稳定性的测定
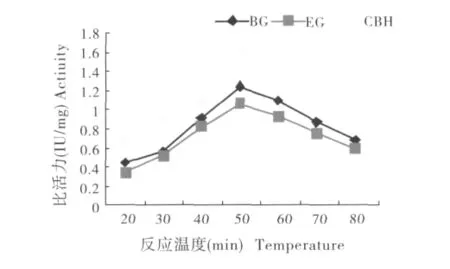
图6 不同反应温度下3种纤维素酶的活性Fig.6 Activities of the cellulases at different temperature
如图6所示,家蝇EG酶活性从20℃开始上升,到50℃时酶活性最高;BG在40至60℃时酶活较高,50℃时酶活性最高;CBH的酶活性在40℃至70℃酶的活性较高,在50℃时达到最高.因此确定3种酶最适反应温度为50℃。家蝇纤维素酶对温度的稳定性研究中发现,家蝇消化道内的BG、EG和CBH具有较强的热稳定性,在较低温度时 (20℃,30℃,40℃)仅降低 6.10% ~21.11%的活性,60℃是家蝇消化道内纤维素酶活性热稳定性变化的一个转折点,再此温度处理下酶活性下降了50.1% ~64.98%,在80℃以上基本完全失活 (表3)。
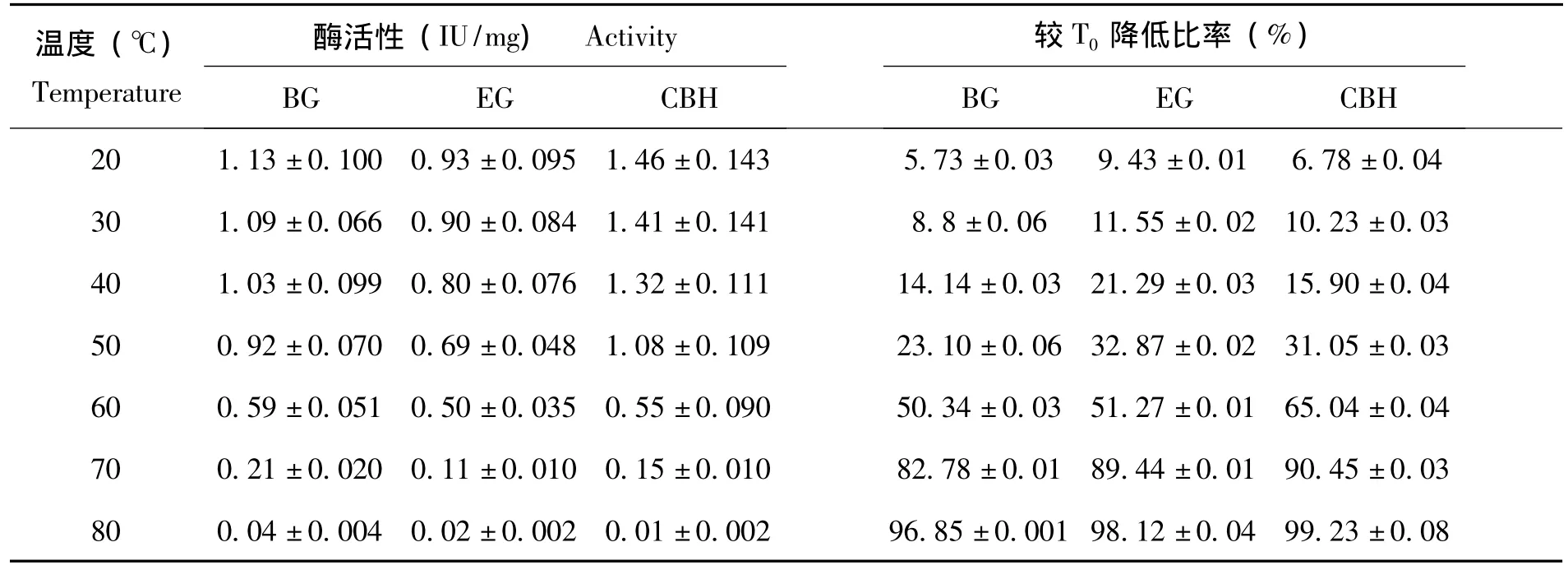
表3 家蝇3种纤维素酶的热稳定性Table 3 Stability of three enzymes from Musca domestica at different temperature
2.4.3 家蝇纤维素酶的混合底物实验
粗酶液与3种特异性底物混合进行反应时,测定家蝇纤维素酶体内EG、CBH和BG三种酶的综合做作用,其酶活性为 (1.045±0.030)IU/mg。
3 结论与讨论
昆虫与环境中的纤维素接触非常密切,越来越多的研究证实等翅目、鞘翅目、鳞翅目、双翅目昆虫具有纤维素酶活性,它们是自然界中协助进行碳循环的一类重要的昆虫。如斑蝥 (Sami et al.,2011)、白蚁 (Nathan et al.,2011;曾文慧等,2011;Tokuda et al.,2012)、草地贪衣蛾(Marana et al.,2004)和大蚊科 (Willis et al.,2010)等已有纤维素酶活性的报道。本研究以滤纸为底物证实家蝇具有纤维素酶活性,这为家蝇能够从富含纤维素的物质中获得生存所需的能量提供了实验依据。家蝇正是由于体内存在高效的纤维素酶才具有将纤维素转化为自身新陈代谢所需小分子碳水化合物的能力。目前已有白蚁纤维素酶在消化道定位的报道 (曾文慧等,2011),天牛的纤维素酶存在部位也有了一些研究 (Wei et al.,2006;索风梅等,2007)。但没有学者对家蝇纤维素酶种类和分布进行研究。本研究通过纤维素酶复合酶系3种酶的特异性底物检测到家蝇3龄幼虫唾液腺、前肠、中肠和后肠粗酶液均具有β-葡萄糖苷酶、内切β-1,4-葡聚糖酶和外切β-1,4-葡聚糖酶,为进一步研究家蝇消化纤维素的机制奠定了基础。
纤维素酶作为一种复杂酶系,酶系中各种酶发挥各自作用将纤维素降解为单糖。根据作用方式,首先EG水解纤维素非结晶区生成大量还原性或非还原性末端;然后CBH再进行降解生成大量纤维二糖,最后再由BG将纤维二糖水解成葡萄糖,从而完成降解纤维素的反应 (Beguin and Aubert,1994)。在纤维素降解的过程中可能存在酶的活性中心与不同底物间的竞争性抑制作用(王骥,2003;段旭等,2009)。这种竞争必将导致生成的单糖 (葡萄糖)的量减少。从混合底物实验结果中得到证实,家蝇纤维素酶系各酶系组分间也显示出生成单糖减少。
在进一步分析家蝇纤维素酶的性质中可以看出,随着反应时间的延长,能够更好的促进家蝇纤维素酶酶促反应。在不同温度下用粗酶液与底物作用,家蝇纤维素酶对温度比较敏感。在较低温度下,酶与底物亲和性弱,酶的活性显著降低,这可能与它的生活习性有关。同时发现家蝇纤维素酶与环毛蚓 (张炎,2006)和黑胸散白蚁 (许利霞等,2012)比较,显示出较好的稳定性且具有较高活性。这表明家蝇纤维素酶具有很好的应用前景。
在家蝇的消化系统内,纤维素酶的主要组成及其分布各不相同。这可能是与家蝇消化器官的功能不同造成的。家蝇的唾液腺主要是分泌唾液对吞咽食物起到润滑和帮助消化作用,因此纤维素酶较为丰富,而前肠是储存食物和调节食物进入中肠的作用,所以该处的酶活性较低。家蝇中肠是消化吸收的最主要的部位,其体积约占了消化道总长度的3/4,使食物有充分的时间与纤维素酶作用,因此该处的酶活性最高,后肠是排出食物残渣、代谢废物和吸回水分等的部位,不是降解纤维素酶的主要部位,所以酶活性也相对最低。本研究从对该物种纤维素酶分布情况进行分析,为家蝇纤维素酶主要是家蝇自身分泌提供了理论依据。
References)
Beguin P,Aubert JP,1994.The biological degradation of cellulose.Federation ofEuropean MicrobiologicalSocieties(FEMS).Microbiology Reviews,13(1):25-58.
Smith PK,Krohn RI,Hermanson GT,Mallia AK,Gartner FH,Provenzano MD,Fujimoto EK,Goeke NM,Olson BJ,Klenk DC,1985.Measurement of protein using bicinchoninic acid.Anal.Biochem.,150(1):76-85.
Clarke AJ, 1997. Biodegradation ofCellulose:Enzymology and Biotechnology.Lancaster:Technomic Pub.Co.:23 -68.
Duan CJ,Feng JX,2010.Mining metagenomes for novel cellulase genes.Biotechnol.Lett.,32:1765 -1775.
Duan X, ZhangJJ, ZhuJL, CaiHH, ChenFF, GuoAW,2009.Comparison research on cellulase system from Monochamus alternatus and Cipangopaludina chinensis.JournalofYunnan Agricultural University,24(4):545-551.[段旭,张晶晶,朱静,蔡护华,陈粉粉,郭爱伟,2009.松墨天牛和中国圆田螺体内纤维素酶系的比较研究.云南农业大学学报,24(4):545 -551]
Liu N,Yan X,Zhang M,Xie L,Wang Q,Huang Y,Zhou X,Wang S,Zhou Z,2011.Microbiome of fungus-growing termites:a new reservoir for lignocellulase genes.Appl.Environ.Microb.,77(1):48-56.
Marana SR,Andrade EH,Ferreira C,Terra WR,2004.Investigation of the substrate specificity of a beta-glycosidase from Spodoptera frugiperda using site-directed mutagenesis and bioenergetics analysis.Eur.J.Biochem.,271(21):4169 -4177.
Miller GL,1959.Use of dinitrosalicylic acid reagent for determination of reducing sugar.Analytical Chemistry,31:426-428.
Nathan L,Gaku T,Hirofumi W,2011.Evolution and function of endogenous termite cellulases.Springer:Biology of Termites:A Modern Synthesis.:51-67.
Sami AJ,Anwar MA,Rehman FU,Shakoori AR,2011.Digestive cellulose hydrolyzing enzyme activity(endo-β-1,4-D-glucanase)in the gut and salivary glands of blister beetle,Mylabris pustulata.Pakistan J.Zool.,43(2):393-401.
Suo FM,Wang HJ,Ding ZW,Xu TS,2007.Study on the character ofcellulase in Monochamus alternatusⅣ.Effect of feeding conditions on the Monochamus alternatus cellulase activity.Forest Research,20(3):381-384.[索风梅,王浩杰,丁中文,徐天森,2007.松墨天牛纤维素酶的研究Ⅳ.取食条件对松墨天牛纤维素酶活性的影响.林业科学研究,20(3):381-384]
Tokuda G,Watanabe H,Hojo M,Fujita A,Makiya H,Miyagi M,Arakawa G,Arioka M,2012.Cellulolytic environment in the midgutofthewood-feedinghighertermiteNasutitermes takasagoensis.Journal of Insect Physiology,58(1):147-154.
Teng YG,Yin QY,Ding M,2010.Purification and characterization of a novel,AfEG22,from the giant endo-β -1,4 - glucanase snail,Achatina fulica Ferussac.Acta Biophys Sin.,42:729-734
Wang J,2003.The Study on the Multi- functional Cellulase EGX from Mollusca, Ampullaria crossean. PhD Dissertation. Shanghai:Institute of Biochemistry and Cell Biology Shanghai,SIBS,CAS.[王骥,2003.福寿螺多功能纤维素酶EGX的研究.上海:中国科学院上海生命科学研究院生物化学与细胞生物学研究所.博士论文]
Wei YD,Lee KS,Jin BR,GuiZZ,Hyung JY,Iksoo K,Zhang ZG,Guo XJ, HungDS, ByungRJ, 2006. Molecularcloning,expression,and enzymatic activity of a novel endogenous cellulase from the mulberry longicorn beetle,Apriona germari.J.Compartive Biochemistry and Physiology,part B,145:220-229.
Willis JD,Klingeman WE,Oppert C,Oppert B,Jurat- Fuentes JL,2010.Characterization of cellulolytic activity from digestive fluids of Dissosteira carolina(Orthoptera:Acrididae).Comp.Biochem.Physiol.Biochem.Mol.Biol.,157(3):267 -72.
Xu LX,Xu R,Zhao HY,Yang H,2012.In vitro characteristics of the cellulases from Reticulitermes chinensis Snyder.Chin.J. Appl.Environ.Biol.,18(1):070-074. [许利霞,徐荣,赵焕玉,杨红,2012.黑胸散白蚁纤维素酶的体外酶学特性.应用与环境生物学报,18(1):070-074]
Yin YP,Cao Y,He ZB,Dong YM,2000.Origin and distribution of three digestive enzymes in the brown mulberry longhorn borer Apriona germari(Hope). Coleoptera:Cerambucider. Scientia Silvas Sinicae,36(6):82-85.[殷幼平,曹月青,何正波,董亚敏,2000.桑粒肩天牛3种纤维素消化酶的分布.林业科技,36(6):82-85]
Zeng WH, Liu RX, LiZQ, Liu BR, LiQJ, Chen LQ,2011.Induction effect of six glycosides on glycosylhydrolase secretion ofCoptotermesformosanus.JournalofEnvironmental Entomology,33(1):30-35[曾文慧,刘瑞娴,李志强,刘炳荣,李秋剑,陈来泉,钟俊鸿,2011.种糖基化合物对台湾乳白蚁糖基水解酶分泌的影响.环境昆虫学报,33(1):30- 35]
Zhang Y,2006.Purincation and enzymatic character analysis of β -1,4 - glucanase endoglucanase from Pheretima.M.S.Dissertation.Jinan University.[张炎,2006.环毛蚓内切纤维素酶的分离纯化及酶学特点.暨南大学硕士论文]
