油桐种子LOX基因的克隆与生物信息学分析
2013-04-04朱凤云陈鸿鹏谭晓风
朱凤云,陈鸿鹏,谭晓风
(1.黄淮学院 生物工程系,河南 驻马店 463000;2.国家林业局 桉树研究开发中心,广东 湛江 524022;3. 中南林业科技大学 经济林育种与栽培国家林业局重点实验室,湖南 长沙 410004)
在当前全球化石能源枯竭、环境污染严重的情况下,人们开始寻找新的可再生能源,植物能源的开发研究已成为当今新能源研究的热点之一[1]。
油桐Vernicia fordii为大戟科木本油料植物,是我国特有的重要工业油料树种。桐果含油量高,全干桐仁的含油率高达71.91%。油桐种子榨取的桐油中不饱和脂肪酸含量达94% , 其中,α-桐酸含量占脂肪酸总量的80%左右[2]。由于α-桐酸是一种含有共轭双键的不饱和脂肪酸,所以桐油极易在空气中被氧化聚合生成致密的保护漆膜。因此,桐油是植物油中最优质的干性油,是制造优质油漆和油墨的基本原料,可用于制取大规模集成电路板的浸渍材料,同时还是制造生物柴油的优质原料,可以缓解我国能源短缺的问题,是一种很有潜力的生物质能源树种[3-4],并且已开展了相关的分子生物学研究[5-6]。
脂氧合酶(lipoxygenase,LOX,EC1.13.11.12),又名亚油酸:氧氧化还原酶,俗称脂肪氧化酶、脂肪加氧酶、脂肪氧合酶或类胡萝卜素氧化酶,1932年首次发现广泛存在于哺乳动物、植物和微生物中[7-9]。脂氧合酶在真核生物中参与不饱和脂肪酸的代谢,是动植物体内催化脂质降解的关键酶,也是茉莉酸合成途径的关键酶[8,10],植物膜脂中富含的亚油酸和亚麻酸是其主要的反应底物[11-18]。研究表明,LOX在植物的生长、发育、衰老以及环境胁迫反应中起重要调节作用,引起了植物学界的广泛兴趣,其基因表达和调控也已经成为研究真核生物基因表达的模式系统[14,19-20]。目前,已在小麦、玉米、猕猴桃、番茄、桃、大豆、沙梨、油橄榄等植物种子中发现脂氧合酶的存在,并对LOX基因进行了初步研究。本研究中对油桐种子中LOX基因的全长cDNA进行了克隆和生物信息学分析,旨在为油桐生长过程中的该基因功能及其对油脂品质的影响等相关研究的开展提供依据。
1 材料与方法
1.1 材 料
1.1.1 植物材料
本试验中以油桐的近成熟种子为材料。2011年9月下旬,采自于湖南省湘西自治州的种质资源库,于液氮中保存备用。
1.1.2 主要试剂
Prime-star高保真酶购自Takara公司;感受态细胞为大肠杆菌DH5α、dNTPs、DNA凝胶回收试剂盒等购自Ambio公司;100 bp plus DNA Ladder购自Takara公司;DNase、RNA提取试剂盒、5′RACE 和 3′RACE 试剂盒购自 Invitrogen 公司;cDNA反转录试剂盒购自Thermo公司;pEASYBlunt Simple克隆载体购自北京全式金公司;其它生化试剂和常规试剂如DEPC、H2O、Tris、EDTA、无水乙醇、EB、巯基乙醇等均为分析纯,购于国药集团化学试剂有限公司。
1.1.3 生物信息学软件
Vector NTI 11.0、GENEDOC、Gene Tree、Chromas、Primer Premier 5.0以及Anteprot 5.0等。
1.2 方 法
1.2.1 油桐种子cDNA 的制备
将超低温保存的油桐种子迅速取出,在液氮中研磨成粉末,参照Total RNA Purification System的说明提取总RNA,并用琼脂糖凝胶进行电泳检测。
按照cDNA 反转录、5′RACE以及3′RACE说明书,对提取的总RNA进行反转录,得到的总cDNA、5'cDNA及3'cDNA作为PCR扩增的模板。
1.2.2 Vf-LOX基因保守区片段的克隆
根据GenBank 基因库中已公布的高等植物(油橄榄、大豆、拟南芥、葡萄等)的LOX基因序列的保守区,进行BLAST X比对分析,设计1对简并引物,并由深圳华大基因公司合成。
Vf-LOX-F1: 5'-TATGACTATGCTTACTACAAT GAYTT-3';
Vf-LOX-R1: 5'-CTTAGAGTKGGGCGRTTTG GRAGGT-3'。
以油桐种子cDNA为模板,选用Vf-LOX-F1与Vf-LOX-R1为引物进行PCR扩增。总体积50 μL的PCR 反应体系:0.5 μL PrimeStar聚合酶(5 U/μL),5.0 μL 10×PCR 缓冲液(Mg2+),4.0 μL dNTPs(各2.5 mmol/L),2.0 μL cDNA,1.0 μL Vf-LOX-F1(10 μmol/L),1.0 μL Vf-LOX-R1 (10 μmol/L),31.5 μL ddH2O。PCR扩增条件:98 ℃预变性5 min;98 ℃变性 10 s,68 ℃退火 30 s,72 ℃延伸1 min,5个循环;98℃变性10 s,64 ℃退火30 s,72 ℃延伸1 min,5个循环;98 ℃变性10 s,60 ℃退火30 s,72 ℃延伸1 min,25个循环;72 ℃继续延伸5 min;4 ℃保温。之后在琼脂糖凝胶中进行电泳检测,并对目的产物进行回收、克隆和测序。
1.2.3 Vf-LOX基因5'端和3'端片段的克隆
根据已有基因片段,通过Primer Premier 5.0分别设计了Vf-LOX基因的3条5'RACE和2条3'RACE引物,由深圳华大基因公司合成并通过PAGE方式进行纯化。
Vf -LOX基因的5'RACE特异引物设计如下。
Vf-LOX-GSP 1:5′-CCGACATCTTCAAGTGA CCAAACCGTT-3′;
Vf-LOX-GSP 2:5′-GAAGCTCCAACC TACTCTCCGATT - 3′;
Vf-LOX-GSP 3:5′-TGGGCGGGCATATTTG GA-3′。
Vf-LOX基因的3'RACE特异引物设计如下。
Vf-LOX-GSP 4:5′-GAGTGGCGGTGAAGGA TGACAATGCT-3′;
Vf-LOX-GSP 5:5′-TTGTCAAGGCATTCGTC AGATGAGGTC-3′。
以油桐种子5'RACE cDNA为模板,选用5' RACE引物与UPM为引物进行巢氏PCR扩增。50 μL 的 PCR 反应体系:0.5 μL PrimeStar聚合酶(5 U/μL),5.0 μL 10×PCR 缓冲液(Mg2+),4.0 μL dNTPs( 各 2.5 mmol/L),2.0 μL cDNA,1.0 μL Vf-LOX-GSP 1 (10 μmol/L),1.0 μL UPM (10 μmol/L),31.5 μL ddH2O。PCR 扩增条件:98 ℃预变性 5 min;98 ℃变性 10 s,62 ℃退火 30 s,72 ℃延伸1 min,5个循环;98 ℃变性10 s,60 ℃退火30 s,72 ℃延伸1 min,5个循环;98 ℃变性10 s,58 ℃退火30 s,72 ℃延伸1 min,25个循环;72 ℃继续延伸5 min;4 ℃保温。在此次扩增之后,继续用Vf-LOX-GSP 2和Vf-LOX-GSP 3做巢氏PCR,以提高产物纯度,体系不变,并对5'RACE产物进行回收、克隆和测序。
同理,以3'RACE cDNA为模板,反应体系同5'RACE,分别以AUAP和Vf-LOX-GSP 4、Vf-LOX-GSP 5为引物进行巢式PCR扩增。PCR扩增条件:98 ℃预变性5 min;98 ℃变性10 s,60 ℃退火30 s,72 ℃延伸1 min,35个循环;72 ℃继续延伸5 min;4 ℃保温,并对3'RACE产物进行回收、克隆和测序。
1.2.4 Vf-LOX基因的生物信息学分析
将扩增获得的油桐基因片段利用软件拼接以后,利用生物学软件进行翻译,得到所编码蛋白质的氨基酸序列,利用在线工具进行蛋白质序列的功能域及结构域的预测。
2 结果与分析
2.1 基因克隆
2.1.1 RNA检测
取3µL的RNA样品在1.2%琼脂糖凝胶进行电泳检测,电泳结果如图1所示。由图1中可以看出,油桐种子中所提取的总RNA样品电泳条带清晰,5.8S含量很少,表明降解很少,特别是28S和18S的比例基本呈2∶1的状态,具有较高的纯度和完整性,可以作为后续cDNA反转录的模板。

图1 总RNA的电泳检测结果Fig.1 Electrophoresis result of total RNA
2.1.2 基因片段的扩增
以反转录的cDNA为模板,使用Vf-LOX-F1、Vf-LOX-R1引物组合进行PCR扩增,得到1条约1700bp的片段。将此基因片段进行克隆和测序获得序列信息,经Vector NTI 11.0和NCBI Blast进行比对分析后,确认此序列片段是LOX基因的保守区部分片段(见图2)。
以 5′RACE cDNA 为模板,5′RACE引物 与UPM为引物进行巢氏PCR扩增后,获得了条带清晰特异、大小约为1100bp的DNA条带(见图3)。此外,利用获得的已知序列设计特异性引物,用3′RACE技术从油桐种子cDNA中扩增出1条约600bp的产物(见图4)。

图2 LOX基因保守区片段电泳结果Fig.2 Electrophoresis result of conserved region fragment in LOX gene
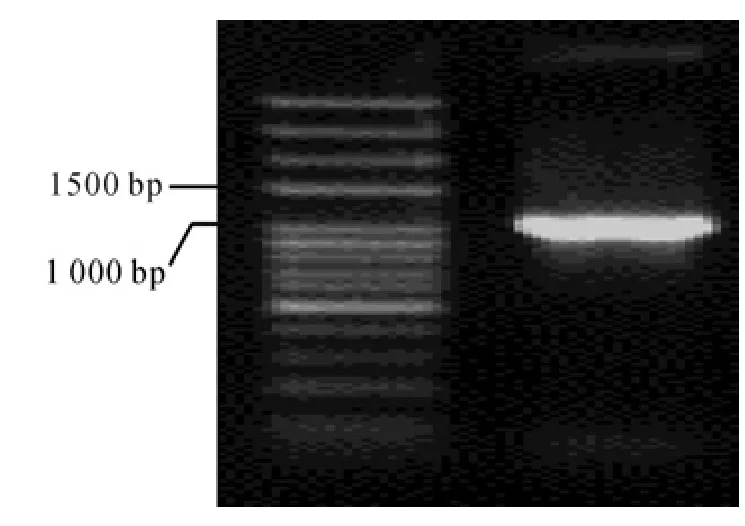
图3 LOX基因的5′RACE片段电泳结果Fig.3 Electrophoresis result of 5′RACE fragment in LOX gene

图4 LOX基因的3′RACE片段电泳结果Fig.4 Electrophoresis result of 3′RACE fragment in LOX gene
2.2 Vf-LOX基因的全长cDNA序列分析
将中间保守区段、5' RACE和3' RACE各片段测序结果去除载体序列部分进行拼接,获得了油桐种子LOX基因的全长cDNA。应用生物软件Vector NTI 11.0分析测序结果得出,该基因cDNA全长2690bp, 包括5'非编码区142 bp、3'非编码区154 bp以及1个长2394 bp的编码区和poly(A)尾巴(17bp),起始密码子为ATG,终止密码子为TAA,该基因开放阅读框编码797个氨基酸(见图5)。

图5 Vf-LOX基因的全长cDNA序列与蛋白质序列的分析Fig.5 Full-length cDNA and deduced protein sequences in Vf-LOX gene
2.3 Vf-LOX基因的蛋白质序列
对Vf-LOX基因进行ORF预测,并应用Vector NTI 11.0将编码部分翻译成蛋白质序列,并与其它不同来源的LOX进行比对分析,发现油桐LOX序列与其它物种LOX基因同源性较高,如其编码的氨基酸序列与茶、葡萄、辣椒、马铃薯的LOX氨基酸序列的同源性达99%,与橄榄、烟草、番茄、猕猴桃的LOX氨基酸序列的同源性达98%,由此,可推测该片段是LOX基因。
此外,脂氧合酶基因家族根据其催化亚油酸中加氧位置的不同,分为9-LOX、13-LOX2种类型[16],9-LOX和13-LOX在序列长度上有差异,13-LOX在N端含有额外约60个氨基酸残基[18]。在对油桐LOX序列的分析中,发现其N端缺少约40个氨基酸残基(见图6),推测其应属于9-LOX。另外,根据氨基酸序列分析结果,该酶在C-末端具有和其它物种的高保守区GIPNSVSI,序列中还存在几个高保守性的区域,如底物结合区KSAWRTDEEFAREMLA(氨基酸366~379)、氧结合区IASALHAAVNFGQ(氨基酸719~729),Siedow 等认为它们同酶的催化作用相关[16]。

图6 Vf-LOX与不同植物LOX的蛋白质序列比对结果Fig.6 Comparison of LOX protein sequences in Vernicia fordii and other plants
2.4 分子系统进化聚类分析
为探讨油桐LOX与其它植物同类基因的亲缘关系和可能的作用方式,应用AlignX软件对该基因编码的蛋白质与拟南芥、大豆、油菜、茶叶等物种的已知基因氨基酸序列进行比对分析,结果见图7。图7中结果显示,这些植物的LOX在进化上主要形成了3个分支,其中第1个分支又分成了2个分支:拟南芥和油菜亲缘较近,之后与大豆聚为1类,再与棉花聚合成1个亚分支;棉花,烟草与马铃薯聚为1类,之后与辣椒聚为1类,再与油橄榄聚合成1个亚分支;油桐与茶进化关系最近,聚在一起形成1个分支;葡萄单独成为1个分支。

图7 油桐与其它植物LOX的进化树Fig.7 Phylogenetic tree of LOX Vernicia fordii and other plants
运用生物软件Antheprot 5.0对油桐LOX的蛋白质序列进行理化性质的分析,发现此蛋白质的相对分子质量约为91 423.339 Da;理论等电点5.415(见图 8);在 34、227、465、502、651、715 aa处等发现了信号肽剪位点(见图9),其中715 aa处可能性最大。639~648 aa为跨膜区(见图10),从而使LOX可以跨膜去行使功能。
利用在线分析软件http://www.expasy.org/cgibin/protscale.pl, 选 择 Hphob./Kyte& Doolittle 模式,对油桐LOX蛋白的疏水性进行分析预测,疏水性分析结果如图11所示,该蛋白的疏水指数从-2.978到2.567,约在第50、648、712 位表现出较强的疏水性,在第92、620、765 位表现出较强的亲水性。对Vf-LOX进行亚细胞定位发现,油桐LOX主要在细胞内的叶绿体、细胞质中分布(见表1),且以细胞质为主,这与其它物种该基因相关研究结论是一致的[8]。

图8 Vf-LOX等电点的预测Fig.8 Prediction of isoelectric point of Vf-LOX
经过三维建模和在线结构工具分析,用VMD软件优化后,得到了Vf-LOX的3D结构(见图12)。从图12中可以看出,此蛋白经过几次折叠后,主要以α螺旋为主,包括长螺旋(深色柱状部分)和短螺旋(灰色柱状部分),并伴有一些β折叠(浅色带箭头片状部分),其间由一些转角等相互连接(深色和浅色线条部分)。

图9 Vf-LOX的信号肽剪切位点的预测Fig.9 Prediction of spliced site for signal peptide in Vf-LOX
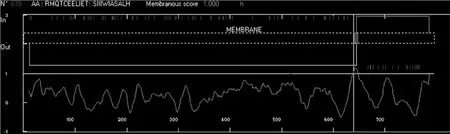
图10 Vf-LOX跨膜结构域的预测Fig.10 Prediction of transmembrane domain in Vf-LOX
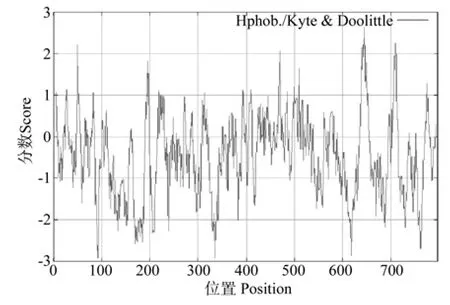
图11 Vf-LOX的疏水性分析Fig.11 Hydrophobicity analysis of Vf-LOX
3 结论与讨论
脂氧合酶基因广泛存在于植物中,它参与不饱和脂肪酸的代谢,参与催化脂质的降解与茉莉酸的合成,与植物的生长、发育过程关系密切,由于脂氧合酶对油脂的氧化作用,其对油脂品质影响也较大[6-7]。目前,大量的研究工作主要是集中于酶的活性等生理学方面,但迄今尚不完全清楚该酶的生理功能,尤其是对脂质合成代谢的调控作用研究不多。LOX在不同的组织或同一组织的不同发育阶段有不同的表达模式,利用分子生物学技术,获取种子中该基因的序列信息,从分子水平揭示该基因在植物果实成熟衰老及脂质降解进程中的作用,对脂氧合酶的调控机理的研究也具有重要的意义[6,8]。本研究中对油桐种子进行该基因的克隆分析,获得油桐LOX基因的cDNA片段序列, 长度为2 111 bp,编码604个氨基酸,起终止密码子为TAA。该序列与其它物种进行相似性比较后发现相似性非常高。在本研究中,从油桐果实中成功地克隆了LOX基因的中间保守区段、5'端部分和3'端的部分序列,并通过序列拼接获得了LOX基因的全长cDNA序列。

表1 Vf-LOX的亚细胞定位预测分析Table 1 Location prediction for Vf-LOX at sub-cellular level

图12 Vf-LOX的3D结构预测Fig.12 Prediction of 3D structure of Vf-LOX
参考文献:
[1] 张玲玲,彭俊华. 油桐资源价值及其开发利用前景[J]. 经济林研究 ,2011,29(2): 130- 135.
[2] 何 方,何 柏,王承南,等. 油桐产品质量等级标准制订说明[J]. 经济林研究, 2005, 23(4): 118-122.
[3] 谭晓风,蒋桂雄,谭方友,等. 我国油桐产业化发展战略调查研究报告[J]. 经济林研究, 2011, 29(3): 1-7.
[4] 张玲玲,彭俊华. 油桐资源价值及其开发利用前景[J]. 经济林研究 , 2011, 29(2): 130- 135.
[5] 李建安,孙 颖,陈鸿鹏,等.油桐LEAFY同源基因片段的克隆与分析[J]. 中南林业科技大学学报,2008,28(4): 21-26.
[6] 龙洪旭,谭晓风,陈 洪,等. 油桐油体蛋白基因的克隆及序列分析[J]. 中南林业科技大学学报,2010,30(4): 31-38.
[7] Brash A R. Lipoxygenases: Occurrence, functions, catalysis, and acquisition of substrate [J]. J Biol Chem, 1999,274(34):23679 - 23682.
[8] Feussner I, Wasternack C. The lipoxygenase pathway [J]. Annu Rev Plant Biol, 2002, 53: 275 - 297.
[9] 李彩凤,赵丽影,陈业婷,等. 高等植物脂氧合酶研究进展[J]. 东北农业大学学报, 2010, 41(10): 143-149.
[10] 汪 仁,沈文飚,江 玲,等. 水稻种子脂氧合酶基因OsLOX1的原核表达、纯化及鉴定[J]. 中国水稻科学, 2008,22(2): 118 - 124.
[11] 陈昆松,张上隆,Gavin S Ross. 猕猴桃成熟果实中脂氧合酶基因的克隆[J]. 园艺学报,1998,25(3): 230-235.
[12] 张 波,李 鲜,陈昆松. 基于EST库的猕猴桃脂氧合酶基因家族成员的克隆[J]. 园艺学报,2008,35(3): 337-342.
[13] 胡廷章,胡宗利,屈霄霄,等. 植物脂肪氧化酶的研究进展[J]. 生物工程学报,2009,25(1):1-9.
[14] 汪 仁,沈文飚,翟虎渠,等. 植物种子脂氧合酶[J]. 植物生理学通讯,2005,41(3): 388-393.
[15] 陈书婷,孔祥珍,华欲飞,等. 大豆脂肪氧合酶催化合成亚麻酸氢过氧化物的研究[J]. 中国油脂,2011,3(4): 388-393.
[16] 田其英,华欲飞. 大豆脂肪氧合酶研究进展[J]. 粮食与油脂,2010,(8): 6 - 9.
[17] 蔡 琨,周建东,方 云,等. 大豆脂肪氧合酶酶促合成亚油酸氢过氧化物[J]. 精细化工,2005,22(1): 74-77.
[18] Siedow JN. Plant lipoxygenase: structure and function [J]. Annu Rev Plant Physiol Plant Mol Biol,1991,42: 145 - 188.
[19] Boyington J C, Gaffney BJ, Amzel LM. The three dimentional structure of an arachidonic acid 15-lipoxygenase [J].Science,1993,260:1482 - 1486.
[20] Casey R. Lipoxygenases[C]//Shewry P R, Casey R. Seed Proteins. Dordrecht, the Netherlands: Kluwer Academic Publishers, 1999: 865 - 708.
