丛枝菌根真菌对农药三环唑的残留减量研究
2013-03-28李世阳张淑娟徐亚男
马 放,李 哲,王 立,李世阳,张淑娟,徐亚男
(哈尔滨工业大学 城市水资源与水环境国家重点实验室,150090 哈尔滨)
农残超标带来的食品安全问题和农药过量施入带来的严重面源污染风险是当前的热点问题.我国2010年施用化学农药264.8万 t[1],过量施用的农药一方面以不同形式进入到环境中,造成严重的面源污染[2-4];另一方面在作物体内蓄积,严重影响食品质量[5].2009年南方某地区水稻稻壳抽样检测结果表明,农药残留超标率达14.2%[6].丛枝菌根真菌(Arbuscular Mycorrhizal Fungi,AMF)是一种内生菌根真菌,可与地球上90%的维管植物根系结合,形成丛枝菌根结构[7-9].菌根化的植物对农药有很强的耐受性,并能把一些有机农药转化为菌根真菌和植物的营养物质,从而降低农药造成的污染[10-11].已有研究证明,接种AMF的植物根系能吸收土壤中残留的DDT,降低土壤中和植物茎叶中的含量[12].球囊霉 (Glomus intraradices,GI)和摩西球囊霉(Glomus mosseae,GM)是两种广适性的 AMF,能够与大多数植物形成良好共生体系,具有良好的农药抗性与消解效能[13],宋福强等于盆栽高粱条件下研究了AMF根内GM、GI消解土壤中阿特拉津的效用,接种GM处理的土壤中阿特拉津最高消解率达 91.6%[14].
针对北方稻区稻瘟病发病严重的现状,选择防治稻瘟病最常用的农药三环唑作为研究对象,比较两种优势土著AMF(GM、GI)单独施用和混合施用,对受不同质量分数三环唑污染的水稻土壤及植株进行生物修复,通过测定土壤及水稻植株中三环唑残留量的变化,研究接种不同AMF对不同质量分数三环唑消解率的影响,并筛选出优势菌种,为研究AMF对土壤及水稻植株中的农药消解效果提供依据.
1 试验
1.1 试验材料
试验样地:黑龙江省双城市前进乡城市水资源与水环境国家重点实验室“农用化学品源头减量示范基地”(E:125°41'-126°42',N:45°08'-45°43');试验田土壤中水解性氮110.43 mg/kg,有效磷422.37 mg/kg;pH为6.48.
供试菌剂:丛枝菌根真菌(AMF)广适菌种,包括摩西球囊霉(GM)、根内球囊霉(GI)、混合菌剂(GM+GI).
植物宿主:水稻(Oryza sativa),品种为北稻4号,种子购于黑龙江省农科院.种子用水浸泡,30℃保湿催芽,待芽长至约1 cm时,筛选长势相近的水稻种子用于试验.
供试农药:三环唑75%可湿性粉剂(江苏丰登农药有限公司),三环唑原药(国家标准物质)纯度99.6%.
1.2 试验田设计
试验田共4块,分别按照三环唑正常施加量的50%、100%、150%、200%进行喷药,并设置不加药的空白.每块试验田的面积为8 m×8 m,于四周各留出1 m作为保护区,内部6 m×6 m进行试验.将试验区按十字分成4块,每块大小为2.5 m×2.5 m,每小块田之间留有1 m间隔,4块小田分别设置接种摩西球囊霉、根内球囊霉、两种菌的混菌以及不接菌的处理.
施药剂量及时间:75%三环唑可湿性粉剂,262.5 g/hm2(有效成分196.9 g/hm2,每块小试验田面积为2.5 m×2.5 m,添加0.2 g原药为正常(100%)施加量;三环唑施加时间为水稻苗期自然生长一个月之后.
1.3 试验方法
1.3.1 AMF接种及测定
接种:水稻种子采用条播的方法,每个小区设计20垅,分别将不同设计的菌剂均匀撒入垅中.
侵染率测定:侵染率测定样品采样时间为水稻自然生长一个月后.采用Phillip的KOH脱色-酸性品红染色方法.随机选取120条根段染色、制片,观察侵染率变化,并根据十字交叉法计算菌根侵染率[16].
菌根依赖性指数[17]IMD=接菌后植物生物量(M+)/未接菌植物生物量(M-)×100%.
1.3.2 采样方法
分别于喷药后2 h、1、3、5、7、10、14、21 d 进行采样.土壤样品在每个小区采10个点,总量不少于1 kg,混匀后采用4分法留样品500 g左右,盛放于封口塑料袋中,实验室-20℃保存.植株样品在每个小区采10个点,总量不少于1 kg,剪碎混匀后采用4分法留样品500 g左右,盛放于封口塑料袋中,实验室-20℃保存.
1.3.3 残留提取方法
三环唑提取方法参考文献[15],并作适当改进.
1.3.4 残留量拟合方法
一级化学反应动力学方程式为ln c=-Kt+ln c0,将其变形为c=c0e-Kt.将此公式应用于实验结果可得c=k0c0e-Kt,其中c0为施药后三环唑的初始残留量;c为施药后间隔t时间的三环唑残留量;K为消解速率常数;k0为初始残留量修正系数;t为施药后的天数.
2 结果与分析
2.1 菌剂侵染情况
自然条件下,仍可检出AMF对水稻的侵染,表明自然基质中水稻与土著AMF形成共生体的现象是普遍存在的,但是自然侵染率很低(3.34%)(图1,2).

图1 不同AMF菌剂施用小区水稻的侵染率
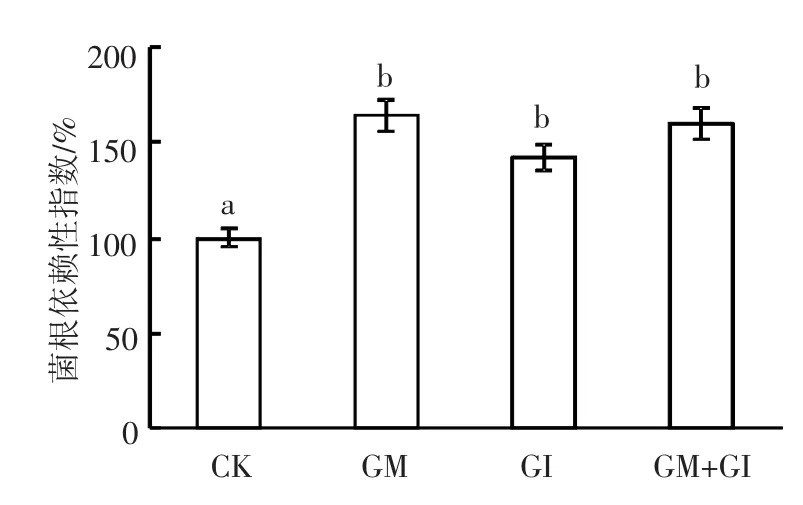
图2 不同AMF菌剂施用小区水稻的菌根依赖性指数
与CK相比,人工强化施加菌剂可极显著提高AMF对水稻的侵染作用(P<0.05),并可显著提高菌根依赖性指数(P<0.05).单独施加菌剂时,GM(侵染率53.86%)对水稻的侵染效果优于GI(侵染率34.57%),且效果显著(P <0.05).两种菌剂混合施加时的侵染效果最好,侵染率达56.06%,显著好于单独施加GI(P<0.05).单独施加GM(IMD=164%)、GI(IMD=142%)和施加混合菌剂(IMD=160%)的处理之间菌根依赖性指数差异无统计学意义.结果表明,GM+GI对水稻的侵染效果最佳,侵染效果优于单菌.
2.2 AMF对土壤中三环唑残留的影响
以田间施用量为标准,模拟减半和倍增质量分数梯度设计,考察不同梯度三环唑质量分数条件下,AMF对土壤残留的影响.测得不同处理在不同时间的残留量,拟合出消解曲线,得消解动态方程.根据经验,稻田土壤中三环唑的残留量与其施用后的取样时间之间呈较明显的负指数关系,采用一级化学反应动力学方程式进行模拟.
根据实测数据三环唑在土壤中的残留量在第3天达到最大值,第3天以后开始下降,因此,残留拟合从第3天开始,共取6个点(图3、表1).

表1 不同AMF菌剂施用小区土壤中三环唑残留量随时间变化的拟合
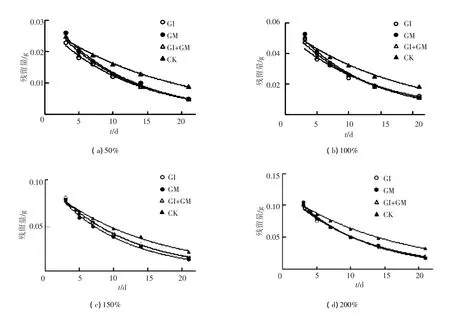
图3 不同AMF菌剂施用小区土壤中三环唑的残留量随时间变化
结果表明,在土壤的不同处理中,施加菌剂的处理三环唑的消解速率均不同程度地大于CK,半衰期均低于CK,表明AMF的加入对土壤中三环唑的消解有明显的促进作用.
不同质量分数处理条件下,GM和GM+GI消解速率接近,均高于GI.在一定范围内随着三环唑质量分数升高,其在土壤中的消解速率也逐渐加快,在1.5倍田间施用三环唑质量分数时,其消解速率最快,超过这一质量分数三环唑的消解速率明显下降,表明AMF对田间正常施用质量分数的三环唑具有一定的耐药性,超过1.5倍田间施用质量分数AMF活性将受到抑制.
加入菌剂后土壤中三环唑的半衰期明显低于不加菌剂的空白.GI在50%低质量分数下对土壤中三环唑消解影响最大,GM在150%高质量分数下对土壤中三环唑消解影响最大.GM+GI在质量分数100%和200%情况下效果最好,并且在4种质量分数处理下效果稳定.3种不同菌剂处理在农药质量分数150%时半衰期最低,能发挥最大效应.
取土壤不同处理在21 d的消解率作图,结果如图4.

图4 施药21 d后不同处理水稻土壤中三环唑消解率
GM的侵染率低于GM+GI,但在不同处理里GM的消解率均为最大,说明GM的促消解效果优于GM+GI.GM+GI的侵染率最高,在4种质量分数下效果较稳定.
综上,土壤中3种菌剂处理对三环唑的消解效果由大到小为GM+GI>GM>GI,4种不同质量分数下菌剂在150%施药情况下可以发挥最好效果.因此,在土壤中加入150%质量分数摩西和根内混合菌剂的情况下三环唑消解情况最好.
2.3 AMF对水稻植株中三环唑残留的影响
以田间施用量为标准,模拟减半和倍增质量分数梯度设计,考察不同梯度三环唑质量分数条件下,AMF对水稻植株中残留的影响.测得不同处理在不同时间的残留量,拟合出消解曲线,得消解动态方程.根据经验,水稻植株中三环唑的残留量与其施用后的取样时间之间呈较明显的负指数关系,采用一级化学反应动力学方程式进行模拟.
根据实测数据,三环唑在水稻植株中消解较快,在第14天消解率已全部达90%以上,因此,残留拟合的最后一点取第14天即可,共计7个点(图5、表2).

表2 不同AMF菌剂施用小区水稻植株中三环唑残留量随时间变化的拟合

图5 不同AMF菌剂施用小区水稻植株中三环唑的残留量随时间变化
结果表明,在水稻植株的不同处理中,施加菌剂的处理三环唑的消解速率均不同程度地大于CK,半衰期均低于CK,表明AMF的加入对水稻植株中三环唑的消解有明显的促进作用.
不同质量分数处理条件下,GM消解速率最大,均高于GI和GM+GI.在一定范围内随着三环唑质量分数升高,其在水稻植株中的消解速率也逐渐加快,在1.5倍田间施用三环唑质量分数时,其消解速率最快,超过这一质量分数三环唑的消解速率明显下降,表明AMF对田间正常施用质量分数的三环唑具有一定的耐药性,超过1.5倍田间施用质量分数AMF活性将受到抑制.
加入菌剂后水稻植株中三环唑的半衰期明显低于不加菌剂的空白.不同质量分数处理下,3种菌剂对三环唑的半衰期影响效果大小为GM>GM+GI>GI.GI在农药质量分数200%时半衰期最短,说明GI可以在农药质量分数较高时发挥最好效果.GM和GM+GI在农药质量分数150%时半衰期最短.
取水稻植株不同处理在14 d的消解率作图,结果如图6.
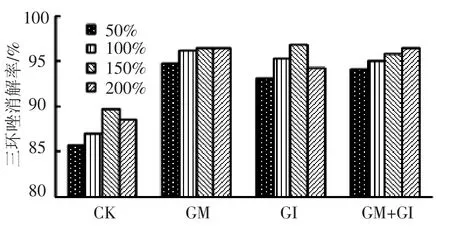
图6 施药14 d后不同处理水稻植株中三环唑消解率
GM的侵染率低于GM+GI,但在不同处理里GM的消解率均为最大,说明GM的促消解效果优于 GM+GI.
综上,水稻植株中3种菌剂处理对三环唑的消解效果由大到小为GM>GM+GI>GI,GM和GM+GI在150%施药情况下可以发挥最好效果.
3 讨论
3.1 菌剂侵染及菌根依赖性
AMF自然侵染率很低(3.34%),人工强化施加菌剂可极显著提高AMF对白三叶草的侵染作用(P<0.05),并可显著提高菌根依赖性指数(P<0.05).GM+GI对水稻的侵染效果(侵染率56.06%)最佳,侵染效果优于 GM(侵染率53.86%)和GI(侵染率34.57%).
3.2 AMF对土壤中三环唑残留的影响
施加菌剂的处理三环唑的消解速率均不同程度地大于CK,半衰期均低于CK,表明AMF的加入对土壤中三环唑的消解有明显的促进作用.
土壤中3种菌剂处理对三环唑的消解效果由大到小为GM+GI>GM>GI,4种不同质量分数下菌剂在150%施药情况下可以发挥最好效果,即在土壤中加入150%质量分数摩西和根内混合菌剂的情况下三环唑消解情况最好.
3.3 AMF对水稻植株中三环唑残留的影响
在水稻植株的不同处理中,施加菌剂的处理三环唑的消解速率均不同程度地大于CK,半衰期均低于CK,表明AMF的加入对水稻植株中三环唑的消解有明显的促进作用.
水稻植株中3种菌剂处理对三环唑的消解效果由大到小为GM>GM+GI>GI,GM和GM+GI在150%施药情况下可以发挥最好效果.
4 结论
1)人工施加菌剂可极显著地提高AMF对水稻的侵染效果.
2)AMF的加入促进了稻田土壤中三环唑的消解,效果由大到小为GM+GI>GM>GI.
3)AMF的加入促进了水稻植株中三环唑的消解,效果由大到小为GM>GM+GI>GI.
[1]刘宝存.农业面源污染综合防控技术研究与应用[M].北京,中国农业科学技术出版社,2011.
[2]JEFFRIES P S,GIANINAZZI S,PEROTTO S,et al.The contribution of arbuscular mycorrhizal fungi in sustainable maintenance of plant health and soil fertility[J].Biology and Fertility of Soils,2003,37:1 -16.
[3]王立,贾文奇,马放,等.菌根技术在环境修复领域中的应用及展望[J].生态环境学报,2010,19(2):487-493.
[4]方淑荣,刘正库.论农业面源污染及其防治对策[J].农业科技管理,2006,25(3):22 -23.
[5]宋家永,李英涛,宋宇,等.农业面源污染的研究进展[J].中国农学通报,2010,26(11):362 -365.
[6]胡心亮,夏品华,胡继伟,等.农业面源污染现状及防治对策[J].贵州农业科学,2011,39(6):211 -215.
[7]刘润进,焦惠,李岩,等.丛枝菌根真菌物种多样性研究进展[J].应用生态学报,2009,20(9):2301-2307.
[8]ARTURSSON V,JANSSON J K.Use of bromodeoxyuridine immunocapture to identify active bacteria associated with arbuscular mycorrhizal hyphae[J].Applied and Environmental Microbiology,2003,69(10):6208 -6215.
[9] SNDERSF E,TINKER P B.Phosrhato flow into mycorrhizal root[J].Pestic Sci,1973(4):385 - 395.
[10]王曙光,林先贵,施亚琴.丛枝菌根(AM)与植物抗逆性[J].生态学杂志,2001,20(3):27 -30.
[11]HELGASON T,MERRYWEATHERJ W,DENISON J,et al.Selectivity and functional diversity in arbuscular mycorrhizas of cooccurring fungi and plants from a temperate deciduous wood land[J].J Ecol,2002,90:371-384.
[12]许秀强,徐丽娟,殷元元,等.丛枝菌根真菌修复农药污染土壤的潜力分析[J].菌根学报,2009,28(4):616-621.
[13]GAO Yanzheng,CHENG Zhaoxia,LING Wanting,et al.Arbuscular mycorrhizal fungal hyphae contribute to the uptake of polycyclic aromatic hydrocarbons by plant roots[J].Bioresource Technology,2010,101:6895-6901.
[14]宋福强,丁明玲,董爱荣,等.丛枝菌根(AM)真菌对土壤中阿特拉津消解的影响[J].水土保持学报,2010,24(3):189 -193.
[15]李敬源,卢丽霞.高效液相色谱法测定三环唑原药[J].广州化工,2007,35(1):49 -51.
[16]PHILLIPS J M,HAYMEN D S.Imprived pricedures for clearing and staining parasitic and vesicular arbuscular mycorrhizal fungi for rapid.assessment of infection[J].Transactions of the British Mycological Society,1970,55:158-161.
[17]NEMEC S.Response of six citrus root-stocks to three species of Glomus,a mycorrhizal fungus[J].Proc Fla State Hort Sci,1978,9:1.
