银屑病患者皮损间充质干细胞对HaCaT细胞增殖的影响
2013-03-26刘瑞风杨元文张开明太原市中心医院皮肤科太原030009通讯作者mailzhangkaimingsinacom
刘瑞风,王 芳,杨元文,张开明(太原市中心医院皮肤科,太原 030009;通讯作者,E-mail:zhangkaiming@sina.com)
银屑病是一种以角质形成细胞过度增殖以及分化异常为特征的炎症性皮肤病。皮肤间充质干细胞(skin-derived mesenchymal stem cells,S-MSCs)为皮肤微环境的重要组成成分之一,它不但参与皮肤组织的发育和再生;而且可以通过分泌细胞因子对皮肤微环境产生重要影响[1]。表皮细胞异常增殖是银屑病的主要病理特点之一,研究银屑病患者皮损MSCs生物学特性可以确切地反映银屑病的实际发病状况,我们设想银屑病患者皮损MSCs对局部角质形成细胞(keratinocyte,KC)可能有影响,故我们在体外将银屑病患者皮损MSCs与人永生化角质形成细胞株HaCaT细胞共培养,观察前者对后者增殖的影响。现将结果报道如下。
1 材料和方法
1.1 研究对象与材料
1.1.1 研究对象 银屑病患者8例,均为太原市中心医院皮肤科临床及病理确诊为寻常性银屑病的门诊患者,就诊前3个月内局部及全身未使用过皮质类固醇激素、维甲酸类药物和免疫抑制剂。其中进行期4例,静止期4例,年龄14-56岁,平均(36.56±12.89)岁,病程10 d-20年。所有患者均依据银屑病皮损面积和严重程度指数(PASI)评分进行评估,PASI评分范围在1.6-18.0,平均11.64。对照组8例,取自我院泌尿外科和整形科手术切除皮肤,性别、年龄与患者组匹配,均无银屑病家族史,且入选禁用药条件同患者组。取材均经患者同意,并签署知情同意书。人永生化角质形成细胞株HaCaT细胞购自北京北纳创联生物技术研究院。本课题经太原市中心医院医学伦理委员会批准。
1.1.2 主要试剂与仪器 细胞培养瓶、24孔培养板及Transwell小室购自美国Corning公司,DMEM/F12培养基、胎牛血清购自美国Hyclone公司,Dispase酶Ⅱ、胰蛋白酶、重组人碱性成纤维细胞生长因子(bFGF)购自美国Sigma公司,B27添加剂购自美国Gibco公司,异硫氰酸荧光素(FITC)标记的鼠抗人 CD29,CD44,CD73,CD90,CD105,CD34,CD45 及HLA-DR单克隆抗体购自美国贝克曼库尔特公司,CountessTM自动细胞计数仪购自美国Invitrogen公司,iCELLigence实时无标记细胞功能分析仪购自美国艾森生物科学公司,IMT2型倒置相差显微镜购自日本OLYMPUS公司;EPICS-XL型流式细胞仪购自美国贝克曼库尔特公司。
1.2 方法
1.2.1 S-MSCs的分离、培养及鉴定 无菌条件下将标本制成1 mm3大小的组织块,0.25%Dispase酶Ⅱ37℃消化2-4 h,机械分离表、真皮,收集真皮部分,尽量切碎真皮组织,加入含有10%胎牛血清的DMEM/F12培养基,吸管反复吹打组织使细胞分离,通过孔径40 μm的筛网过滤,滤过液于冰上静置20-30 min,离心弃上清,加培养基重悬细胞。培养条件为:DMEM/F12培养基,加入5%胎牛血清、bFGF 10 ng/ml、B27 添加剂 10 μl/ml及青霉素 100 U/ml、链霉素 100 μg/ml,以 1 ×105个/cm2密度接种于T25塑料培养瓶内,置37℃,5%CO2饱和湿度培养箱中孵育。72 h后,全量换液弃去悬浮细胞,加入新配制的上述培养基,继续培养贴壁细胞,以后每3 d半量换液1次。倒置相差显微镜下观察细胞生长情况,细胞生长近90%融合状态时用0.25%的胰酶消化传代。细胞传至第5代,用胰酶消化,收获细胞,用PBS洗涤后计数,分别取2×105个细胞与FITC 标记的小鼠抗人 CD29,CD34,CD44,CD45,CD73,CD90,CD105和 HLA-DR单克隆抗体室温避光反应30min,用PBS洗涤后进行流式细胞术分析,对S-MSCs进行鉴定。
1.2.2 实时动态细胞分析技术法进行HaCaT细胞增殖检测 向E-Plate检测板中加入培养基并测定背景阻抗值。取对数生长期的HaCaT细胞,以3×104细胞/孔接种于E-Plate L8检测板(共3孔),将1例患者和1例对照来源的第5代S-MSCs分别以3×105细胞/孔接种于E-Plate Insert上室(各1孔,孔径0.4 μm),并设HaCaT细胞自然增殖孔(1孔,上室不加S-MSCs),室温超净台内放置30 min,将加入细胞的E-Plate检测板放入检测台上,于37℃,5%CO2、饱和湿度培养箱中培养,进行实时动态的细胞增殖检测,分析细胞增殖曲线,并确定观察增殖的最佳时间。
1.2.3 细胞计数法检测HaCaT细胞的数量 取对数生长期的HaCaT细胞,以1×105细胞/孔接种于24孔Transwell培养板(孔径0.4 μm)下室,将患者或对照来源(各8例)的第5代S-MSCs以1×106细胞/孔接种于上室,并设HaCaT细胞自然增殖孔(不含S-MSC)8孔(每份标本设两个复孔,最后取其平均值),于37℃,5%CO2、饱和湿度培养箱中培养,74 h(依据方法2确定的观察增殖最佳时间)后将上室连同S-MSCs取出,胰酶消化并收获下室HaCaT细胞,进行细胞计数。
1.2.4 统计学处理 使用SPSS 16.0统计软件分析,计量资料以±s表示。S-MSCs对HaCaT细胞增殖的影响采用方差分析,患者组和对照组HaCaT细胞数量比较采用SNK检验,P<0.05为差异有统计学意义。
2 结果
2.1 银屑病患者和正常对照S-MSCs的形态特点及流式鉴定结果
倒置相差显微镜下观察,银屑病患者组和对照组分离的S-MSCs形态相似。原代细胞接种72 h后,可见少量贴壁细胞,随着培养时间的延长,贴壁细胞逐渐增多,细胞明显增大并且分裂增殖,基本上为梭形成纤维细胞状形态,细胞互相重叠呈复层生长(图1A,B,见第917页)。患者组和对照组细胞原代培养时间相似,平均为(25.10±7.38)d,细胞达90%融合状态(图1C,见第917页)。传代细胞经0.25%胰蛋白酶消化后变形,呈圆形,经24 h后恢复原来形态,并贴壁增殖,形态和原代细胞相似,3-4 d后呈融合状态。
2.2 银屑病患者和对照S-MSCs的表型鉴定结果
两组细胞传5代后经流式细胞仪检测,结果均显示S-MSCs表面抗原高表达 CD29、CD44、CD73、CD90、CD105,而 CD34、CD45 及 HLA-DR 表达阴性(见图2)。说明分离、培养后获得的细胞符合SMSCs的特点。

图1 S-MSCs在倒置相差显微镜下的形态特点 (×200)Figure 1 Morphological characteristics of S-MSCs under an inverted phase-contrast microscope
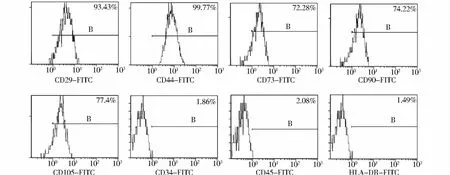
图2 S-MSCs的表型鉴定Figure 2 Phenotype identification of S-MSCs

图3 HaCaT细胞增殖曲线Figure 3 HaCaT cell proliferation curves
2.3 实时动态细胞分析技术法检测结果
与HaCaT细胞自然增殖相比,与S-MSCs共培养的HaCaT细胞增殖能力减弱,表明银屑病患者及对照S-MSCs均可抑制HaCaT细胞增殖(自然增殖HaCaT细胞 CIMax值为 4.95,患者组 HaCaT细胞CIMax值为 3.88,对照组 HaCaT细胞 CIMax值为3.11),但与对照S-MSCs相比,患者皮损MSCs的抑制能力较弱(图3,见第917页)。从图中还可得知,培养72-75 h后,三组细胞陆续达到最大增殖状态,因此,在72-75 h之间均可作为细胞增殖的观察点。
2.4 HaCaT细胞计数结果
银屑病患者及对照S-MSCs与HaCaT细胞共培养后细胞计数法检测结果显示,与自然增殖组相比,与S-MSCs共培养的HaCaT细胞的增殖能力显著降低,表明银屑病患者皮损及正常皮肤来源的MSCs对HaCaT细胞增殖均有抑制作用(P<0.05),但患者皮损MSCs的抑制能力减弱[患者组HaCaT细胞计数结果为(2.35±0.254)×105,对照组HaCaT细胞计数结果为(2.04±0.122)×105,P <0.05,见表1]。
表1 银屑病患者皮损和对照S-MSCs与HaCaT细胞共培养及HaCaT细胞自然增殖组细胞计数检测结果比较(±s)Table 1 HaCaT cell counts in natural proliferation group,co-cultured with patient S-MSCs group,and cocultured with control S-MSCs group(±s)

表1 银屑病患者皮损和对照S-MSCs与HaCaT细胞共培养及HaCaT细胞自然增殖组细胞计数检测结果比较(±s)Table 1 HaCaT cell counts in natural proliferation group,co-cultured with patient S-MSCs group,and cocultured with control S-MSCs group(±s)
与HaCaT细胞自然增殖组比较,*P<0.05;与对照SMSCs共培养组比较,#P<0.05
组别 n 细胞计数/×105 HaCaT细胞自然增殖组8 2.76±0.216与对照S-MSCs共培养组 8 2.04±0.122*与患者S-MSCs共培养组 8 2.35±0.254*#
3 讨论
角质形成细胞(KC)是人皮肤表皮的主要细胞,具有强烈的增殖和分化能力,是皮肤更新、屏障和免疫的主要功能性细胞之一。基底层细胞不断分裂、增生,并随着衰老向上推移,经过棘细胞层,达到颗粒层最外层最终演变成角质层细胞。在皮肤中,机体通过调节KC的增殖,调控表皮生长分化,保持表皮层的稳定。HaCaT细胞来源于成人表皮细胞,本研究结果显示,S-MSCs可抑制HaCaT细胞增殖,这一机制对于保持KC的自然生长平衡、维持表皮层的稳定起着非常重要的作用。
KC增殖、分化、凋亡(角质层形成)的过程,使细胞逐渐分化、成熟,逐渐走向死亡的过程,是受许多相互制约的调控机制精细控制的,当其中任何一环产生异常时,KC的分化进程就会受到影响,进而产生复杂的病理生理反应,从而导致一系列疾病的发生发展。KC分化异常在几种皮肤疾病,特别是银屑病的发病中起着重要作用[2]。银屑病的发病机制尚不明确,然而KC的过度增殖是该病重要的病理特征之一[3]。Wrone-Smith 等[4]发现银屑病中bcl-X1基因在增生的KC上呈强阳性表达,认为bcl-X1基因可能通过抑制表皮细胞凋亡,从而延长细胞的存活期,导致表皮增生。本研究结果显示,银屑病患者KC异常增殖与皮损MSCs密切相关,患者皮损MSCs抑制KC增殖的能力减弱,这可能是KC增殖异常的原因之一。对于皮损MSCs导致KC增殖异常的具体作用机制将是本研究之系列研究的重要内容。
本研究采用iCELLigence RTCA实时监测HaCaT细胞的细胞指数以反映细胞的生长情况,来研究S-MSCs对HaCaT细胞生长的影响。通过考察不同培养条件下HaCaT细胞的生长曲线,选择了74 h作为后期实验细胞增殖的观察点。RTCA技术对细胞的监测是实时、动态进行的,此方法可以与传统终点实验联合使用,以定义实验中的治疗或干预的终点时间,获得的信息可以帮助研究者了解目前的终点实验所无法得知的中间数据[5]。本研究结果证实了我们开始的设想,即银屑病患者皮损MSCs有异常,其对KC增殖的抑制能力减弱,这导致KC在皮损局部的异常增殖,促进了银屑病皮损的发生和发展。
深入研究KC增殖调控通路及调控因子对于银屑病的研究具有相当重要的理论和实际意义,也为该类疾病的治疗树立一座崭新的路标。本研究为银屑病的病因探讨提供了新的思路,并为寻找治疗银屑病的新的药物作用靶点和方法提供参考。
[1] Salvolini E,Orciani M,Vignini A,et al.Skin-derived mesenchymal stem cells(S-MSCs)induce endothelial cell activation by paracrine mechanisms[J].Exp Dermatol,2010,19(9):848-850.
[2] Nagpal S,Thacher SM,Patel S,et al.Negative regulation of two hyperproliferative keratinocyte differentiation markers by a retinoic acid receptor-specific retinoid:insight into the mechanism of retinoid action in psoriasis[J].Cell Growth Differ,1996,7(12):1783-1791.
[3] Mckee PH,Calonje E,Granter SR.皮肤病理学:与临床的联系[M].朱学骏,孙建方,译.3版.北京:北京大学医学出版社,2007:195-206.
[4] Wrone-Smith T,Johnson T,Nelson B,et al.Discordant expression of Bcl-x and Bcl-2 by keratinocytes in vitro and psoriatic keratinocytes in vivo[J].Am J Pathol,1995,146(5):1079-1088.
[5] Atienzar FA,Tilmant K,Gerets HH,et al.The use of real-time cell analyzer technology in drug discovery:defining optimal cell culture conditions and assay reproducibility with different adherent cellular models[J].J Biomol Screen,2011,16(6):575-587.
