NK4基因转染对人乳腺癌细胞MDA-MB-231生物学特性的影响
2013-03-26李松林刘新莉尹元琴中国医科大学附属第一医院肿瘤研究所二室沈阳000辽宁省肿瘤医院血液生物治疗科通讯作者mailyuandouwangyahoocomcn
李松林,李 霏,刘新莉,尹元琴(中国医科大学附属第一医院肿瘤研究所二室,沈阳 000;辽宁省肿瘤医院血液生物治疗科;通讯作者,E-mail:yuandouwang@yahoo.com.cn)
乳腺癌是妇女最常见的恶性肿瘤之一,目前在我国的发病率逐年增加,且有年轻化趋势。因此,研究乳腺癌的治疗新策略显得尤为重要。研究表明,肝细胞生长因子(hepatocyte growth factor,HGF)是由间质细胞产生的一种多功能细胞因子[1],通过结合其受体c-Met使其激活成p-Met,在肿瘤侵袭和转移中发挥着重要的作用[2]。NK4是一种新的肝细胞生长因子拮抗剂,它是由HGFα链的447个氨基酸和4个kringle结构所组成,故命名为NK4,相对分子量是50 kD[3]。NK4能够与c-Met受体结合,但并不激活c-Met受体,因此能够竞争性抑制HGF对c-Met受体的激活作用。研究证实NK4体外可以抑制HGF诱导的多种肿瘤细胞的生长、运动和侵袭[4-7]。但在乳腺癌中的作用,目前国内外少见报道。为此我们构建了NK4重组慢病毒载体[8],并进行转染研究,探讨NK4基因对HGF诱导MDA-MB-231的细胞生长、侵袭的影响。
1 材料与方法
1.1 细胞培养
乳腺癌细胞株MDA-MB-231培养在含10%胎牛血清的DMEM培养基中,置于37℃,5%CO2孵箱中。
1.2 细胞转染
将NK4病毒载体转染到231细胞中,最适感染复数(multiplicity of infection,MOI)为 10,载体转染时培养基中添加聚凝胺调整浓度至8 μg/ml,以正常培养和空白载体转染的细胞作为对照。
1.3 转染细胞NK4基因mRNA水平表达检测
取NK4转染组、空载体组和对照组细胞各5×106,常规提取总RNA,参照NK4基因序列设计引物,上游引物:5’-ATCAGGCAAGATTTGTCAGCG-3’;下游引物:5’GAGCAGTAGCCAACTCTCGGAT-3’。用上述两种引进行RT-PCR反应,阳性者可扩增出453 bp片段。β-actin作为内参照。
1.4 NK4蛋白和p-met蛋白表达的检测
采用Western blot法检测NK4蛋白和p-met蛋白表达。NK4转染组、空载体组和对照组的细胞孵育2 d,分别收集对数生长期的细胞培养液上清和细胞裂解液。聚丙烯酰胺凝胶电泳后,电转移到硝酸纤维膜上,5%牛奶封闭,加入兔抗人单克隆抗体4℃过夜,TBST洗3次,加入二抗,TBST冲洗3次后加入ECL发光液曝光。
1.5 细胞生长曲线测定
按照每孔5×103个细胞接种于96孔板,分为MDA-MB-231组和NK4转染组,每组设5个复孔,每组加入10 ng/ml的HGF。每孔加入MTT溶液10 μl,37 ℃ 培养,4 h 后加入 DMSO 150 μl震荡 10 min。在酶联免疫检测仪OD570nm读取吸光值。抑制率计算公式为:抑制率=1-(实验孔A值-空白孔A值)/(对照孔A值-空白孔A值)。
1.6 细胞侵袭能力测定
采用8 μm的Transwell chamber,对数生长期的MDA-MB-231细胞组,空载体组和NK4转染组,胰酶消化后,用含有10%胎牛血清的DMEM培养基调整成1×105的细胞悬液,上室每孔加入0.5 ml的细胞悬液(即每孔5×104个细胞),下室加入含有10 ng/ml HGF的培养基孵育48 h。取出滤膜,用棉签擦尽上室面Matrigel和未侵袭的细胞,10%中性甲醛固定30 min,常规HE染色,200倍光镜下随机选取5个视野,计数滤膜下室面的细胞数,以平均数作为侵袭指数。
1.7 统计学分析
采用SPSS13.0软件对数据进行 t检验和方差分析及两样本比较的LSD检验。数据以±s表示,以P<0.05为差异有统计学意义。
2 结果
2.1 转染细胞NK4 mRNA基因的表达
对NK4转染组、空载体组和对照组样品进行RT-PCR反应,均可扩增出长度为1 434 bp的特异性条带,而空载体组和对照组则没有特异性条带。说明NK4转染乳腺癌后能够正常转录(见图1)。

图1 三组细胞中NK4基因的表达Fig 1 Identification of NK4 gene
2.2 转染细胞NK4蛋白和p-met蛋白的表达
取NK4转染组、空载体组和对照组细胞培养液上清液进行Western blot实验,结果显示:NK4转染组能够表达NK4蛋白,而对照组和空载体组中无NK4表达,且与对照组和空载体组相比转染组中pmet蛋白的表达明显减弱(见图2)。

图2 各组细胞中NK4及p-met的表达Fig 2 Expression of NK4 and p-met in three groups
2.3 细胞生长曲线测定
结果显示NK4转染组与对照组和空载体组相比能够明显抑制由HGF诱导的细胞生长(P<0.01,见图3)。
2.4 细胞侵袭能力测定
Transwell小室法观察转染NK4基因对乳腺癌细胞侵袭的影响,结果显示,转染NK4能够显著抑制HGF诱导的乳腺癌细胞的侵袭(P<0.01,图4,5,见第248页)。
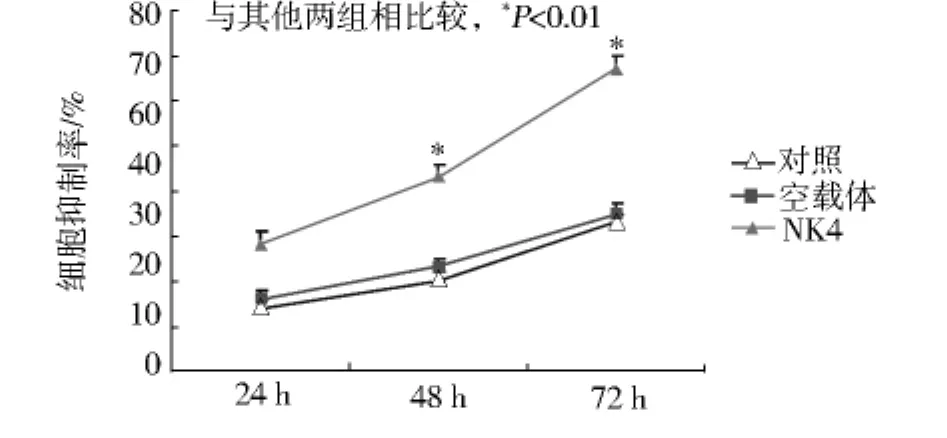
图3 转染NK4对MDA-MB-231细胞的抑制作用Fig 3 The cell inhibition of NK4 on MDA-MB-231

图4 Transwell小室法观察转染NK4基因对乳腺癌细胞侵袭的影响 (×100)Fig 4 Effect of NK4 transfection on MDA-MB-231 invasion by Transwell assay (×100)

图5 对照组、空载体组及转染NK4组48 h后MDA-MB-231侵袭情况对比Fig 5 The inhibition on MDA-MB-231 invasion of null,vector and p-Lenti-NK4 at 48 h
3 讨论
乳腺癌已经成为女性最常见的恶性肿瘤之一,占女性所罹患的全部恶性肿瘤的23%[9],在美国乳腺癌已经成为女性恶性肿瘤第一位[10]。因此研究乳腺癌细胞的侵袭和转移的机制,探索有效地抑制乳腺癌的生长、侵袭和转移的方法显得至关重要。
HGF是由间质细胞产生的一种多功能细胞因子。最初引起对肝细胞具有很强的丝裂原作用而命名[1]。HGF具有诱导细胞有丝分裂、刺激细胞迁移、对抗细胞因子诱导凋亡的作用。通过包括癌细胞在内的多种细胞膜上的特异性受体c-Met发挥生物学作用[2]。HGF/c-Met可以激活蛋白激酶结构域中的PTK,导致丝裂原活化蛋白激酶(MAPK)发生磷酸化上调u-PA(内皮细胞尿激酶-纤溶酶原激活系统),引起一系列的生物反应,诱导基质金属蛋白酶的表达,促进细胞外基质的降解,最终导致肿瘤的侵袭和转移[11]。最近,有研究证实乳腺癌中HGF和c-Met的表达与正常组织相比明显升高,且HGF的水平与乳腺癌的肿瘤大小、临床分期、淋巴结状况及组织学分级有明显关系[12-14]。因此,如果能够抑制HGF与其受体c-Met的结合将对乳腺癌的治疗起到重要作用。NK4是HGF最具代表性的全面的拮抗剂,它具有拮抗HGF和抑制血管生成的双重作用。本实验通过对乳腺癌细胞MDA-MB-231转染NK4重组慢病毒载体,发现转染NK4基因的细胞组能够向培养基中大量分泌NK4蛋白,体外实验结果显示NK4能够竞争性抑制HGF与乳腺癌细胞上cmet受体的结合,抑制了c-Met受体的磷酸化。从而阻断了HGF/c-met信号通路对乳腺癌细胞促肿瘤作用,NK4基因的转染能够明显地抑制乳腺癌细胞的生长和侵袭,为进一步的体内实验和乳腺癌的临床治疗提供了研究基础。
[1] Cooper CS,Park M,Blair DG,et al.Molecular cloning of a new transforming gene from a chemically transformed human cell line[J].Nature,1984,311(5981):29-33.
[2] Zeng Q,Chen S,You Z,et al.Hepatocyte growth factor inhibits anoikis in head and neck squamous cell cancinoma cells by activation of ERK and Akt signaling independent of NK-kappaB[J].J Biol Chem,2002,277(28):25203-25208.
[3] Date K,Matsumoto K,Shimura H,et al.HGF/NK4 is a specific antagonist for pleiotrophic actions of hepatocyte growth factor[J].FEBS Lett,1997,420(1):1-6.
[4] Kuba K,Matsumoto K,Date K,et al.HGF/NK4,a four-kringle antagonist of hepatocyte growth factor,is an angiogenesis inhibitor that suppress tumor growth and metastasis in mice [J].Cancer Res,2000,60(23):6737-6743.
[5] Date K,Matsumoto K,Kuba K,et al.Inhibition of tumor growth and invasion by a four-kringle antagonist(HGF/NK4)for hepatocyte growth factor.[J].Oncogene,1998,17(23):3045-3054.
[6] Hiscox S,Parr C,Nakamura K,et al.Inhibition of HGF/SF-induced breast cancer cell motility and invasion by the HGF/SF variant NK4 [J].Breast Cancer Res Treat,2000,59(3):245-254.
[7] Yue D,Wang Y,Ma P,et al.Effects of transferred NK4 gene on proliferation,migration,invasion and apoptosis of human prostate cancer DU145 cells[J].Asian J Androl,2010,12(3):381-389.
[8] 李霏,李松林,尹元琴.NK4基因重组慢病毒载体的构建及在肝癌细胞中的表达.[J].中国医科大学学报,2011,40(12):1081-1084.
[9] Parkin DM,Bray F,Ferlay J,et al.Global cancer statistics.[J].CA Cancer J Clin,2005,55(2):74-108.
[10] Jemal A,Sieqel R,Ward E,et al.Cancer statistics,2006[J].CA Cancer J Clin,2006,56(2):106-130.
[11] Abounader R,Ranganathan S,Lal B,et al.Reversion of human glioblastoma malignancy by U1 small nuclear RNA/ribozyme targeting of scatter factor/HGF and c-met expression [J].J Natl Cancer Inst,1999,91(18):1548-1556.
[12] Sheen-Chen SM,Liu YW,Eng HL,et al.Serum levels of hepatocyte growth factor in patients with breast cancer[J].Cancer Epidemiol Biomarkers Prev,2005,14(3):715-717.
[13] 王承正,许重杰,毛书明,等.血清肝细胞生长因子水平与乳腺癌临床病理特征的关系[J].新乡医学院学报,2009,26(4):388-390.
[14] 王玉萍,楚天骄,党秋红,等.乳腺癌中肝细胞生长因子及其受体C-Met和血管内皮生长因子表达的意义[J].实用诊断与治疗杂志,2006,20(5):336-338.
