曲古霉素A对SGC7901/ADR细胞系耐药逆转机制的研究
2013-03-26孙红坤杨晓丹西安交通大学医院内科西安7006西安交通大学医学院第一附属医院消化内科通讯作者mailqiaowen0com
王 丹,孙红坤,唐 青,杨晓丹,乔 文(西安交通大学医院内科,西安 7006;西安交通大学医学院第一附属医院消化内科;通讯作者,E-mail:qiaowen0@6.com)
肿瘤的多药耐药(MDR)是指肿瘤细胞对多种化学结构和作用机制均不相同的化疗药物产生的耐药性,可分为先天性耐药(intrinsic MDR)及获得性耐药(acquired MDR)[1]。目前有关耐药的机制研究比较多的有:转运泵样作用、细胞内特定酶系统的激活,例如谷胱甘肽-S-转移酶(GST)[2]、还有凋亡机制的紊乱,例如Bcl-2家族成员及CD95等[3]。TSA是一种链霉素的代谢产物,具有组蛋白脱乙酰基抑制剂活性[4,5],可以通过影响细胞中核小体组蛋白的乙酰化水平来调节某些转录因子的水平,进而通过调节相关基因的转录与表达来实现抑制肿瘤细胞生长、逆转肿瘤细胞耐药的作用。TSA可抑制多种肿瘤细胞的生长并逆转其耐药[6-9],但是对胃癌耐药细胞是否具有逆转作用尚不明确,本研究旨在观察TSA对胃癌耐药细胞SGC7901/ADR是否具有逆转作用,并对其作用机制进行探讨。
1 材料和方法
1.1 主要试剂和药物
TSA为 Fermentek公司产品,用二甲基亚砜(dimethyl sulfoxide,DMSO)溶解后储存浓度为50 μmol/L,ADR为浙江海正公司产品,用生理盐水溶解后储存浓度为460 μmol/L,试验时倍比稀释至所需浓度,PCR引物由北京奥科生物技术有限责任公司合成。
1.2 细胞株及培养条件
胃癌细胞株SGC7901和胃癌耐药细胞SGC7901/ADR均由第四军医大学消化内科实验室提供,在含10%小牛血清、双抗(青、链霉素各100 U/100 ml)的DMEM培养液中培养,在37℃,5%CO2湿度适宜条件下生长传代,实验时取对数生长期的细胞。
1.3 MTT法检测TSA对胃癌耐药细胞SGC7901/ADR的影响
选择对数生长期的SGC7901和SGC7901/ADR细胞,调整细胞浓度为5×104个/ml,分别种植于96孔板内,每孔100 μl,在细胞培养箱培养24 h后,SGC7901 细胞中分别加入 0.23,0.45,0.90,1.80,3.60,7.19,14.38,28.75 μmol/L 的 ADR,SGC7901/ADR 细胞中分别加入 0.90,1.80,3.60,7.19,14.38,28.75,57.50,115 μmol/L的ADR,阴性对照组用培养基补足体积,空白对照组为DMEM培养液,各设6个复孔,继续孵育72 h,加入新鲜配制的 MTT,每孔20 μl,继续孵育4 h后,用加样枪吸掉上清液,每孔加入150 μl DMSO,振荡器震荡10 min,用酶标仪测得每孔的光密度值(OD值),检测波长为490 nm。根据三次试验的平均值计算得出存活率及抑制率,用SPSS1 3.0分别得到ADR对SGC7901和SGC7901/ADR的IC50。同样的细胞处理方法,分别加入 12.5,25,50,100,200,300,400,500 nmol/L的 TSA 干预 SGC7901/ADR 细胞,得出TSA对SGC7901/ADR的IC5(95%细胞存活的药物浓度即无毒剂量)和IC15(85%细胞存活的药物浓度即低毒剂量)。最后加入1.5 nmol/L的TSA 和0.45,0.90,1.80,3.60,7.19,14.38,28.75,57.50 μmol/L的ADR干预SGC7901/ADR细胞,得出IC50,通过以下计算公式得出耐药倍数,逆转倍数及逆转比率:
抑制率(%)=(1-实验组光密度值/对照组光密度值)×100%
耐药倍数=耐药株IC50/敏感株IC50
逆转倍数=耐药株IC50/逆转株IC50
逆转比率=(1-ADR对逆转株IC50/ADR对耐药株IC50)×100%
1.4 流式细胞仪检测TSA对SGC7901/ADR细胞内ADR浓度的影响6
将5×10个/ml的细胞悬液吹打均匀后,接种于6孔细胞培养板内,待细胞贴壁后,分别加入1.5 nmol/L、12 nmol/L的TSA,空白组用培养基补足体积,分别作用48 h和72 h后,用0.25%的胰酶消化后制成单细胞悬液,800 r/min离心5 min,弃上清,用冷PBS溶液洗涤细胞,800 r/min离心5 min,弃上清,再重复一次,用 PBS溶液重悬后上机检测。ADR在细胞内可发出荧光,其荧光强度与浓度成正比[10],用流式细胞仪的免疫荧光计数进行检测,设定激发波长为488 nm,接受波长为575 nm。
1.5 RT-PCR法检测TSA对SGC7901/ADR细胞内MDR1表达的影响
细胞培养及处理同前,分别加入1.5 nmol/L和12 nmol/L的TSA,空白组用培养基补足体积,作用48 h、72 h后,TRIzol法抽提细胞总RNA,逆转录为cDNA,在PCR扩增仪上进行 DNA扩增,取5 μl反应产物加入2%琼脂糖凝胶中70 V电泳30 min,用灰度分析仪直接分析各条电泳条带的灰度值,反应中的引物序列见表1。
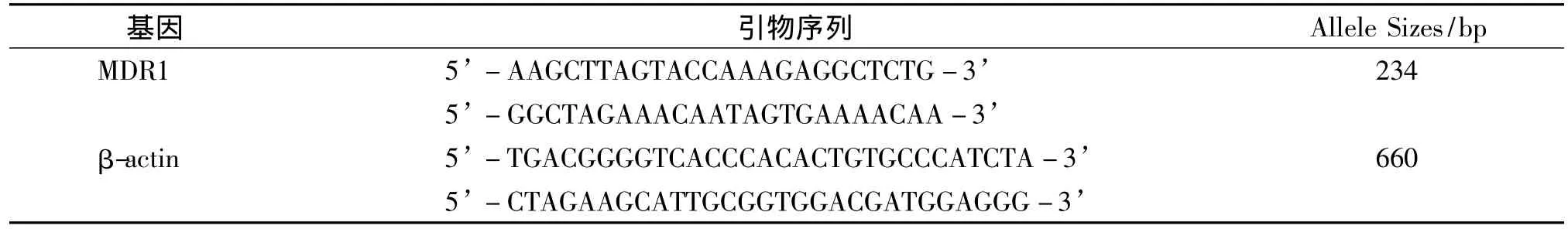
表1 MDR1及内参引物序列Tab 1 MDR1 and β-actin primer sequences
1.6 统计学处理
2 结果
2.1 MTT法检测TSA对胃癌耐药细胞SGC7901/ADR的影响
胃癌耐药细胞SGC7901/ADR相对于SGC7901的耐药倍数约为29.51倍。TSA作用于耐药细胞SGC7901/ADR的IC5=(1.52±0.118)nmol/L、IC15=(12.35±0.399)nmol/L。1.5 nmol/L的TSA作用于SGC7901/ADR后可使其耐药性明显降低,逆转倍数约为1.95倍,逆转比率约为48.70%,TSA作用前后耐药细胞的抑制率见表2,可以明显看到TSA作用后相同浓度下阿霉素对SGC7901/ADR细胞的抑制率明显升高。
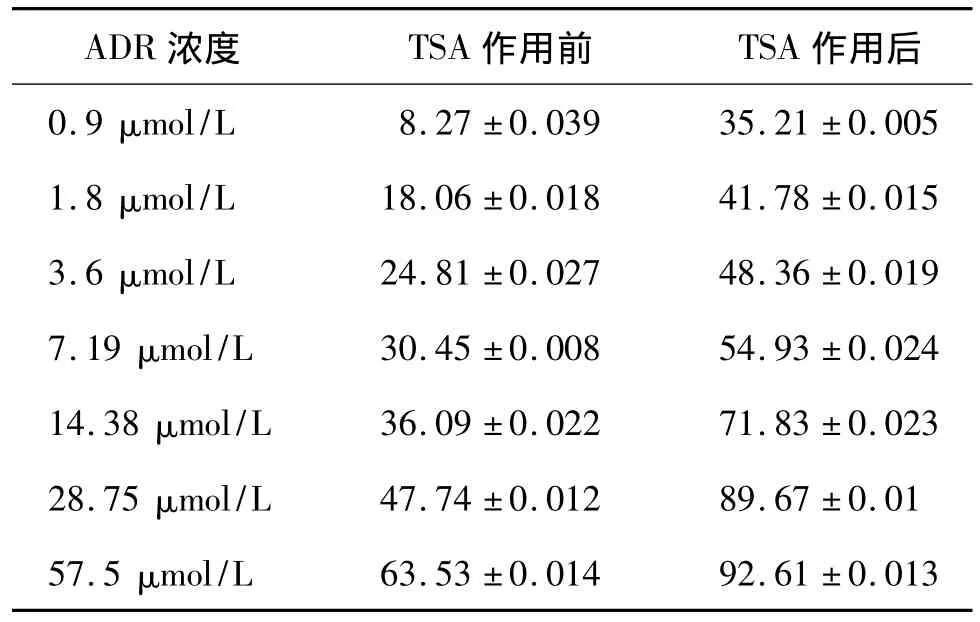
表2 TSA作用前后SGC7901/ADR细胞的抑制率Tab 2 The inhibition rate of SGC-7901/ADR cells after giving TSA
2.2 TSA对SGC7901/ADR细胞内ADR浓度的影响
TSA作用后耐药细胞内ADR荧光强度明显增加,且随着作用时间延长和TSA剂量增加,耐药细胞内ADR荧光强度逐渐增加(见表3)。

表3 TSA作用后ADR的荧光强度变化Tab 3 The changes of ADR fluorescence intensity after giving TSA
2.3 TSA对SGC7901/ADR细胞内MDR1表达的影响
RT-PCR法检测各组细胞内MDR1基因的mRNA表达结果见图1。用灰度分析仪对各组条带进行灰度分析,结果见表4。可见随着TSA作用时间延长和作用剂量增加MDR1表达显著降低。
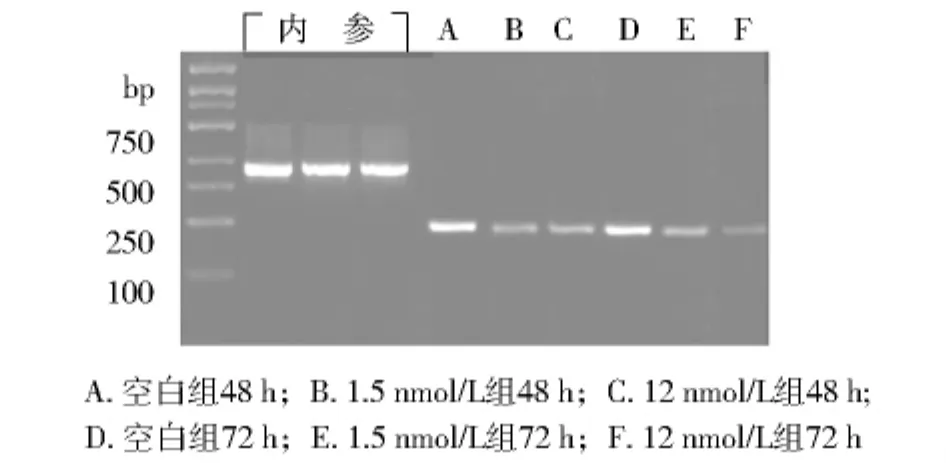
图1 TSA作用后MDR1的变化Fig 1 The change of MDR1 expression after giving TSA
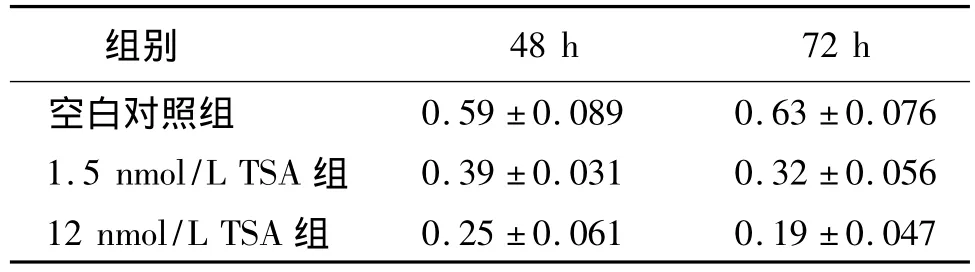
表4 TSA作用后各组间MDR1 mRNA表达灰度值Tab 4 The changes of gray value of MDR1 mRNA expression after giving TSA
3 讨论
本研究通过MTT证实人胃腺癌耐药细胞SGC7901/ADR相对于SGC7901的耐药倍数约为29.51倍,在加入1.5 nmol/L的TSA后可使阿霉素对耐药株的作用明显加强,其逆转耐药倍数约为1.95倍,证实了TSA对胃癌耐药细胞具有逆转作用。
进一步通过RT-PCR法证实TSA作用后可使耐药细胞内MDR1基因表达降低,且随着TSA作用时间延长和作用剂量的增加MDR1表达明显下降。MDR1基因编码的正是P-糖蛋白(P-gp)[11]。P-gp是ABC(ATP-binding cassette)膜转运家族成员之一[12,13],是一种位于细胞膜上的转运蛋白,可通过水解ATP供能,逆浓度梯度将抗肿瘤药物泵出细胞外来实现耐药[14-16]。MDR1基因表达降低,其表达产物细胞膜上的P-糖蛋白也随之明显下降,对细胞内阿霉素泵出作用明显减弱,使细胞内阿霉素浓度明显升高,增强阿霉素对肿瘤耐药细胞的作用,从而实现其逆转耐药作用。本实验通过流式细胞仪检测发现TSA作用后耐药细胞内的阿霉素荧光强度明显增加,且随TSA作用时间延长和作用浓度增加呈正比,证实了TSA逆转耐药是通过增加细胞内阿霉素浓度来实现的。
但是TSA是如何下调MDR1基因的尚不明确。细胞中有乙酰化酶和去乙酰化酶,可通过改变染色质中核小体组蛋白的乙酰化水平来调节相关基因的转录和表达,进而改变细胞的生长进程,正常情况下乙酰化酶和去乙酰化酶处于平衡状态。TSA具有去乙酰化酶抑制剂活性,因此推测,TSA通过抑制去乙酰化酶活性,改变细胞内染色质中核小体组蛋白的乙酰化水平,进而降低MDR1的表达,逆转肿瘤细胞的耐药。
[1] WANG Jiemin,LI Sanren.Progress in the clinical research of gastric cancer[J].Chin J Gastroenterol Hepatol,2012,21(1):3-5.
[2] Shi H,LU D,SHU Y,et al.Expression of multidrug resistance-related proteins P-glycoprotein,glutathione-S-transferases,topoisomerase-Ⅱand lung resistance protein in primary gastric cardiac adenocarcinoma[J].Hepato-Gastroenterology,2008,28(4B):2087-2092.
[3] 董改霞,洪行球,黄燕芬.基因逆转肿瘤多药耐药的研究进展[J].现代生物医学进展,2008,8(12):48-51.
[4] Kim H,Kim SN,Park YS,et al.HDAC inhibitors downregulate MRP2 expression in multidrug ressistant cancer cells:implication for chemosensitization[J].Int J Oncol,2011,38(3):807-812.
[5] Tamannai M,Farhangi S,Truss M,et al.The inhibitor of growth 1(ING1)is involved in trichostation A-induced apoptosis and caspase 3 signaling in P53-deficient glioblastoma cells[J].Oncol Res,2010,18(10):469-480.
[6] TIAN Yingxia,WANG Diegui,ZHANG Xiangbo.Research of trichostatin A in treating bladder cancer[J].J Int Oncol,2010,37(1):76-78.
[7] 姚宏伟,孙浩,何鸿保.曲古霉素A对人肾细胞癌Caki-1细胞体外生长的影响[J].江苏大学学报:医学版,2011,21(1):46-49.
[8] 顾红军,武宁,胡海洋.曲古霉素 A对肺腺癌细胞株 NCIH1299增殖的抑制作用及其机制[J].中国癌症杂志,2009,19(10):779-783.
[9] 孙圣坤,刘兵,李秀森.曲古抑菌素A对前列腺癌细胞LNCaP细胞抑制效应的信号通路研究[J].中国临床药理学,2006,11(9):1013-1016.
[10] Eid H,Mingfang L,Institoris E,et al.Mnp expression of testicular cancers and its clinical relevance[J].Anticancer Res,2000,20(50):4019-4022.
[11] Mizutani T,Masuda M,Nakai E,et al.Genuine functions of P-Glycoprotein(ABCB1)[J].Curr Drug Metab,2008,9(2):1220-1221.
[12] Shitan N,Tanaka M,Terai K,et al.Human MDR1 and MRP1 recognize berberine as their transpoter substrate[J].Biosci Biotechnol Biochem,2007,71(1):242-245.
[13] MA Yunfang,PEI Desheng,LIANG Guolu.Research advances in P-glycoprotein[J].Prog Modern Biomed,2008,8(8):1584-1587.
[14] Lee W,choi HI,Kim MJ,et al.Depletion of mitochondrial DNA up-regulations the expression of MDR1 gene via an increase in mRNA stability[J].Exp Mol Med,2008,40(1):109-117.
[15] 蔡青,欧阳琦,黄钱焕.维拉帕米对胶质瘤细胞卡氮芥化疗敏感性的作用[J].安徽医药,2010,14(6):643-645.
[16] Buds G,Orciuolo E,Maggini V,et al.MDRI modulates apoptosis in CD34+leukemic cells[J].Ann Hemmol,2008,87(12):1017-1018.
