巯基化MCM-41对水中Hg(Ⅱ)的吸附
2013-03-23秦庆东陈志真傅大放
秦庆东 陈志真 傅大放 马 军
(1东南大学土木工程学院,南京 210096)(2中国市政工程中南设计研究总院有限公司,武汉 430010)(3哈尔滨工业大学市政环境工程学院,哈尔滨 150090)
汞由于具有生物累积性对环境和人体健康危害极大,一直是水处理重点控制的污染物之一.目前,对于水体中的汞污染常用的处理方法有化学沉淀法、离子交换法、混凝法、反渗透法、吸附法、微生物浓集法等.其中,吸附法由于具有工艺简单、操作方便等优点被广泛地研究和应用,并已逐渐成为控制汞污染的有效方法之一[1-3].而吸附法的核心是选择和制备具有优良除汞性能的吸附材料.
介孔材料由于具有比表面积高、孔道规则、孔径分布均匀可调、易于引入功能化基团等特点已被广泛应用于择形催化、选择性吸附分离等领域.近年来,在介孔材料上(如MCM-41,HMS和SBA-15等)嫁接有机官能团,以去除水中的重金属已成为当前研究的热点[4-7].实验表明改性后的介孔材料对水中重金属具有很高的吸附容量.其中,将对汞具有较强亲和力的巯丙基嫁接在MCM-41上以提高其对水中汞的去除率,被认为是修复汞污染最有前途的技术之一.然而,对巯基化MCM-41吸附汞的性能还缺乏系统的研究.因此,本文采用3-巯丙基三甲氧基硅烷改性MCM-41来吸附水中的汞,并考察接触时间、初始浓度、温度、pH值和氯离子等因素对巯基化MCM-41吸附汞的影响,探讨巯基化MCM-41吸附汞的机理,最后通过脱附实验确定巯基化MCM-41与汞的结合能力.
1 实验
1.1 试剂及主要仪器
实验采用的试剂有:氯化汞(分析纯);正硅酸乙酯(TEOS,分析纯);溴化十六烷基三甲基铵(CTAB,分析纯);3-巯丙基三甲氧基硅烷(MPTS,>95%);乙二胺四乙酸二钠(EDTA,分析纯);罗丹明6G(>95%);明胶(化学纯);碘化钾(分析纯);盐酸(分析纯);氢氧化钠(分析纯);甲苯(分析纯);甲醇(分析纯);正己烷(分析纯).实验仪器主要有SHZ-88水浴恒温水浴摇床(金坛医疗仪器厂)和 UV/VIS 分光光度计(美国UNIC公司).
1.2 巯基化MCM-41的制备
MCM-41的制备方法如下[8]:① 将CTAB溶于含有NaOH的超纯水中,在室温下磁力搅拌2 h,直至溶液澄清.② 向溶液中缓慢加入TEOS,同时搅拌约2 h,得到乳白色溶液(整个溶液反应物的摩尔比为rCTAB∶rTEOS∶rNaOH∶rH2O=0.12∶1∶0.24∶66.7.③ 将乳白色溶液移到聚四氟乙烯反应釜中,373 K下晶化48 h,冷却后,经洗涤、过滤、353 K下干燥24 h,得到白色MCM-41半成品,将该半成品放入以1 K/min速度升温的马弗炉中,在813 K温度下煅烧5 h,得到样品MCM-41.
巯基化MCM-41的制备方法如下[9]:称取5 g的MCM-41加入到含有6 mL MPTS的100 mL甲苯溶液中,在温度为388 K和N2保护下回流24 h,反应完成后待溶液冷却至室温,离心后的固体在索式提取器中用甲苯、甲醇和正己烷洗涤,然后在温度为353 K下真空干燥8 h,得到的白色固体记作SH-MCM-41.
1.3 样品表征
样品晶相分析采用Philips PW1710型X射线衍射仪进行测定,Cu靶,Kα辐射源,管电压40 kV,管电流30 mA,扫描步长0.02°,扫描速度1.2(°)/min,扫描范围2θ为1.0°~10°.样品的SEM采用日本日立公司生产的S-4700型扫描电子显微镜进行表征.样品的TEM采用H-8100透射电子显微镜进行表征,电子加速电压为200 kV.样品的BET比表面积采用ASAP2020比表面分析仪进行分析.采用2400LS Ⅱ型元素分析仪测定样品中的碳、氢、氮和硫.
1.4 吸附实验
1.4.1 吸附动力学
准确称量10 mg SH-MCM-41于250 mL的三角瓶中,加入已知浓度Hg(Ⅱ)溶液100 mL(pH 5.5),在298 K下,采用磁力搅拌器进行搅拌,每隔一段时间取样,样品经过0.45 μm的滤膜过滤,测定滤液中剩余Hg(Ⅱ)的浓度.
1.4.2 吸附等温线
准确称量2 mg SH-MCM-41于50 mL的具塞锥形瓶中,加入20 mL系列初始浓度(20~80 mg/L)的Hg(Ⅱ)溶液(pH 5.5),恒温水浴振荡(150 r/min) 2 h后,样品经过0.45 μm的滤膜过滤,测定滤液中剩余Hg(Ⅱ)的浓度,并由下式计算平衡吸附量:
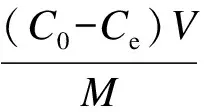
(1)
式中,qe为平衡吸附量;C0为初始Hg(Ⅱ)浓度;Ce为吸附平衡后剩余Hg(Ⅱ)浓度;V为溶液体积;M为吸附质投量.另外,通过考察MCM-41对Hg(Ⅱ)的吸附发现,Hg(Ⅱ)在MCM-41上的吸附可忽略不计.
1.4.3 pH和氯离子影响
在每个锥形瓶中加入20 mL溶度为50 mg/L的Hg(Ⅱ)溶液,采用HCl和NaOH调节pH值至2~7,然后加入2 mg的SH-MCM-41,将上述锥形瓶室温下振荡2 h后,用0.45 μm的滤膜过滤,测定滤液pH值和剩余Hg(Ⅱ)的浓度.
在每个锥形瓶中加入20 mL溶度为50 mg/L的Hg(Ⅱ)溶液(pH 5.5),用NaCl调节氯离子浓度至0.01~1 mol/L,然后加入2 mg的SH-MCM-41,将上述锥形瓶室温下振荡2 h 后,用0.45 μm 的滤膜过滤,测定滤液中剩余Hg(Ⅱ)的浓度.
1.5 脱附实验
称取2 mg SH-MCM-41于50 mL锥形瓶中,加入20 mL浓度为 50 mg/L的Hg(Ⅱ)溶液(pH 5.5),吸附达到平衡后,用离心的方法进行固液分离,测定上清液中剩余Hg(Ⅱ)的浓度.然后移取上清液,将固体置入50 mL的锥形瓶中,加入20 mL的脱附剂,脱附剂分别为12 mol/L HCl和0.05 mol/L EDTA溶液,在温度为298 K下于水浴恒温振荡器中恒温振荡24 h,使脱附达到平衡,用0.45 μm 的滤膜过滤,测定滤液中剩余Hg(Ⅱ)的浓度,计算脱附率.
1.6 分析方法
采用分光光度法测定[10]Hg(Ⅱ),其原理为:在Hg(Ⅱ)存在条件下,罗丹明6G和KI能反应形成粉红色的中间产物,该反应在pH值为1~7的条件下能迅速进行,生成物可以在明胶溶液中稳定24 h,其最大吸附波长为575 nm.但该方法只适用于含量为5~25 μg范围内Hg(Ⅱ)浓度的分析与测定.
2 结果与讨论
2.1 SH-MCM-41的表征
MCM-41和SH-MCM-41的XRD图谱如图1所示,从图中可以看出,MCM-41在2θ为1.80°,3.38°和3.96°有较强的衍射峰,分别对应于(100),(110)和(200)晶面,这与文献[11]报道的具有六方对称特征的典型介孔材料MCM-41的特征衍射峰相符,表明所合成的MCM-41具有长程有序的六方形介孔结构,并且结晶度较好.SH-MCM-41在2θ为1.84°有较强的衍射峰,在3.44°和3.99°有较弱的衍射峰,说明巯基化后的MCM-41保持原有的结构特征.与MCM-41的XRD图谱相比,(100)晶面的特征吸收峰强度有所下降,(110)和(200)晶面的衍射峰大大减弱,说明嫁接巯基后MCM-41的有序度有所下降.这可能是巯基的引入对介孔材料MCM-41结构产生一定影响,即孔道内由于嫁接有机物后,孔道尺寸减小,晶格缺陷增多,最终使衍射峰强度降低.

图1 MCM-41和SH-MCM-41的XRD图谱
图2为SH-MCM-41的SEM和TEM图.从SEM图中可以看出,SH-MCM-41表面较粗糙,颗粒形貌不规则,颗粒大小分布不均匀,最大颗粒直径可达5 μm.从TEM图中可以看出,SH-MCM-41具有良好的六方形介孔结构,孔径分布均匀,孔径大小在2.5~3.5 nm之间.

图2 SH-MCM-41的SEM和TEM
另外,通过比表面分析仪分析,MCM-41和SH-MCM-41的比表面积分别为942和815 m2/g,孔容分别为0.88和0.34 cm3/g,平均孔径分别为2.91和2.48 nm.说明改性后MCM-41的比表面积、孔容和孔径均减小.经元素分析仪得到MCM-41和SH-MCM-41中的硫含量分别为0 和4.04%.说明巯基已经成功嫁接到MCM-41表面上.
2.2 SH-MCM-41对 Hg(Ⅱ)的吸附性能
2.2.1 接触时间对SH-MCM-41吸附Hg(Ⅱ)的影响
接触时间对SH-MCM-41吸附Hg(Ⅱ)的影响如图3所示.从图中可以看出,在60 min内,SH-MCM-41对Hg(Ⅱ)的吸附量随着时间的增加而增加.在接触时间大于60 min后,吸附达到平衡,平衡时间与Hg(Ⅱ)初始浓度无关,并且平衡吸附量随着初始浓度的增加而增加.当Hg(Ⅱ)初始浓度分别为70和35 mg/L时,SH-MCM-41对Hg(Ⅱ)的最大平衡吸附量分别为217和197 mg/g,去除率分别为29.4%和53.5%.这种较快的吸附速率主要是由于SH-MCM-41所具有的有序介孔结构,该结构使得Hg(Ⅱ)在吸附过程中有较快的传质速度,从而加快了吸附速率.另外,平滑而连续的动力学曲线表明Hg(Ⅱ)在SH-MCM-41上是单层吸附.

图3 接触时间对SH-MCM-41吸附Hg(Ⅱ)的影响
吸附动力学有多种描述模型,其中有假一级动力学、假二级动力学和扩散模型等.本实验中,SH-MCM-41对Hg(Ⅱ)的吸附动力学可以用假二级动力学模型来描述,即

(2)
式中,qt为时间t时的吸附量;k2为假二级吸附速率常数.动力学参数通过t/qt对t作图得出,计算得出的动力学参数如表1所示.从表中可以看出,假二级动力学模型可以较好地拟合SH-MCM-41对Hg(Ⅱ)的吸附动力学(R2>0.99).当Hg(Ⅱ)的初始浓度从35 mg/L增加到70 mg/L时,k2从3.26×10-4g/(mg·min)增加到6.16×10-4g/(mg·min).这是由于增加初始浓度可以增加Hg(Ⅱ)向SH-MCM-41表面和内孔扩散的动力,从而导致SH-MCM-41吸附速率的增加.

表1 SH-MCM-41吸附Hg(Ⅱ)的动力学参数
2.2.2 SH-MCM-41吸附Hg(Ⅱ)的等温线
在不同温度下,SH-MCM-41吸附Hg(Ⅱ)的等温线如图4所示.从图中可以看出,随着温度从298 K升高到308 K,最大吸附量从219 mg/g升高到258 mg/g,说明该吸附是吸热过程,温度升高有利于Hg(Ⅱ)的吸附.另外,SH-MCM-41吸附Hg(Ⅱ)的等温线符合典型的Langmuir吸附模型,因此可以用Langmuir模型来描述吸附等温线,即
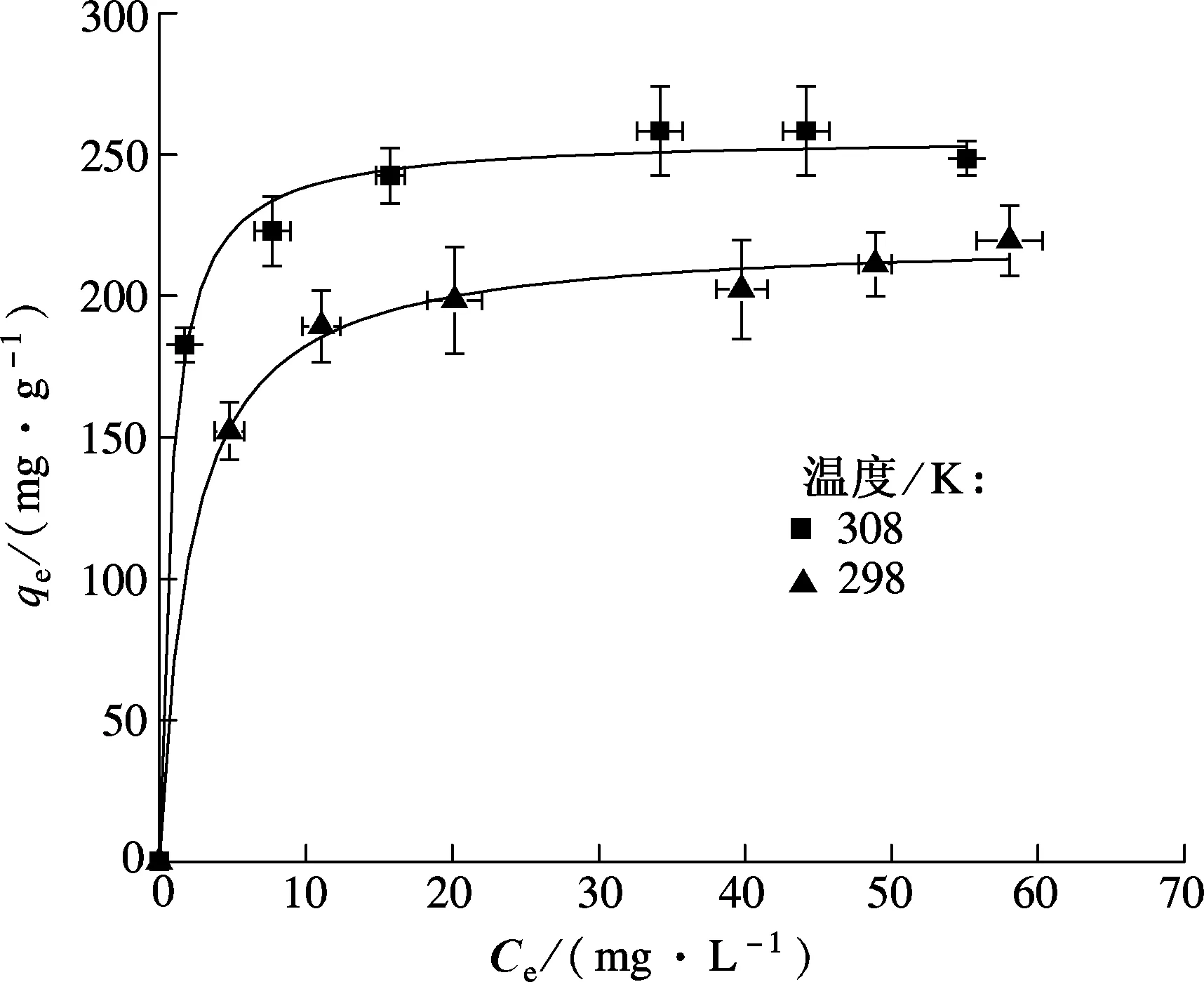
图4 SH-MCM-41吸附Hg(Ⅱ)的等温线

(3)
式中,Q0为单位吸附剂表面覆盖单分子层时的最大吸附量,mg/g;KL为吸附系数,与温度及吸附热有关.拟合的模型参数如表2所示.从表中可以看出,Langmuir模型能较好地拟合吸附等温线(R2>0.99),说明Hg(Ⅱ)在SH-MCM-41是单层吸附,计算得到的最大吸附量与实验结果相差不大.当温度为308 K时,吸附剂每摩尔巯基吸附的Hg(Ⅱ)为1.01 mol,表明SH-MCM-41上的巯基官能团与Hg(Ⅱ)发生等量的配位作用.而未改性的吸附剂如硅镁石[2]、活性炭[3]等对Hg(Ⅱ)的最大吸附量仅为41~174 mg/g,说明巯基化改性介孔材料能有效提高水中Hg(Ⅱ)的去除能力.

表2 SH-MCM-41吸附Hg(Ⅱ)的Langmuir等温线参数
ΔG0=-RTlnKL
(4)
ΔG0=ΔH0-TΔS0
(5)
式中,R为气体常数,R=8.31 J/(mol·K);T为溶液的温度,K.经过计算得出在298和308 K时的ΔG0分别为-28.4和-31.9 kJ/mol.根据式(5)计算得到ΔH0和ΔS0分别为79和360 J/(mol·K).ΔG0为负值说明吸附是可行的,且是自发进行的.ΔH0为正值说明吸附过程是吸热过程,吸附热值较大,说明Hg(Ⅱ)与SH-MCM-41之间的结合力较强.ΔS0为正值说明吸附质和吸附剂在固液界面间的混乱程度增加.
2.2.3 pH值对SH-MCM-41吸附Hg(Ⅱ)影响
溶液pH值是影响金属离子吸附的重要因素,它不仅影响溶质的存在状态,也影响着吸附剂表面的电荷特性和化学特性,进而影响吸附效果.pH值对SH-MCM-41吸附Hg(Ⅱ)的影响如图5所示.从图中可以看出,在pH 2.0~7.6范围内,Hg(Ⅱ)在SH-MCM-41上的吸附基本保持不变,饱和吸附量在190~240 mg/g之间,平均去除率为42.7%.在初始pH 4.0~6.7时,SH-MCM-41吸附Hg(Ⅱ)后,溶液pH值降低,最大降低量约为1.4,说明巯基上的H被置换下来.从吸附等温线可以得出,巯基上的H与溶液中的Hg(Ⅱ)发生1∶1置换.而在初始pH 2~4和pH 6.7~7.6时,SH-MCM-41吸附Hg(Ⅱ)平衡后,溶液pH保持不变.

图5 pH对SH-MCM-41吸附Hg(Ⅱ)的影响


(6)


(7)
2.2.4 氯离子对SH-MCM-41吸附Hg(Ⅱ)影响
天然水体中存在大量的氯离子,而汞离子能与多个氯离子形成络合物,不同的络合物对SH-MCM-41的吸附可能产生影响,实验中考察了溶液中氯离子浓度的变化对SH-MCM-41吸附Hg(Ⅱ)的影响,当氯离子浓度从0增加到0.1 mol/L时,SH-MCM-41对Hg(Ⅱ)的吸附量从226 mg/g降低到172 mg/g,去除率从45.2%降低到34.4%;当氯离子浓度从0.1 mol/L增加到1 mol/L时,SH-MCM-41对Hg(Ⅱ)吸附量不再降低,平均吸附量为173 mg/g.

2.3 脱附实验
Hg(Ⅱ)在SH-MCM-41上的结合能力可以用脱附实验来描述.一般用来脱附吸附剂上的金属离子溶液有HCl,HNO3和EDTA等.实验考察了12 mol/L HCl和0.05 mol/L EDTA溶液脱附Hg(Ⅱ)的情况,结果表明, HCl的最大脱附率为60%,而用EDTA的最大脱附率为12%,说明Hg(Ⅱ)在SH-MCM-41上不易发生脱附,二者的结合能力较强.而Walcarius等[13]采用3 mol/L HCl+5%硫脲的溶液进行脱附时,脱附率达到81%.因此,SH-MCM-41的再生可考虑加入硫脲.
3 结论
1) 用3-巯丙基三甲氧基硅烷改性MCM-41得到巯基化MCM-41,与MCM-41相比,巯基化MCM-41的介孔结构特征保持不变,比表面积、孔容和孔径均减少,硫含量为4.04%.
2) 利用巯基化MCM-41可以有效地去除水中Hg(Ⅱ),吸附符合假二级动力学模型,吸附速率随着初始浓度的增加而增加,吸附等温线符合Langmuir模型,最大吸附量随着温度的升高而升高,温度为298和308 K时的饱和吸附容量分别为219和258 mg/g,溶液pH(2.0~7.6)基本不影响巯基化MCM-41对Hg(Ⅱ)的吸附,当氯离子浓度从0增加到0.1 mol/L时,巯基化MCM-41对Hg(Ⅱ)的吸附量降低,当氯离子浓度从0.1 mol/L增加到1 mol/L时,巯基化MCM-41对Hg(Ⅱ)的吸附量保持不变.
3) 脱附实验表明,Hg(Ⅱ)在巯基化MCM-41上结合力较强.因此,3-巯丙基三甲氧基硅烷改性MCM-41作为一种优良的汞吸附材料在汞污染治理领域具有潜在的应用价值.
)
[1] Chiarle S, Ratto M, Rovatti M. Mercury removal from water by ion exchange resins adsorption[J].WaterResearch, 2000,34(11): 2971-2978.
[2] Benhammou A, Yaacoubi A, Nibou L, et al. Study of the removal of mercury (Ⅱ) chromium(Ⅵ) from aqueous solutions by Moroccan stevensite[J].JournalofHazardousMaterials, 2005,B117(213): 243-249.
[4] 张翠, 周玮, 路平, 等. 巯丙基官能团化MCM-41对Pb(Ⅱ)的吸附[J]. 化学通报, 2006, 69(7): 529-531.
Zhang Cui, Zhou Wei, Lu Ping, et al. Adsorption of Pb(Ⅱ) by mercapto-modified MCM-41[J].Chemistry, 2006,69(7): 529-531. (in Chinese)
[5] Puanngam M, Unob F. Preparation and use of chemically modified MCM-41 and silica gel as selective adsorbents for Hg (Ⅱ) ions[J].JournalofHazardousMaterials, 2008,154(1/2/3): 578-587.
[6] Teng M, Wang H, Li F, et al. Thioether-functionalized mesoporous fiber membranes: sol-gel combined electrospun fabrication and their applications for Hg2+removal[J].JournalofColloidandInterfaceScience, 2011,355(1): 23-28.
[7] Jeong E Y, Ansari M B, Mo Y H, et al. Removal of Cu(Ⅱ) from water by tetrakis(4-carboxyphenyl) porphyrin-functionalized mesoporous silica[J].JournalofHazardousMaterials, 2011,185(2/3): 1311-1317.
[8] Broyer M, Valange S, Bellat J P, et al. Influence of aging, thermal, hydrothermal, and mechanical treatments on the porosity of MCM-41 mesoporous silica[J].Langmuir, 2002,18(13): 5083-5091.
[9] Mercier L, Pinnavaia T J. Heavy metal ion adsorbents formed by the grafting of a thiol functionality to mesoporous silica molecular sieves: factors affecting Hg(Ⅱ) uptake[J].EnvironmetalScienceandTechnology, 1998,32(18): 2749-2754.
[10] Ramakrishna T V, Aravamudan G, Vijayakumar M. Spectrophotometric determination of mercury(Ⅱ) as the ternary complex with rhodamine 6G and iodide[J].AnalyticaChimicaActa, 1976,84(2): 369-375.
[11] Kresge C T, Leonowicz M E, Roth W J, et al. Ordered mesoporous molecular sieves synthesized by a liquid-crystal template mechanism[J].Nature, 1992,359(6397): 710-712.
[12] Aguado J, Arsuaga J M, Arencibia A. Adsorption of aqueous mercury(Ⅱ) on propylthiol-functionalized mesoporous silica obtained by cocondensation[J].IndustrialandEngineeringChemistryResearch, 2005,44(10): 3665-3671.
[13] Walcarius A, Delacte C. Mercury (Ⅱ) binding to thiol-functionalized mesoporous silicas: critical effect of pH and sorbent properties on capacity and selectivity[J].AnalyticaChimicaActa, 2005,547(1): 3-13.
