烟草品种DB101青枯病症状发生前后部分蛋白质变化规律研究
2013-03-21袁清华谢锐鸿马柱文张振臣李淑玲李集勤陈俊标
袁清华,谢锐鸿,马柱文,张振臣,李淑玲,李集勤,陈俊标
广东省农业科学院作物研究所烟草研究室,广州市天河区五山金颖西二街18号 510640
烟草青枯病(Tobacco bacterial wilt )发生时可严重影响烟叶产量,防治措施主要包括抗病育种、合理耕作、药剂防治和生物防治[1-2]。抗病育种从品种特性入手对烟草进行抗性改良,是一条经济、环保、有效的途径。抗病育种过程中,育种材料的选择决定育种工作的成败。因此了解抗病材料的抗性机理可为育种材料的选择提供理论依据。烟草青枯病抗性鉴定通常用抗病品种Dixie Bright101(DB101)作为抗病对照[3]。DB101来源于美国[4],是较早选育的抗青枯病的烟草品种。但对其进行抗性机理研究的报道较少见。
作为一种新的研究蛋白质差异表达的技术,蛋白质组学为研究作物抵抗病原微生物的机理提供了一条十分重要的途径。这是由于无论是病原微生物对宿主的识别和入侵还是宿主对病原微生物的识别与抵抗,这两个不同作用路径中的各个环节,都有不同的蛋白质发挥着不同的作用[5]。同时,在宿主抵抗病原微生物入侵时发生的各种生物学响应机制也有蛋白质的参与[6]。有些具有酶功能的蛋白质还参与到抗病过程的各种生理生化过程并发挥十分重要的作用。蛋白质是基因表达的结果,是病原入侵时表现抗性的直接作用物。通过蛋白质组学的方法,寻找抗病材料与病原菌相互作用时的差异表达蛋白,能够从蛋白表达水平上了解作物的抗病机理,以及其中蛋白之间的相互作用。因此,蛋白质组学可以在研究作物的抗病机制中发挥重要的作用。
宋浩等[7]进行不同烟草青枯病抗性品种的蛋白质组学比较研究,结果发现2个不同抗性品种间的蛋白质组分不同,26 个蛋白质在 2 个不同抗性品种中发生了差异变化,其中在DB101 表达量上升的有12个,在红花大金元表达量上升的有14 个。本试验应用蛋白质胶条鉴定技术,对DB101在接种后应对青枯病菌入侵时部分蛋白质组分的变化过程进行了探索。
1 材料与方法
1.1 实验材料
植物材料:DB101种子为本研究室保存资源。
病原菌材料:中等致病力的青枯菌(由华南农业大学刘琼光老师提供)。
1.2 实验方法
本试验分别在田间盆栽和人工气候箱两个不同环境下进行研究,对两个不同环境下的总蛋白质组分以SDS-PAGE指纹图谱的方式考察其发病前后的总体变化趋势。通过比较选择田间盆栽样品进行蛋白质胶条鉴定。
1.2.1 田间盆栽试验
2011年7月5日播种,9月2日移栽,移栽后一周施肥一次。旺长期接种。于2011年11月1日、2011年11月2日分别取样,对应编号为A、B系列样品。选取3株长势相近、发病情况一致的烟株,各摘取1片叶片合并装入自封袋,磨样时每个自封袋为一个重复。
1.2.2 人工气候箱接种试验
1.2.2.1 培养青枯菌
将冻存的青枯菌菌种划线活化,挑取单菌落接种于100 m LNA液体培养基中,28℃,100 rpm摇床摇菌24 h,培养至菌液浓度约为3.9×108cfu/mL。
1.2.2.2 青枯病接种试验
2011年10月12日播种,发芽后适时间苗,每盆保留一株。2011年12月16日接种。用剪刀插入栽培基质使根损伤然后淋下1 mL青枯菌液,2个重复。2盆(株)注射清水,作为对照。2011年12月20日接种处理的烟株均发病,进行拍照,并摘取从底部向上数第3片叶片作为样品。将样品装入自封袋,-80摄氏度保存备用。
1.2. 3 SDS聚丙烯酰胺凝胶电泳
1.2.3.1 提取蛋白质
以上样品各称取5 g,剪碎研磨成粉末提取蛋白质,方法参照Wang等[8]。
1.2.3.2 蛋白质定量
各取前面制备的蛋白粉末约30 mg,溶解于600 uL 1×上样缓冲液(不含溴酚蓝指示剂),振荡,置于4℃冰箱溶解过夜。取出离心。取50 uL蛋白质溶液、50 uL 1×上样缓冲液分别定容到2 mL,以稀释后的上样缓冲液作为空白测各个样品的260 nm和280 nm处吸光值。根据经验公式(赵亚华,2005)计算:蛋白质浓度=1.45×A280 - 0.74×A260 (mg/mL)计算各个样品的相对浓度。根据相对浓度调整上样量,以达到各样品总蛋白量一致。Maker加5 μL。
1.2.3.3 电泳
配制15%浓度的分离胶,5%的浓缩胶。用上样缓冲液溶解蛋白质样品上样。70V低电压浓缩,110V电压电泳。分离胶、浓缩胶、上样缓冲液配方参照《蛋白质与蛋白质组实验指南》(Richard J.Simpson 主编,何大澄主译 2006)。上样缓冲液以DTT(二硫苏糖醇)代替巯基乙醇。
1.2.4 蛋白质胶条鉴定
对样品进行蛋白液提取和凝胶电泳分离; 对胶条进行识别、编号,并切胶;胶内酶解,并洗脱,得到肽段混合物;通过LC-MS/MS质谱分析,得到原始质谱数据。通过实验串联质谱数据,与数据库模拟得到的理论质谱数据进行匹配,从而得到蛋白质鉴定结果。基于蛋白鉴定结果,做GO,COG,Pathway等分析。蛋白质鉴定的工具是蛋白质搜索鉴定软件Mascot,软件版本:Mascot 2.3.02。鉴定选用数据库:茄目Solanales txid4069 43571 sequences。搜索选用的酶为胰蛋白酶。选用的仪器:LTQ-Otbitrap-Velos。胶条鉴定由华大基因公司完成。
1.2.5 仪器设备
台式离心机3SR+ :Thermo,光密度扫描仪GS-800 :Bio-Rad,Concentrator plus真空离心浓缩仪:Eppendorf,PowerPac Universal电泳仪电源:Bio-Rad,Mini-Protein Tetra System微型垂直电泳系统:Bio-Rad,紫外可见分光光度计DU 800 :贝克曼库尔特。
2 结果与分析
2.1 SDS电泳比较
SDS电泳结果(图1)显示,田间试验结果与人工气候箱试验结果有一致的变化趋势,即在抗病过程中,部分蛋白质组分发生消解,在表达量上产生明显的变化,尤其在分子量大小约为50~60 kD之间的变化最显著。
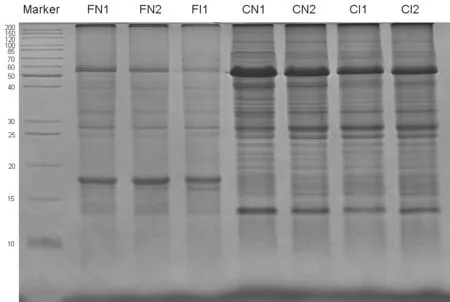
图1 DB101在田间与光照培养箱中抗青枯病过程蛋白质组分的SDS-PAGE电泳比较
为进一步明确两种不同环境中植株发病前后发生显著变化蛋白质具体组分,本研究裁割FN2(未发病植株)、FI1(发病植株)SDS-PAGE泳道中分子量在50~60 kD之间发生显著变化的条带进行蛋白质胶条鉴定。
2.2 蛋白质胶条鉴定结果
胶条鉴定结果显示,两个样品的胶条分别鉴定出168和162种蛋白质组分(表1)。99种组分在发病前后的植株均存在。69种组分仅在未发病植株中出现,63种组分仅在发病植株中出现。进一步对这些已鉴定出的蛋白进行生物信息学分析。比较两样品间的差异。
2.3 GO分析
图2为两样品各自鉴定出的蛋白质组分的GO分析结果。比较两者间的差异发现,两样品在不同的生物学过程中表达的蛋白质数量有所不同。各个生物过程中未发病植株表达的蛋白质数量几乎都多于发病植株,仅在生物过程中的生物调节、生长、生物过程的调控和应激响应过程发病植株表达的蛋白数量多于未发病植株。发病植株胞外区细胞成分表达的蛋白质数量比未发病植株多。未发病植株表达的蛋白质分子功能以酶调节活性和结构分子活性的蛋白质数量居多。

表1 样品鉴定结果
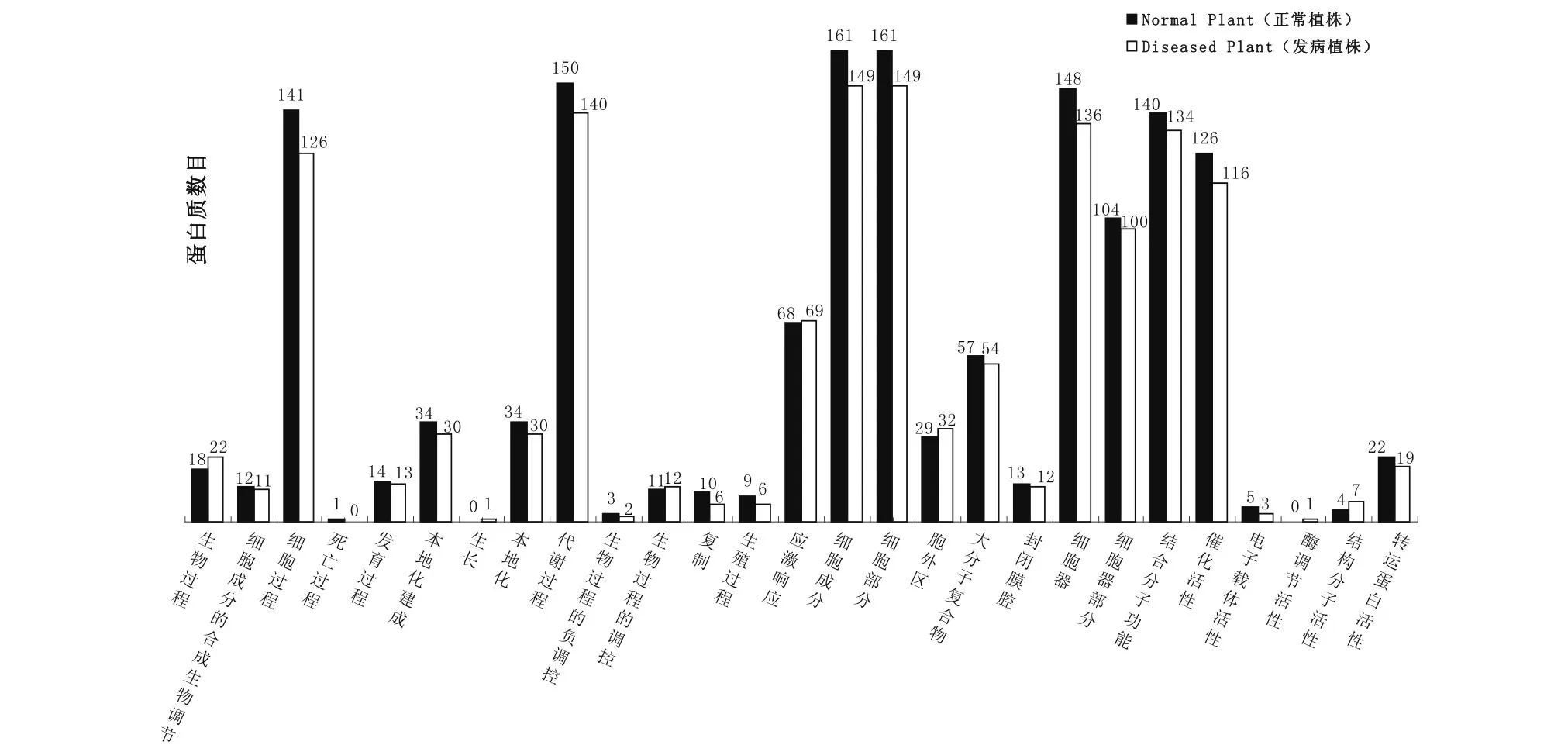
图2 正常植株与发病植株的GO差异比较
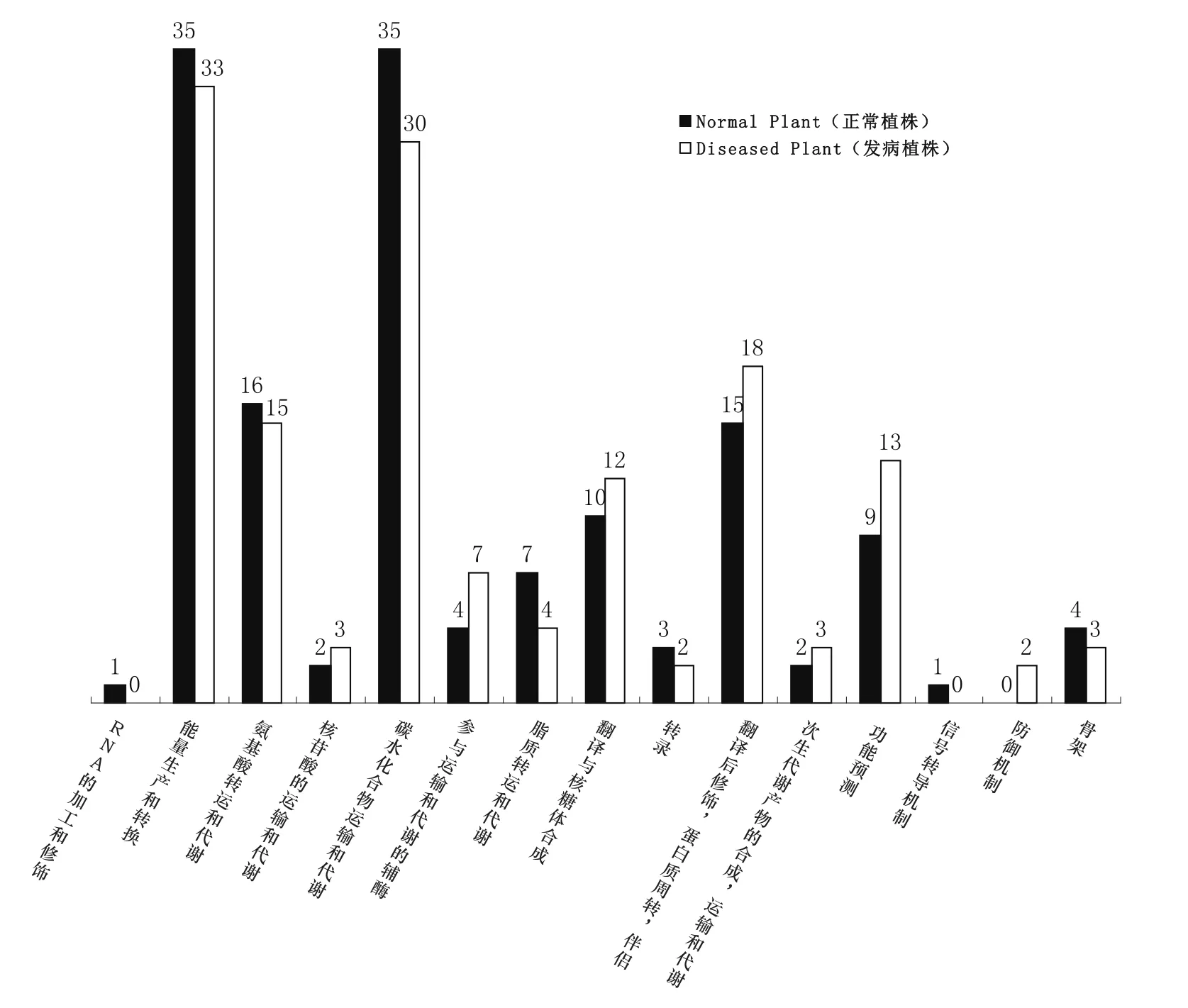
图3 正常植株与发病植株COG差异比较
2.4 COG分析
对这些差异蛋白进行蛋白相邻聚簇(COG)分析(图3)。分析结果显示,对于烟草抗青枯病品种DB101,植株发病以后,分子量大小在50~60 kD之间的相关蛋白质主要在以下方面数量有所增加:核苷酸的运输代谢,运输和代谢的辅酶,翻译、核糖体结构和合成,翻译后修饰,蛋白质周转、伴侣,次生代谢产物的合成、运输和代谢,防御机制等相关蛋白。除此以外,还有一些未知功能的蛋白质在发病植株中可能对于作物抵御病原微生物的侵扰起作用。
2.5 Pathway分析
综合以上分析结果,发病植株中,有2个分子量大小在分子量在50~60 kD之间的蛋白质与防御机制相关。本研究通过生物信息学途径检测分析其所在的代谢路径。结果如图4和图5。图中结果表明,这2个蛋白在组成剪切体的细胞核核糖核蛋白的合成和代谢通路中。同时与ABC转运子的合成与代谢也有关系。

图4 可能参与青枯病防御机制的蛋白质所在的代谢路径(1)

图5 可能参与青枯病防御机制的蛋白质所在的代谢路径(2)
3 讨论
DB101在20世纪50年代育成于美国,其抗性较稳定,是国内烟草品种青枯病抗性鉴的抗病对照,然而其抗性机理却未得到明确的阐析。本试验考察田间和人工气候箱2个不同环境下,该品种发病植株在发病后与未发病植株相比其蛋白质组分的变化趋势,发现发病后植株的蛋白质在分子量大小约为50~60 kD之间的部分蛋白发生明显的变化;进一步应用蛋白质胶条鉴定技术对该部分蛋白质进行鉴定和生物信息学分析,得到该烟草青枯病抗病品种在抵御病原微生物入侵时基因表达引起的部分生理生化变化信息。
本试验仅选择田间样品作为蛋白质胶条鉴定样品,原因主要有以下2点:(1)SDS-PAGE指纹图谱显示,田间和人工气候箱两个不同环境中,发病植株与正常植株比较均发生相同的变化趋势,即发病后的植株中分子量大小约为50~60 kD之间的蛋白质组分发生明显的消减。(2)田间环境中发病前后的蛋白质变化趋势虽然与人工气候箱环境中的一致,但蛋白质数量明显比人工气候箱环境中的少,因此选择此环境中的样品作为蛋白质胶条鉴定对象,以考察在两个不同环境中共同存在的烟草植株抵抗青枯病菌的相同蛋白质组分变化趋势。
本试验针对该品种发病前后发生显著变化的部分蛋白质组分进行生物信息学分析,得到2个分子量大小在分子量在50~60 kD之间、与防御机制相关的蛋白。该蛋白主要存在于组成剪切体的细胞核核糖核蛋白的合成和代谢通路中,可能与ABC转运子的合成与代谢也有关系。植物ABC转运蛋白于1992年被首次报道,在植物生长素的极性转运、脂质的降解、外源毒素的解毒、植物抗病和气孔的功能调节等方面起作用[9-10]。水稻ABC1家族被证明参与非生物胁迫应答,在逆境胁迫应答中发挥重要作用[11]。然而,未见关于该类蛋白是否与青枯病胁迫应激响应有关的相应报道,因此该问题有待进一步深入研究。
[][]
[1] 番华彩,唐嘉义,秦小萍,等.烟草青枯病防治研究进展[J].云南大学学报:自然科学版,2008,30(S1):31-35.
[2] 徐辉,熊霞. 烟草青枯病防治技术研究进展[J].湖南农业科学,2009(4):91-94.
[3] 王志德, 王元英, 牟健民. 烟草种质资源描述规范及数据标准[D]. 北京:中国农业出版社,2006.
[4] Weeks W W, Chaplin J F,Campbell J C R. Capillary chromatography: evaluation of volatiles from fluecured tobacco varieties[J]. Agric Food Chem, 1989, 37(4):1038-1045.
[5] 张彩霞,李壮,陈莹. 植物与病原茵互作的蛋白质组学研究进展[J]. 西北植物学报,2010,30(3):0626-0632.
[6] 赵大伟,范海延,武春飞,等. 植物响应病原菌胁迫的蛋白质组学研究进展[J]. 广西植物,2009, 29(6):758-762.
[7] 宋浩,丁伟,沙伟,等. 不同烟草青枯病抗性品种的蛋白质组学比较. 中国烟草科学[J], 2011,32(5):70-76.
[8] Wang W, Scali M, Vignani R, et al. Protein extraction for two-dimensional electrophoresis from olive leaf, a plant tissue containing high levels of interfering compounds [J].Electrophoresis, 2003, 24(14): 2369-2375.
[9] Verrier P J, Bird D, Burla B, et al. Plant ABC proteins--a unif i ed nomenclature and updated inventory[J]. Trends Plant Sci,2008,13(4):151-159.
[10] Rea P A. Plant ATP-binding cassette transporters [J].Annu Rev Plant Biol,2007,58:347-75.
[11] Michal Jasinski, Eric Ducos, Enrico Martinoia. The ATP-binding cassette transporters: structure, function, and gene family comparison between rice and Arabidopsis [J].Plant Physiology March,2003 ,131(3):1169-1177.
