As(Ⅲ)暴露对紫贻贝抗氧化酶活性和脂质过氧化的影响
2013-03-20李巧梅王清于倩吴惠丰由丽萍赵建民
李巧梅,王清,于倩,吴惠丰,由丽萍,赵建民
(1.中国科学院烟台海岸带研究所 海岸带环境过程与生态修复重点实验室,山东 烟台264003;2. 中国科学院大学 北京 100049)
砷(As) 在自然界中普遍存在,它既有金属性又有非金属性,是一种毒性较高的污染物。近年来,砷矿的开采和熔炼、含砷农药的使用以及用砷化物作原料的工矿企业“三废”的排放,使得环境中砷污染日趋严重。目前,我国近岸海域环境中砷污染状况也较为严峻。据《中国海洋环境质量公报》,2007年至2010年期间,我国主要河流的砷入海排污量分别达到6 000 t、6 183 t、3 918 t 和3 137 t;虽然总体趋势有所降低,但局部海域的砷污染现象仍非常严重(张丽旭等,2005;任景玲等,2009)。海水中的砷通常以可溶的无机态形式存在,另有极微量的来源于海洋生物的有机砷;因此,海水中的砷毒性通常较强(Neff,1997)。目前,国内外的研究主要关注砷的富集作用及水产品中砷残留对人类健康的潜在危害,而海湾或河口地区较高浓度的砷污染对海洋生物的毒害作用却少有报道。
紫贻贝作为典型的海洋环境指示生物,具有移动性差和滤食性等特点,易遭受环境污染的暴露。例如,大连湾紫贻贝的无机砷平均残留量达到1.11 mg/kg(刘广远等,1996),闽南沿海紫贻贝总砷含量介于3.7~14.0 mg/kg,无机砷在0.64~1.16 mg/kg 之间(钟硕良等,2005)。此外,国内外多项研究表明,紫贻贝可高度富集海水中的砷,且其富集程度显著高于多数海洋生物(张少娜等,2004;Slejkovee,1996;Szefer,2004)。因此,开展砷对紫贻贝的生态毒理效应研究具有较为重要的意义。
本研究通过亚砷酸钠亚慢性暴露紫贻贝,分别测定鳃和肝胰腺组织抗氧化指标的变化,探讨As(Ⅲ) 暴露对紫贻贝抗氧化能力的影响。研究结果可为深入了解砷在海洋贝类体内的毒性作用机制提供参考,并可为我国近海砷污染的生态风险评估和治理决策提供理论依据。
1 材料与方法
1.1 实验动物与试剂
紫贻贝购自当地水产市场,驯养一周后开始正式实验。实验期间保持连续充气,海水温度控制在20±1 ℃,定时定量投喂扁藻和三角褐指藻。每天换水一次,换水后重新添加相应浓度的As(Ⅲ)。
亚砷酸钠(NaAsO2) 购自国药集团,为分析纯制品。配制成5 mg/L 母液后,按实验暴露浓度进行相应稀释。SOD、GST、CAT 活性及GSH、MDA 含量的测定采用南京建成生物研究所试剂盒进行。
1.2 暴露实验
实验设置包括1 个对照组和3 个处理组,处理组分别采用1、10、100 μg/L (NaAsO2) 进行暴露,对照组未进行任何处理。每个处理组设置3 个重复。暴露30 天后取样,每个处理组随机选取6个紫贻贝分别采集肝胰腺和鳃组织,置于液氮冻存,用于后续SOD、CAT、GST 活性及GSH、MDA 含量的测定。
1.3 抗氧化指标的测定
取冻存样品,加入9 倍体积的Tris-HCl 缓冲液(0.01 M Tris-HCl,0.1 M EDTA-2Na,0.01 M 蔗糖,8 g/L NaCl,pH 7.4),采用IKA 匀浆机完全均质化(12 000 r/m 匀浆两次,10 s/次);组织匀浆液经4 ℃,1 000×g 离心10 min 收集上清液。匀浆液的蛋白浓度采用考马斯亮兰法测定(Bradford et al,1976),以牛血清蛋白制作标准曲线。
SOD、CAT、GST 活性及MDA、GSH 含量的测定采用南京建成生物研究所试剂盒,参照试剂盒说明书操作。其中,SOD、CAT 和GST 活性单位为U/mg 蛋白,MDA 含量单位为nM/mg 蛋白,GSH 含量单位为mg/g 蛋白。
1.4 数据统计
实验结果表示为平均值±标准偏差(Mean±S.D.)。使用SPSS 13.0 统计软件在P=0.05 的置信水平对上述抗氧化指标进行单因素方差分析,并采用Origin 8.0 软件绘图。
2 结果与分析
2.1 As(Ⅲ) 暴露对紫贻贝肝胰腺抗氧化指标的影响
采用As(Ⅲ) 进行亚慢性暴露时,低(1 μg/L)、中(10 μg/L) 剂量暴露组紫贻贝肝胰腺中的CAT(图1A)、SOD(图1B)、GST(图1D) 活性以及GSH 含量(图1C) 均较对照组水平有所增加,但并无显著差异(P >0.05);高剂量暴露组(100 μg/L)肝胰腺MDA 的含量(图1E) 较对照组显著升高(P <0.05),而中、低剂量组(1 μg/L 和10 μg/L)较对照组水平无显著变化。
2.2 As(Ⅲ) 暴露对紫贻贝鳃组织抗氧化指标的影响
As(Ⅲ) 对紫贻贝鳃组织CAT 活性(图2A)和GSH 含量(图2C) 的影响表明:较对照组水平,低剂量(1 μg/L) As(Ⅲ) 暴露可导致鳃组织CAT 活性显著升高(P <0.05,1.9 倍),GSH 含量略微增加;中剂量暴露组(10 μg/L) CAT 活性和GSH 含量均极显著升高(P <0.01),分别达到对照组水平的2.8 倍和2.1 倍;而高剂量暴露组(100 μg/L) CAT 活性和GSH 含量较对照组水平有所升高但不显著。
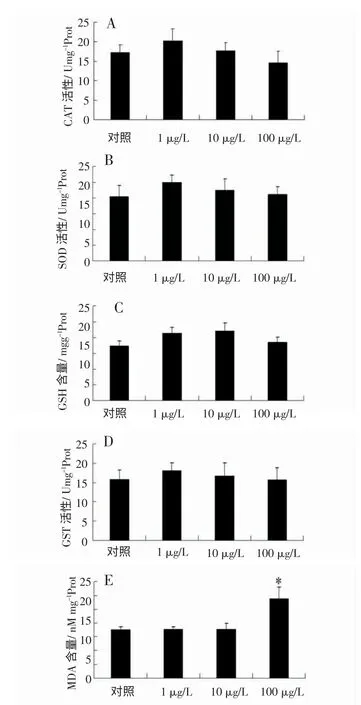
图1 不同浓度As(Ⅲ) 暴露下紫贻贝肝胰腺CAT、GST、SOD活性以及GSH 和MDA 含量的变化
As(Ⅲ) 对紫贻贝鳃组织SOD(图2B) 和GST 活性(图2D) 的影响结果显示:3 种剂量暴露组均可诱导鳃组织SOD 活性的上升,但较对照组水平无显著差异(P >0.05),此趋势与As(Ⅲ)对肝胰腺SOD 活性的影响基本一致。对GST 活性而言,低剂量组活性较对照组略微升高,而中、高剂量组水平较对照组则有所降低。
As(Ⅲ) 对紫贻贝鳃组织MDA 含量的影响如图2E 所示。结果表明,不同剂量As(Ⅲ) 暴露均能导致鳃组织MDA 含量的增加;其中,低、中剂量组MDA 含量较对照组有所升高,但无显著差异(P >0.05),而高剂量暴露组的MDA 含量则极显著升高(P <0.01),达到对照组水平的1.98 倍。
3 讨论
目前,有关无机砷对双壳贝类毒性作用机制的研究相对较少,仅在斑马贻贝(Dreissena polymorpha) 和淡水贻贝(Lamellidens marginalis) 中有相关报道。此外,其它部分水生生物中也有相关报道,包括栉水蚤(Asellus aquaticus)、沙蚕(Laeonereis acuta) 和翠鳢(Channa punctatus) 等。
在本实验条件下,紫贻贝经高浓度As(Ⅲ)(100 μg/L) 暴露30 天时,表征脂质过氧化水平的MDA 含量显著增加。类似的现象在其它水生动物中也有报道。例如,翠鳢经1 mg/L As(Ⅲ) 暴露7 天可导致机体脂质过氧化水平的显著升高(Allen et al,2004;Pisanelli et al,2009),沙蚕经50 μg/L砷暴露7 天后,脂质过氧化物(LPO) 含量有所增加(Ventura et al,2011)。但斑马贻贝在80 μg/L As(Ⅲ) 暴露7 天后,体内脂质过氧化水平基本无变化(Bouskill et al,2006),这可能是由于斑马贻贝对砷的耐受性较强所致。多数研究表明,亚砷酸钠可导致生物体多器官的脂质过氧化水平增强,并伴随组织抗氧化能力的降低(Mosleh et al,2007;Pisanelli et al,2009),表明脂质过氧化很可能是砷毒性作用机制之一(Fernández et al,2012)。

图2 不同浓度As(Ⅲ) 暴露下紫贻贝鳃组织CAT、GST、SOD活性以及GSH 和MDA 含量的变化
本实验对紫贻贝肝胰腺和鳃组织抗氧化指标的研究发现,肝胰腺和鳃组织CAT、SOD、GST 活性以及GSH 含量随As(Ⅲ) 浓度的增加呈现先升高后降低的趋势。这可能是由于紫贻贝机体的抗氧化防御体系由低浓度的诱导逐步转变为高浓度的抑制所致。此外,研究发现,紫贻贝鳃组织抗氧化指标的变化较肝胰腺更为敏感,不同剂量As(Ⅲ) 暴露可导致紫贻贝鳃组织CAT 活性和GSH 含量显著升高(P<0.05),而肝胰腺上述指标均无显著变化。上述现象的产生可能与贻贝鳃组织对砷的富集程度较高有关(Francesconi et al,1999)。类似的现象在淡水贻贝L.marginalis 中也有报道,经1 mg/L As(Ⅲ) 暴露30 d 后,鳃组织GST 和CAT 活性受到抑制,并导致组织发生病理学变化,影响到鳃组织正常的气体交换、滤食行为以及病原防御等免疫反应(Chakraborty et al,2010;Vidal-L~ián et al,2010)。可见,双壳贝类鳃组织抗氧化活性的变化有可能成为评估环境砷污染状况的潜在生物标志物(Box et al,2009;Moraga et al,2005)。
Allen T,Singhal R S,Rana S V S,2004.Resistance to oxidative stress in a freshwater fish:Channa punctatus after exposure to inorganic arsenic.Biological Trace Element Research,98(1):63-65.
Bouskill N J,Handy R D,Ford T E,et al,2006.Differentiating copper and arsenic toxicity using biochemical biomarkers in Asellus aquaticus and Dreissena polymorph.Ecotoxicology and Environmental Safety,65(3):342-349.
Box A,Sureda A,Deudero S,et al,2009.Antioxidant response of the bivalve Pinna nobilis colonized by invasive red macroalgae Lophocladia lallemandii. Comparative Biochemistry and Physiology Part C,149:456-460.
Bradford M,1976.A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein-dye binding.Analytical Biochemistry,72(1-2):248-254.
Chakraborty S,Ray M,Ray S,2010.Toxicity of sodium arsenite in the gill of an economically important mollusc of India. Fish & Shellfish Immunology,29(1):136-148.
Fernández B,Campillo J A,Martínez-Gómez C,et al,2012.Assessment of the mechanisms of detoxification of chemical compounds and antioxidant enzymes in the digestive gland of mussels,Mytilus galloprovincialis,from Mediterranean coastal sites.Chemosphere,87(11):1235-1245.
Francesconi K A,Gailerb J,Edmonds J S,et al,1999.Uptake of arsenic-betaines by the mussel Mytilus edulis.Comparative Biochemistry and Physiology Part C,122:131-137.
Moraga D,Meistertzheim A L,Royer S T,et al,2005.Stress response in Cu2+and Cd2+exposed oysters (Crassostrea gigas):an immunohistochemical approach. Pharmacology & Toxicology,141(2):151-156.
Mosleh Y Y,Palacios S P,Ahmed M T,et al,2007. Effects of chitosan on oxidative stress and metallothioneins in aquatic worm Tubifex tubifex (Oligochaeta,Tubificidae) . Chemosphere,67(1):167-175.
Neff J M,1997.Ecotoxicology of arsenic in the marine environment.Environmental Toxicology and Chemistry,16(5):917-927.
Pisanelli P,Benedetti M,Fattorini D,et al,2009. Seasonal and inter-annual variability of DNA integrity in mussels Mytilus galloprovincialis:A possible role for natural fluctuations of trace metal concentrations and oxidative biomarkers. Chemosphere,77(11):1551-1557.
Slejkovee Z,Byme A R,Smodis B,1996. Preliminary studies on arsenic species in some environmental samples,Fresenius Journal of Analytical Chemistry,354(5-6):592-595.
Szefer P,Kim B S,Kim C K,et al,2004.Distribution and coassociations of trace elements in soft tissue and byssus of Mytilus galloprovincialis relative to the surrounding seawater and suspended matter of the southern part of the Korean Peninsula.Environmental Pollution,129(2):209-228.
Ventura J L,Ramos P B,Fattorini D,et al,2011. Accumulation,biotransformation,and biochemical responses after exposure to arsenite and arsenate in the estuarine polychaete Laeonereis acuta(Nereididae) .Environment Science Pollution Resource,18(8):1270-1278.
Vidal-Linán L,Bellas J,Campillo J A,et al,2010.Integrated use of antioxidant enzymes in mussels, Mytilus galloprovincialis, for monitoring pollution in highly productive coastal areas of Galicia(NW Spain) .Chemosphere,78(3):265-272.
刘广远,韩明辅,陈则玲,1996.中国北方沿岸经济贝类砷残留量的调查研究.海洋环境科学,15(1):23-26.
任景玲,刘素美,张经,2009.黄、东海溶解态无机砷的分布及其季节变化.海洋通报,11(1):25-35.
张丽旭,任松,蔡健,2005.东海三个倾倒区表层沉积物重金属富积特征及其潜在生态风险评价.海洋通报,24(2):92-95.
张少娜,孙耀,宋云利,等,2004. 紫贻贝(Mytilus edulis) 对4种重金属的生物富集动力学特性研究.海洋与湖泊,35(5):438-443.
钟硕良,阮金山,林后祥,等,2011.福建连江县东南部海域养殖贝类质量安全评估.福建水产,33(2):1-5.
