诱导烟草早花的PVX-FT系统的建立
2013-03-20高玉龙肖炳光RalphDewey
高玉龙,肖炳光,Ralph E Dewey
1 云南省烟草农业科学研究院,云南省玉溪市南祥路14号 653100;
2 北卡州立大学 Raleigh, NC 27695-7620
植物开花是一个复杂过程,受外部环境因素和内部基因表达的影响调控。拟南芥的开花受光周期、自主途径、春化途径和赤霉素途径控制[1],光周期途径信号经CO(CONSTANCE)传递给FT(Flowering Locus T),春化途径和自主途径信号经FLC(Flowering Locus C)传递给FT,FT基因的表达诱导花分生组织特异基因AP1(APETALA1)的表达,从而诱导开花。可见,FT基因是控制植物开花信号的汇集点。从对拟南芥FT基因的研究来看,FT编码的蛋白可能是植物“开花素”的重要组成部分[2-4]。FT基因在诱导植物早花的基因工程研究中应用也最为广泛和有效。
FT基因编码的蛋白质属于磷脂酰乙醇胺结合蛋白(Phosphatidylethanolamine-binding protein, PEBP)家族,不同作物的FT基因高度保守。通过异位表达拟南芥FT基因,能够诱导番茄[5]、矮牵牛[6]、瓜类蔬菜[7]等提前开花。
利用FT基因诱导早花在烟草中也已有报道,Ramsey等[8]将拟南芥FT基因导入白肋烟TN90中组成型表达,转基因植株播种后40天左右开花,而正常的非转基因植株要145天左右开花。Ramsey提出将转FT基因应用于烟草回交育种,与常规回交选育相比,育成新品种的时间可以缩短将近一半,利用病毒表达载体使FT基因在烟草中瞬时表达,能够诱导短日照马里兰烟在长日照条件下开花[9-10]。
我国烟草育种工作虽然取得了明显的成绩,但目前生产上的主栽品种比较单一,急需加大烟草品种选育的力度和进度,而烟草生育期比较长,是限制烟草育种进程的一个主要因素。PVX表达系统能够快速表达外源基因,而且不涉及转基因。本研究利用PVX瞬时表达技术使拟南芥FT基因在烤烟、香料烟、白肋烟中瞬时表达,建立诱导烟草早花的PVX-FT系统,以期为加快烟草育种进程提供技术支撑。
1 材料与方法
1.1 材料
烤烟品种K326,云烟87,红花大金元;白肋烟品种TN90;香料烟TEVB(转基因Xanthi,将TEV的HC-Pro基因导入Xanthi,使PVX病毒更容易侵染)。
限制性内切酶购于NEB,T4 DNA连接酶购于大连宝生物。根癌农杆菌GV3101,PVX-FT病毒表达载体由北卡州里大学Ralph Dewey教授惠赠。
1.2 农杆菌渗滤
将构建的载体pCAM:pGR106-FT和空载体pCAM:pGR106质粒DNA通过冻融法分别转化农杆菌菌种GV3101。选取4片真叶左右烟苗的底部2片真叶渗滤法分别接种,利用3mL注射器吸取渗滤液,注射器对着叶片背面轻轻挤压,直到整个叶面湿润。具体步骤参考Van der Hoorn等[11]。
1.3 烟苗生长条件及调查标准
烟苗种植于光照培养室,光照12 h白天,黑夜12 h。温度设定为白天26℃,黑夜18℃。PVX症状出现时间、现蕾和开花时间分别以50%试验苗出现PVX症状、现蕾和开花的时间表示。
1.4 FT基因表达分析
取渗滤后不同时间段有PVX病毒症状的烟株叶片,用Trizol(Invitrogen)提取RNA,SuperScript II RT(Invitogen)合成cDNA。对FT基因的表达进行半定量PCR(RT-PCR)分析。
2 结果
2.1 PVX-FT系统在不同烟草类型中的效果
PVX-FT系统能够诱导供试烤烟、香料烟、白肋烟品种早花。PVX病毒症状在接菌后7~14天出现,质粒pCAM:pGR106对照要比pCAM:pGR106-FT处理提前2~3天出现PVX症状。接菌后23~35天pCAM:pGR106-FT处理处于现蕾期,接菌后39~50天pCAM:pGR106-FT处理开花(表1)。质粒对照和buffer对照在pCAM:pGR106-FT处理开花时仍然处于营养生长阶段(图1)。
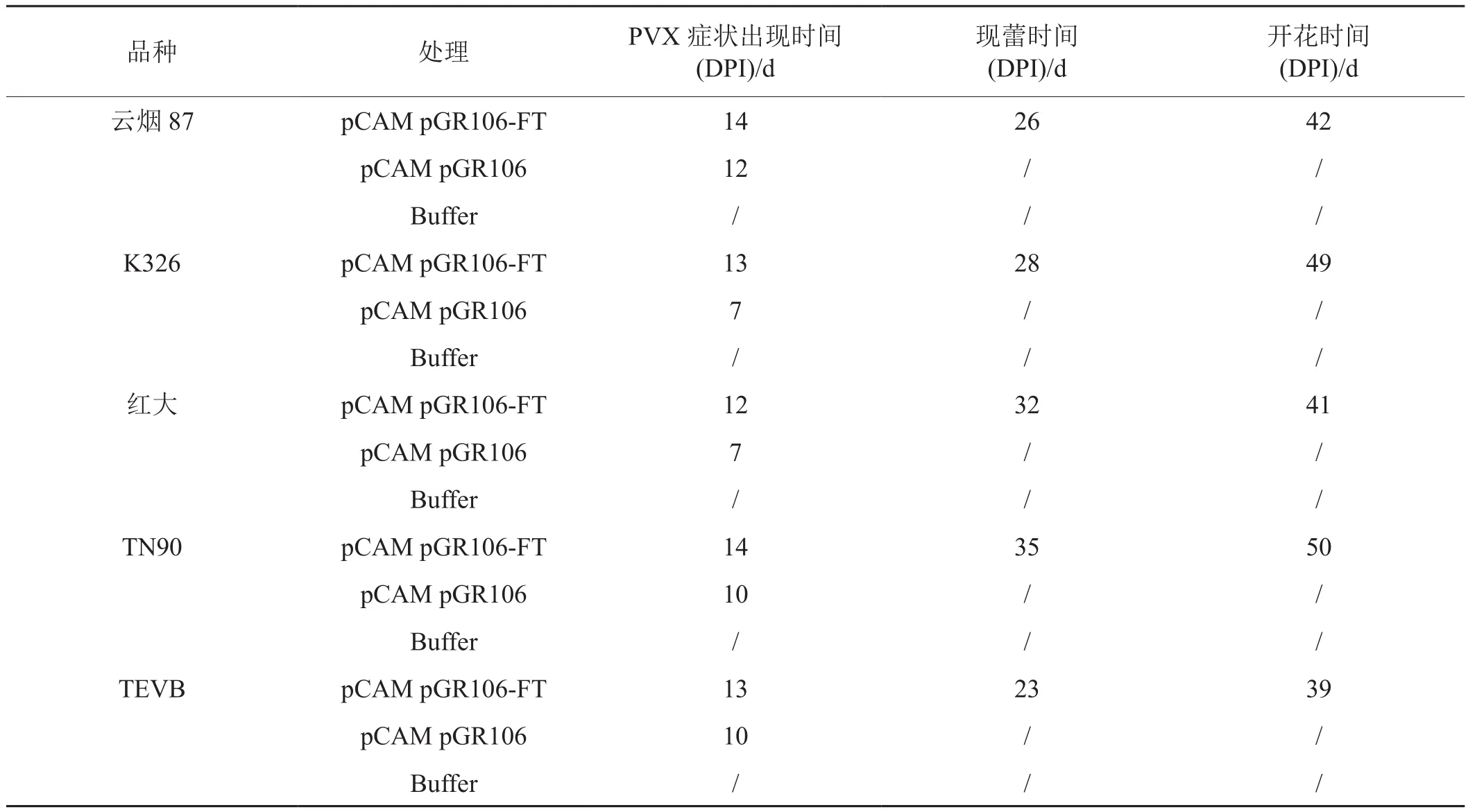
表1 参试品种各阶段的观察记载

图1 PVX-FT系统诱导不同类型烟草早花
2.2 PVX-FT系统渗滤后FT基因的表达分析
为了研究渗滤后FT基因在烟株中的表达情况,我们提取了接菌后4天,8天,12天,现蕾阶段,开花阶段叶片的RNA,进行FT基因的RT-PCR。在试验中,我们发现同一批渗滤烟株(TEVB),少量植株接菌后表现病毒症状,但不早花。提取这些植株的两个时间段(与表现早花植株现蕾和开花同时间)叶片RNA,进行RT-PCR分析。发现不早花的植株,FT基因不表达。早花植株在接菌后4天到开花期都能检测到FT基因的表达(图2)。
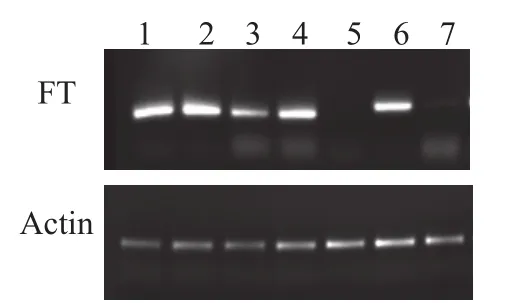
图2 渗滤后TEVB叶片中FT基因的RT-PCR分析
3 讨论
马铃薯X病毒作为瞬时表达载体具有宿主范围广泛、转化方法简单、可快速得到高拷贝的外源基因、目的基因不需稳定整合到宿主基因组中就可以系统侵染植株等优点,而且其不能通过昆虫介体传播,因而成为理想的植物病毒表达载体之一。1992年Chapman等[12]成功构建PVX表达载体,目前,已被广泛应用于研究病毒的侵染、移动、病毒蛋白的功能及生产外源蛋白[13-14]等方面。但是,PVX表达载体也有一些缺陷。如其对外源基因大小有一定的限制,PVX载体对于超过2kb的基因很难表达或不表达;PVX载体经多代繁殖后外源基因容易丢失等。
植物每个调控途径有一个复杂的调控网络,涉及多个基因。由于FT基因参与了多个开花调控途径,并且其位于开花通道下游,所以FT基因被广泛应用于诱导植物早花研究。利用苹果潜隐球形病毒(ALSV)在大豆中使拟南芥FT基因瞬时表达,FTALSV能使短日照大豆在长日照条件下,在第四到第七节(侵染后40天左右)期开花,而对照要到20节以上才开花[15]。不仅如此,FT基因还能诱导多年生的苹果树早花,利用ALSV载体使拟南芥FT基因在苹果树中瞬时表达,在侵染后45到60天,苹果树就能开花,大大缩短了苹果育种中每代需要的时间[16]。Li等[9]利用PVX载体在马里兰烟中瞬时表达FT,诱导短日照习性的马里兰烟在长日照条件下早花。本研究利用PVX病毒载体将拟南芥FT基因在不同类型烟草中进行瞬时表达,结果表明PVX-FT系统能够诱导烤烟、白肋烟和香料烟早花。可见PVX-FT系统可以诱导不同类型烟草早花。在实验过程中发现PVX-FT处理一批苗时会有个别烟株不表现早花的现象,这种烟株中检测不到FT基因表达,这种现象可能是由于PVX-FT载体在繁殖过程中FT基因丢失造成的。本研究构建的PVX-FT系统,可明显缩短烟草每世代所需的时间,应用于烟草常规育种后将大大缩短育成新品种所需的时间。由于PVX-FT侵染烟草后会植株会表现PVX症状,所以该技术适用于不对性状进行选择的情况下,如育种加代或利用与某个性状紧密连锁的分子标记对性状进行选择时。
4 结论
利用PVX病毒瞬时表达载体使拟南芥FT基因在烟草中瞬时表达,该技术能够诱导烤烟、白肋烟和香料烟早花。将该技术应用于烟草育种,可以缩短每个世代所需的时间,从而加快育成新品种的时间。
[1]Martinez-Zapater J M, Coupland G, Dean C, et al. The transition to flowering in Arabidopsis [M]// Meyerowitz E M, Somerville C R. Arabidopsis . Cold Spring Harbor Laboratory Press, New York, 1994:403-434.
[2]Kardailsky I, Shukla V K, Ahn J H, et al. Activation tagging of the fl oral inducer FT[J]. Sci, 1999, 286: 1962-1965.
[3]Kobayashi Y, Kaya H, Goto K, et al. A pair of related genes with antagonistic roles in mediating flowering signals[J].Sci, 1999, 286: 1960-1962.
[4]Corbesier L, Vincent C, Jang S, et al. FT protein movement contributes to long-distance signaling in fl oral induction of Arabidopsis [J]. Sci, 2007.316: 1030-1033.
[5]Lifschitz E,Eshed Y. Universal fl origenic signals triggered by FT homologues regulate growth and fl owering cycles in perennial day-neutral tomato [J]. J Exp Bot, 2006, 57:3405-3414.
[6]Hayama R, Agashe B, Luley E, et al. A circadian rhythm set by dusk determines the expression of FT homologs and the short-day photoperiodic fl owering response in Pharbitis[J].Plant Cell, 2007, 19:2988-3000.
[7]Lin M K, Belanger H, Lee Y J, et al. FLOWERING LOCUS T protein may act as the long-distance fl origenic signal in the Cucurbits[J].Plant Cell, 2007, 19:1488-1506.
[8]Ramsey S L, Kernodle S P. A method for accelerated trait conversion in plant breeding [J].Theor Apple Genet, 2009,118:1499-1508.
[9]Li C, Zhang K, Zeng X,et al. A cis element within Flowering Locus T mRNA determines its mobility and facilitates traf fi cking of heterologous viral RNA[J]. J Virol,2009, 83, 3540-3548.
[10]Li C, Gu M, Shi N, et al. Mobile FT mRNA contributes to the systemic florigen signalling in floral induction[J]. Sci Rep, 2011,1: 73.
[11]Van der Hoorn R A, Laurent F,Roth R, et al. Agroin fi ltration is a versatile tool that facilitates comparative analyses of Avr9/Cf-9-induced and Avr4/Cf-4-induced necrosis[J].MOL PLANT MICROBE IN, 2000,13 (4): 439-46.
[12]Chapman S, Kavanagh T, Baulcombe D. Potato virus X as a vector for gene expression in plants[J].Plant J, 1992, 2:549-557.
[13]Hendy S, Chen Z C, Barker H, et al. Rapid production of single-chain Fv fragments in plants using a potato virus X episomal vector [J]. J Immunol Methods, 1999, 231: 137-146.
[14]Marusic C, Rizza P, Lattanzi L,et al. Chimeric plant virus particles as immunogens for inducing murine and human immune responses against human immunode fi ciency virus type 1[J]. J Virol, 2001, 75: 8434-8439.
[15]Yamagishi N, Sasaki S, Yamagata K. Promotion of flowering and reduction of a generation time in apple seedlings by ectopical expression of the Arabidopsis thaliana FT gene using the Apple latent spherical virus vector[J]. Plant Mol Biol, 2011, 75: 193-204.
[16]Yamagishi N,Yoshikawa N. Expression of FLOWERING LOCUS T from Arabidopsis thaliana induces precocious flowering in soybean irrespective of maturity group and stem growth habit[J]. Planta, 2011, 233:561-568.
