铜与硝酸反应的实验创新设计
2013-03-16张泽志韩春亮
张泽志,韩春亮
(河南教育学院应用化学重点学科组,河南郑州450046)
河南省普通高中新课程化学学科教学实施指导意见指出,化学实验的过程离不开思维,实验能力理应包含实验中的思维,而不仅仅是动手操作.要重视通过实验提高学生思维的敏捷性、灵活性、深刻性、独创性和批判性,培养学生的创新精神和实践能力.
中学化学教学中铜与硝酸反应及二氧化氮的性质实验是两个重要演示实验.按照教材上常规实验装置实验时可能会造成有害气体泄漏污染环境、生成的无色一氧化氮极易被反应器中的空气氧化成红棕色二氧化氮而影响对一氧化氮颜色的观察、不能连续性反应等缺点.为了达到实验装置简单、实验现象直观明显、操作简便,有利于培养学生绿色化学理念和创新科学思维[1-4],笔者结合实际,对实验进行了一些创新设计.
1 实验仪器及药品
1.1 实验仪器
具塞玻璃管,具塞试管,玻璃注射器,带导管的胶塞,乳胶管,滴管,烧杯,止水夹,等.
1.2 实验药品
铜丝,浓硝酸(67%),蒸馏水,石蕊试液,稀氢氧化钠溶液,冰水混合物,等.
2 实验步骤和现象
2.1 铜与浓硝酸反应及二氧化氮气体的制备
将下端盘成圈状的铜丝放入玻璃管底部,其上端穿过胶塞,按图1组装好仪器,并检查装置的气密性.关闭止水夹b、c,打开止水夹a,通过注射器将试管中浓硝酸抽提进入玻璃管底部,关闭止水夹a,此时铜与浓硝酸迅速反应生成红棕色的气体NO2,发生的反应为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O.待NO2充满玻璃管后,上提铜丝,反应停止.
2.2 二氧化氮与四氧化二氮的可逆反应
用浸冰水布条迅速包住玻璃管冷却,可以观察到管中红棕色气体(NO2)颜色逐渐变淡最后可至无色(N2O4),发生的反应为

移去布条,管中无色气体颜色变深最后至红棕色,反应为
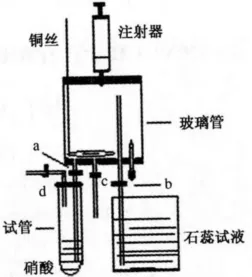
图1 实验装置示意图Fig.1 Schematic diagram of experiment
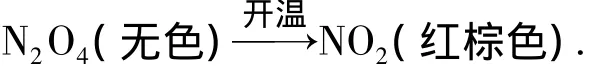
2.3 二氧化氮的溶解及水反应
挤压胶头滴管使水进入玻璃管,红棕色消失,反应为3NO2+H2O=2HNO3+NO.打开止水夹a,石蕊试液喷入形成美丽的红色喷泉.玻璃管内剩有一定体积的无色气体,不溶于水.用注射器向管内注入空气,发现无色气体变红,反应为2NO+O2=2NO2,并迅速消失,管内液面稍微上升.
2.4 铜与稀硝酸反应及一氧化氮气体的制备
通过止水夹c排净玻璃管内的溶液,取下胶头滴管吸入蒸馏水后重新插入原孔.向试管中加入适量蒸馏水稀释浓硝酸,关闭止水夹b,打开止水夹a、d,通过注射器将试管中稀硝酸抽提进入玻璃管底部,关闭止水夹a,将铜丝放回玻璃管底部,此时铜丝上有无色气体NO生成,发生反应为3Cu+8HNO3(稀)=3Cu(NO3)2+ 2NO↑+4H2O.反应一段时间后,挤压胶头滴管让水进入玻璃管,打开止水夹b,未见石蕊试液喷入形成美丽的红色喷泉,说明一氧化氮不溶于水.将空气或氧气由注射器注入玻璃管中,可以看到管内气体迅速由无色变为红棕色,发生反应为2NO+O2=2NO2,并观察到喷泉形成.
2.5 氢氧化钠溶液吸收多余气体
反应完毕后,用注射器抽取氢氧化钠溶液,注入玻璃管中,吸收多余气体防止污染环境,发生反应为

3 讨论
创新实验设计有以下优点:实验装置简单,在同一装置中可连续做多个实验;实验现象明显直观,能很好地观察氮氧化物的颜色,对比性强;实验过程在密闭装置中进行,气体不易扩散到空气中,减少了环境污染,不会对实验人员及观察者造成伤害;提高了药品的利用率,并可以通过抽提铜丝控制反应.
创新实验应注意问题:关于NO2与水反应的问题探究.由于常规难以制得纯净的NO2,采用注射器抽提有利于排尽玻璃管中的空气,从而收得较为纯净的NO2;用冰水冷却玻璃管中红棕色气体(NO2),颜色逐渐变淡最后可至无色(N2O4).由于N2O4的可逆分解,气体颜色可能达不到无色而呈现浅色,冷却效果可能会影响气体颜色的深浅;石蕊试液通过的玻璃导管越细,形成红色喷泉的现象就越明显;玻璃管中液面最终上升的高度受收集气体的温度、室温和杂质成分的影响;实验若将玻璃管抽成真空有利于提高NO2的纯度,但不便于实验操作,这些问题有待于进一步探究.
[1] 教育部.普通高中化学课程标准(实验)[M].北京:人民教育出版社,2003.
[2] 黄健培.二氧化氮与水反应的实验探究[J].化学教育,2005(S1):141-142.
[3] 岳云华.二氧化氮与水的循环吸收反应实验设计[J].教学仪器与实验,2009,25(5):15-16.
[4] 王荣.铜与浓、稀硝酸实验的创新设计[J].新课程,2009(12):222.
