施用根际有益微生物对盆栽紫花苜蓿土壤中微生物区系的影响
2013-03-14石杰
石杰
(黑龙江省科学院大庆分院,黑龙江大庆 163319)
紫花苜蓿(Medicago sativa L.)是一种多年生豆科牧草植物,根状茎发达,枝叶繁茂,能覆盖地面、减少蒸发、保蓄水分,减轻地表冲刷。有资料显示,2~4年生的紫花苜蓿植株每公顷每年可固氮150~450kg,根系腐烂后可增加土壤有机质,改善物理性状,提高土壤肥力。我国北方干旱地区实行粮食作物与紫花苜蓿轮作,更有利于提高粮食产量[1]。
根际促生菌(Plant Growth Promoting Rhizobacteria,简称PGPR)是指自由生活在土壤或附生于植物根际、茎叶的一类可促进植物生长的有益菌类[2,3]。根际有益细菌能够促进植物对矿质营养的吸收和利用,或者产生促进植物生长的代谢物,甚至抑制有害微生物。固氮菌、解磷细菌、解钾细菌是具有促进植物生长的PGPR,是微生物肥料的核心,通过代谢可增加土壤中N、P、K及抗菌素、生长素含量,或促进土壤中一些有效性低的营养性物质的转化,或兼有刺激植物的生长发育进程及防治病虫害作用。
然而,微生物在根圈的定殖很大程度上依赖于作物根的分泌物和溢出物,因而植物会影响到根圈微生物的群落组成和定殖,而它们特定的分泌物又可以作为化学信号分子而同微生物相互作用。一般而言,土壤以其物化特性和存在的土著微生物群体这两种方式来影响接种的微生物的定殖。同时,土壤中存在的土著微生物群体可能已经建立了稳定的互作作用,这种互作作用又可能受到接种微生物添加的影响。已有研究表明,植物根圈土壤施入有益微生物后,可促进或抑制某些微生物的生长,调节微生物区系,改善微生态环境,促进植物生长。研究使用根际促生菌增加退化土壤的微生物活性,改变退化土壤的结构组成,达到改良退化土壤的目的。
1 材料与方法
1.1 试验材料
1.1.1 供试植物
“三得利”为美国引进品种,购买自甘肃省草原总站草业中心(发芽率:85.4%)。
1.1.2 供试菌株
苜蓿根瘤菌菌株91522(Rhizobium meliloti 91522)[4];
巨大芽孢杆菌 (Bacillus megaterium,中国菌保中心菌株号ACCC 10008);
联合固氮菌(Associative-nitrogen-fixing Bacterium)[5];
钾细菌(Bacillus mucilaginosus,胶质芽孢杆菌,西南大学微生物研究中心分离);
纤维素分解菌菌株1306(Cellulose-Degradation Fungi 1306)[6]。
1.1.3 培养基(液)
根瘤菌采用改进的YMA培养基(液),固氮培养基(液),硅酸盐细菌培养基(液),牛肉膏蛋白胨培养基(液),察氏培养基(液),高氏一号培养基。
1.1.4 钙溶液
使用氯化钙溶液配制成5mmol/L。
1.1.5 试验土壤
来源于西南大学水土保持实验室经水土流失模拟试验所获得的土壤,pH7.7,有机质7.27g/kg,全氮0.537g/ kg,全磷0.506mg/kg,全钾20.4g/kg,碱解氮40.3mg/kg,有效磷6.7mg/kg,速效钾93.3mg/kg;细菌2.28 E+05 CFU/ gsoil,真菌4.00 E+02 CFU/gsoil,硅酸盐细菌7.70 E+03 CFU/gsoil,固氮菌2.85 E+03 CFU/gsoil,根瘤菌6.00 E+ 01 CFU/gsoil,放线菌5.90 E+03 CFU/gsoil。
1.2 方法
1.2.1 菌株的准备
取生长于斜面上的苜蓿根瘤菌株91522一支,用5 mL无菌水洗下菌体,取1 mL接种于100 mL中性YMA培养液中,28℃置恒温震荡器中培养约24~26 h,调节其OD600值约为1.0后经4000 rpm 20 min收集菌体,重新悬浮于新鲜YMA液体培养基中,加1%羧甲基纤维素纳溶液作为黏着剂[7],用于拌种。将巨大芽孢杆菌,联合固氮菌,钾细菌,纤维素分解菌菌株1306活化后培养其相应的菌悬液。接种环接种,培养箱培养至各菌悬液活菌体浓度约为106个/mL。根据田间最大持水量,确定各处理的最大施菌量。
1.2.2 紫花苜蓿种子的制备
挑选均匀饱满的健壮的苜蓿种子,于50℃~60℃水中浸泡0.5h,捞出,白天放在阳光下曝晒,夜间转至阴凉处,并加水保持种子湿润,当大部分种子略有膨胀时用根瘤菌拌种。
1.2.3 土壤性状测定方法
全氮:蒸馏法;
碱解氮:扩散法;
全磷和有效磷:钼蓝比色法(660 nm比色);
全钾和有效钾:火焰光度法(6400型火焰光度计);
有机质:重铬酸钾消煮法;
交换性酸:滴定法;
土壤微生物数量:稀释平板法。
1.2.4 盆栽管理
1)苗期施钙:苗期施钙一次,施用5mmol/L CaCl2溶液均匀撒入各个盆栽。
2)栽培管理:取风干土样过3mm筛,每盆精确装入6kg土样,浇透水放置一晚后播种,每盆五穴,每穴播六颗种子。栽培期间浇水、除杂草。待种子均发芽之后按设计方案施入巨大芽孢杆菌、固氮菌、钾细菌菌悬液。每月同一天取样一次,取样后施入相应的新菌悬液,空白处理只浇水。
1.2.5 收后处理
分别于种植紫花苜蓿后的第一个月,第二个月,第三个月和第五个月取土样,测定其化学和生物变化。第五个月收获植株,将进入生殖生长的紫花苜蓿植株剪碎,拌入土中、施用相应水平的纤维素分解菌菌悬液,原位土沤熟两个月,其间定时加水,使土样保持湿润,之后,再次取样进行各个化学和微生物指标的检测。
1.2.6 试验因子设计
采用四因素三水平的L9(34)正交设计法(如表1),四因素分别是施用巨大芽孢杆菌(A)、联合固氮菌(B)、硅酸盐细菌(C)和纤维素分解菌(D),三个水平分别是:水平一是施用该菌株的灭菌的菌悬液15mL、水平二是使用该菌株的活体菌悬液15mL,水平三是使用该菌株的活体菌悬液30mL。共九个处理,重复三次。
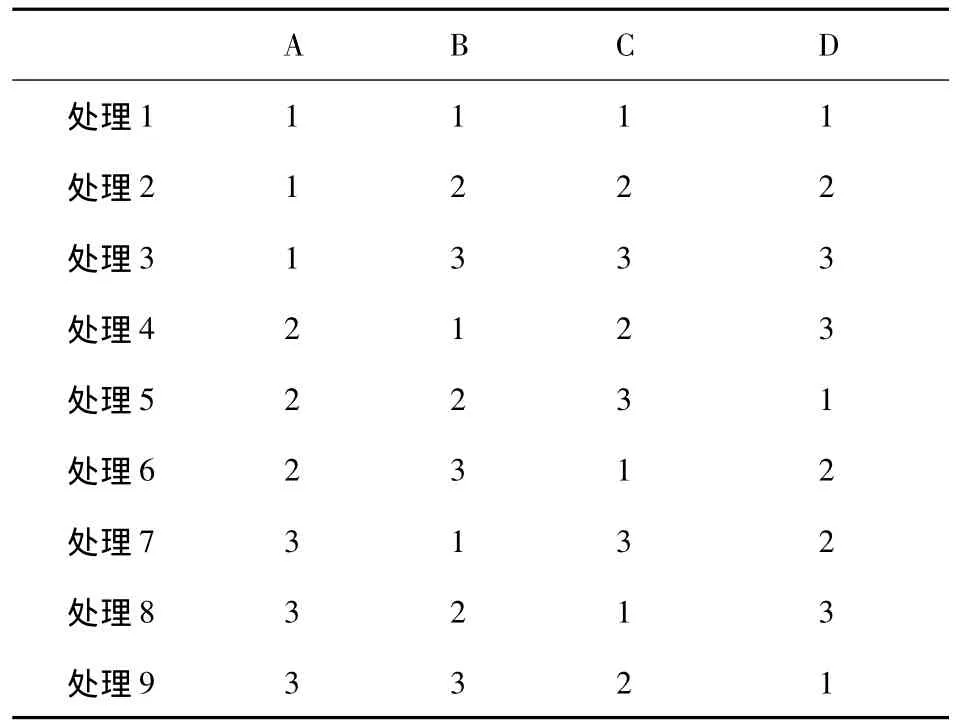
表1 正交设计方案L9(34)Tab.1 Orthogonal design L9(34)
1.2.7 数据处理
利用Excel、DPS统计软件对数据进行统计作图分析,LSD法作多重比较。
2 结果与分析
2.1 施用固氮菌菌悬液对土壤微生物数量的影响
如表2所示,测定的各个微生物数量指标在每个采样期均有稳定增加。第一个月中,施用联合固氮菌菌悬液比不施用对细菌、固氮菌、硅酸盐细菌数量有显著增加的作用,其中施用30mL联合固氮菌的菌悬液对细菌总数的提高影响达到了显著水平(P<0.05),第二个月同样达到了显著水平,且比第一个月的细菌总数也有明显提高,第三个月各个处理的细菌总数基本达到了正常的稳定水平,这说明施用联合固氮菌对退化土壤的细菌总数具有速效提高的作用。施用纤维素分解菌沤熟两个月后施用了联合固氮菌处理的细菌总数还处于两个月前的水平,而不施用联合固氮菌的处理则比沤熟前降低了一个多单位,这说明施用联合固氮菌的菌悬液和灭菌的菌悬液对维持退化土壤的细菌总数的正常水平有重要作用。
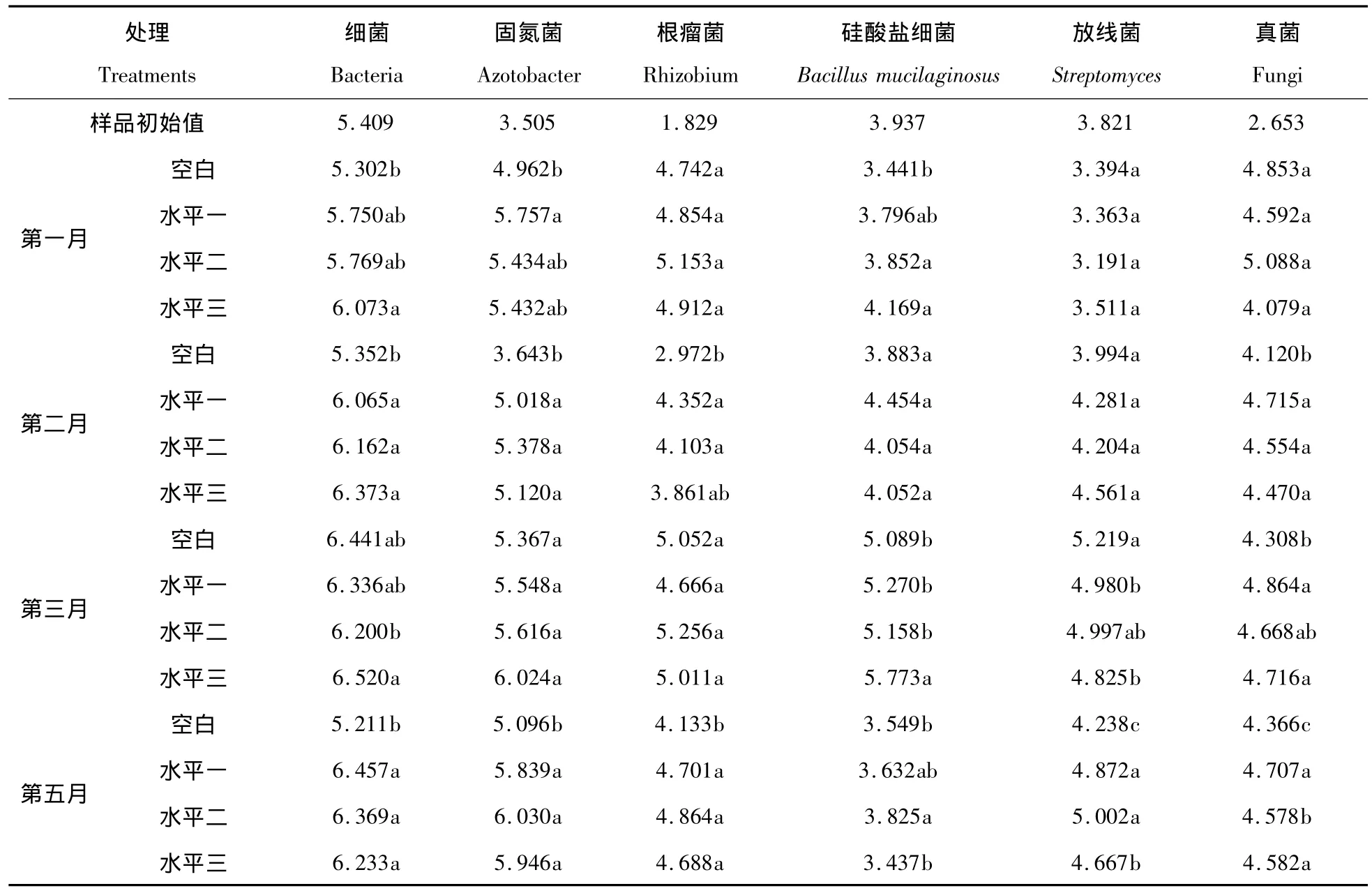
表2 施用固氮菌菌悬液对退化土样微生物数量的影响(logCFU·g-1干土)Tab.2 Effects on the number of microorganism in the degradeted soil after adding Associative-nitrogen-fixing Bacterium(logCFU·g-1dry soil)
2.2 施用巨大芽孢杆菌菌悬液对土壤微生物数量的影响
如表3所示,测定的各个微生物数量指标在每个采样期均有稳定增加。第一个月中,施用30mL巨大芽孢杆菌菌悬液对细菌总数的提高影响达到了显著水平(P<0.05),施用15mL巨大芽孢杆菌菌悬液对固氮菌、根瘤菌、真菌数量的提高影响达到了显著水平,施用灭菌的巨大芽孢杆菌菌悬液比活体菌悬液对提高退化土壤硅酸盐细菌和放线菌的数量更有利。第二个月施用巨大芽孢杆菌菌悬液对各个微生物指标的提高也有显著作用。其中施用30mL巨大芽孢杆菌菌悬液对退化土壤的细菌总数、固氮菌数量、根瘤菌数量的提高达到了显著水平,施用15mL巨大芽孢杆菌菌悬液对退化土壤放线菌、真菌数量的提高达到显著水平。施用灭菌的巨大芽孢杆菌菌悬液对退化土壤的硅酸盐细菌数量的提高有显著作用。第三个月各个处理的微生物指标基本达到了正常的稳定水平,这说明施用巨大芽孢杆菌对退化土壤的微生物指标有速效提高的作用。施用纤维素分解菌沤熟两个月后施用了巨大芽孢杆菌处理的各微生物指标还处于两个月前的水平,而不施用联合固氮菌的处理则比沤熟前有所降低,这说明施用巨大芽孢杆菌的菌悬液和灭菌的菌悬液对维持退化土壤的细菌总数的正常水平有重要作用。退化土壤各处理的硅酸盐数量又降回到原样的水平。
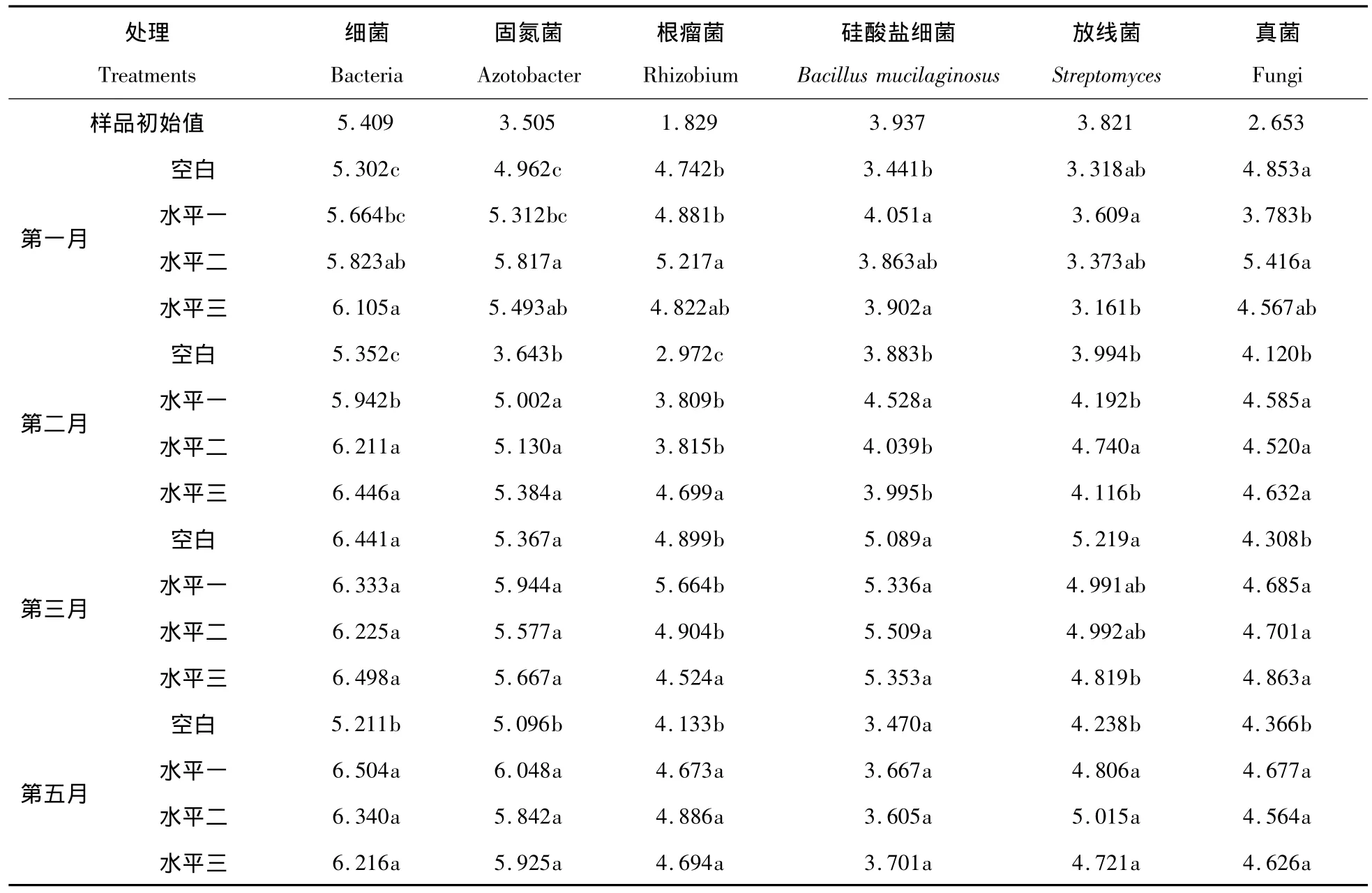
表3 施用巨大芽孢杆菌菌悬液对退化土样微生物数量的影响(logCFU·g-1干土)Tab.3 Effects on the number of microorganism in the degradeted soil after adding Bacillus megaterium(logCFU·g-1dry soil)
2.3 施用硅酸盐细菌菌悬液对土壤微生物数量的影响
如表4所示,测定的各个微生物数量指标在每个采样期均有稳定增加。第一个月中,施用15mL和30mL硅酸盐菌悬液对硅酸盐细菌总数的提高影响达到了显著水平(P<0.05),对其他微生物指标没有显著影响。第二个月施用硅酸盐细菌菌悬液对退化土壤细菌总数、固氮菌数量、根瘤菌数量、真菌数量的提高有显著作用。第三个月各个处理的微生物指标基本达到了正常的稳定水平,这说明施用硅酸盐细菌对退化土壤的微生物指标有速效提高的作用。但放线菌和真菌数量在各处理之间有显著差异。施用纤维素分解菌沤熟两个月后施用了硅酸盐细菌处理的个微生物指标还处于两个月前的水平,而不施用硅酸盐细菌的处理则比沤熟前有所降低,这说明施用硅酸盐细菌的菌悬液和灭菌的菌悬液对维持退化土壤的细菌总数的正常水平有重要作用。退化土壤各处理的硅酸盐数量又降回到原样的水平。
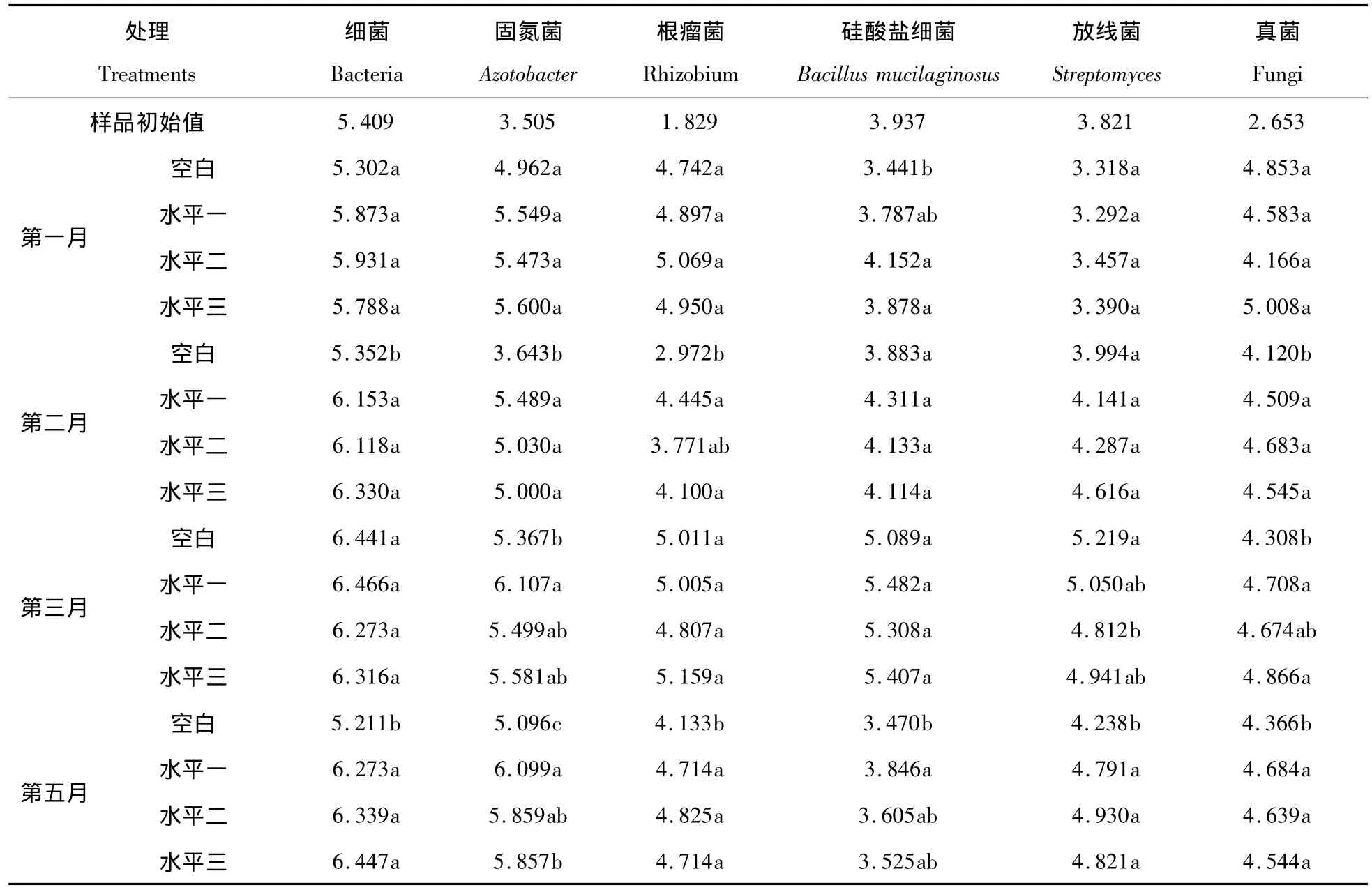
表4 施用硅酸盐细菌菌悬液对退化土样微生物数量的影响(logCFU·g-1干土)Tab.4 Effects on the number of microorganism in the degradeted soil after adding Bacillus mucilaginosus(logCFU·g-1dry soil)
2.4 施用纤维素分解菌菌悬液对土壤微生物数量的影响
使用纤维素分解菌对保持退化土壤的细菌、固氮菌、根瘤菌放线菌和真菌数量有显著作用。对硅酸盐细菌数量没有较大影响(表5)。从表5可以看到固氮菌与纤维素分解菌的相互作用非常显著,施用15mL纤维素分解菌菌悬液对保持固氮菌和根瘤菌数有显著作用。
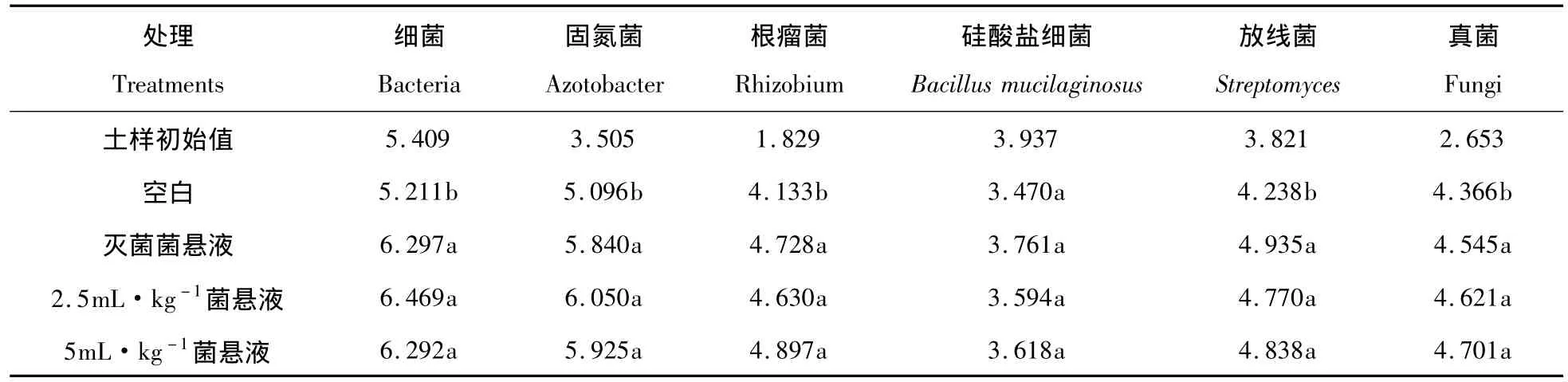
表5 施用纤维素分解菌菌悬液对退化土样微生物数量的影响(logCFU·g-1干土)Tab.5 Effects on the number of microorganism in the degradeted soil after adding Cellulose-Degradation Fungi(logCFU·g-1dry soil)
2.5 各个微生物指标的相关性研究
对退化土样中各个微生物指标的相关关系分析表明(表6),在沙化的退化土壤中固氮菌的数量越多,则细菌总数越多,即细菌总数与固氮菌数量成显著相关关系,也就是说,促进土壤固氮菌数量的提高有利于土壤中细菌总数的提高。退化土壤中根瘤菌数量与固氮菌数量也有显著相关的关系,这与两者的生长基质相似有关。真菌和细菌总数、固氮菌数量和根瘤菌数量有一定的相关,但不显著。
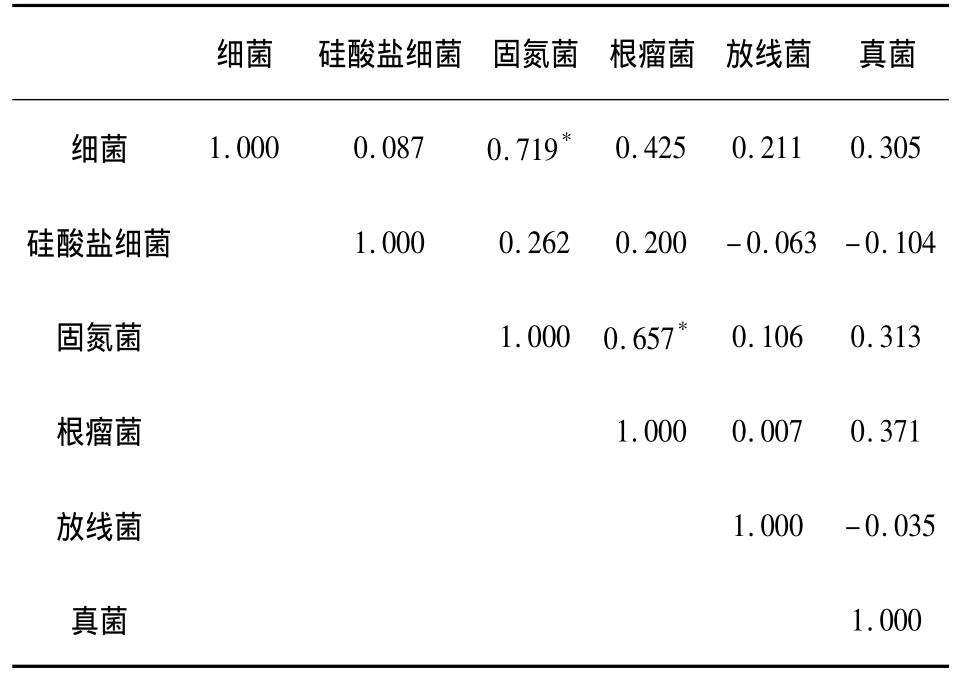
表6 施入根际有益微生物后退化土壤中各微生物指标的相关关系分析r0.05=0.632Tab.6 Analysis of the correlation among microbial indicators in degradation soil by using PGPR r0.05=0.632
2.6 正交设计直观分析
如表7,通过对多个响应指标的饱和正交分析,可以看出:能够提高细菌数量的组合是A1B1C3D2(字母代表因素,数字代表水平),能够提高硅酸盐数量的组合是A3B2C1D1,能够提高固氮菌数量的组合是A1B2C1D2,能够提高根瘤菌数量的组合是A2B2C2D3,能够提高放线菌数量的组合是A2B2C2D1,能够提高真菌数量的组合是A1B1C1D3。其中A1出现了3回,A2出现了2回,A3出现了1回,B1出现了2回,B2出现了4回,C1出现了3回,C2出现了2回,C3出现了1回,D1出现了2回,D2出现了2回,D3出现了2回。因此,本试验的主要因素是B,最好的水平是B2。也就是说使用联合固氮菌对退化土壤各个微生物指标的影响最大,其中施用2.5mL·kg-1的联合固氮菌的处理对修复退化土壤的微生物区系效果最好。
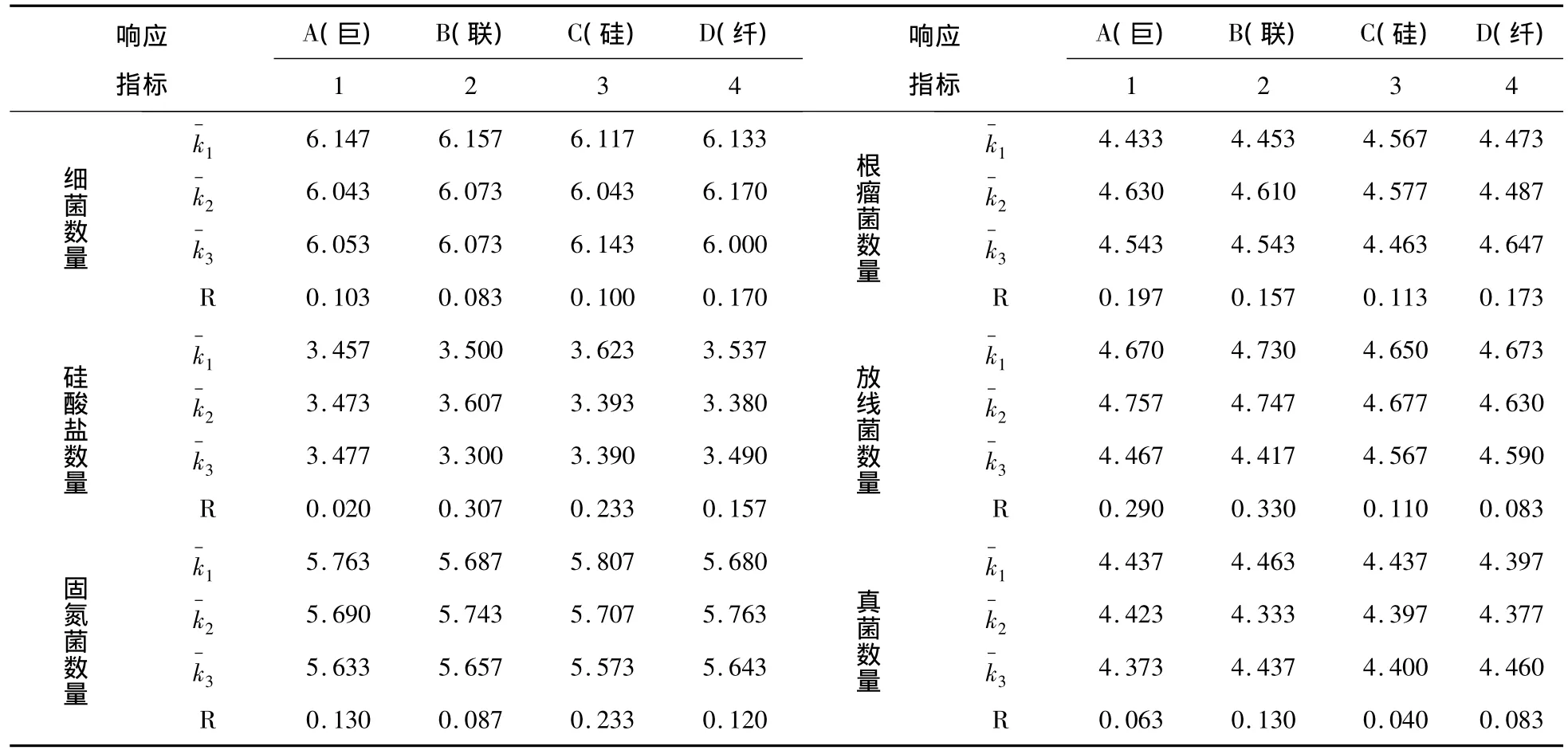
表7 正交设计直观分析Tab.7 Analysis of orthogonal design and intuitive
3 结论与讨论
对于因水土流失而造成养分流失、沙化和微生物活性下降的退化土壤,种植紫花苜蓿和施用根际有益微生物对退化土壤的微生物数量的提高是非常迅速的,且最后会维持一个动态的平衡,不会因再次加入根际有益微生物而再次增加。但施用的根际有益微生物的种类和数量不同对提高微生物数量的速度和维持退化土壤微生态平衡的力度是不同的。一般施用的根际有益微生物越多,退化土壤的细菌总数也增加得越快。施用30mL联合固氮菌菌悬液在第一个月基本上就使退化土壤的细菌数量、固氮菌数量、硅酸盐细菌数量达到最高值。而各个处理的根瘤菌、真菌数量则很快便达到稳定值,甚至不到一个月。各个处理对退化土壤的放线菌数量影响不显著。空白处理的各个微生物指标虽然随后也达到了和其他处理相似的水平,但其形成的微生态系统非常容易被破坏,这从沤熟后退化土壤各个处理的微生物数量的变化可以看出。施用15mL巨大芽孢杆菌菌悬液对退化土壤固氮菌数量、根瘤菌数量、真菌数量的迅速提高有显著作用,施用灭过菌的巨大芽孢杆菌菌悬液对退化土壤的硅酸盐细菌、放线菌数量的提高有显著作用。施用15mL硅酸盐细菌菌悬液可以在第一个月就迅速提高退化土壤的硅酸盐细菌数量。施用硅酸盐细菌对其他微生物指标的作用多体现在种植紫花苜蓿两个月后,一般施用了硅酸盐细菌的都比空白处理好。沤熟后空白处理的微生物指标多变低较多。施入纤维素分解菌对退化土壤的微生物生态的平衡没有严重的破坏作用。
对土样中各个微生物指标的相关关系分析表明,土壤中固氮菌的数量越多,则细菌总数越多,即细菌总数与固氮菌数量成显著相关关系,也就是说,促进土壤固氮菌数量的提高有利于土壤中细菌总数的提高。退化土壤中根瘤菌数量与固氮菌数量也有显著相关的关系,这与两者的生长基质相似有关。真菌和细菌总数、固氮菌数量和根瘤菌数量有一定的相关,但不显著。对本试验的正交设计的直观分析表明,在研究中,施用联合固氮菌对修复退化土样有着更重要的作用。
[1]龙伟文,王平,冯新梅,胡正嘉,李阜棣.PGPR与AMF相互关系的研究进展[J].应用生态学报,2000,11(2):311-314.
[2]MAREN E.VEATCH,StTEVEN E SMITH,GEORGE VANDEMARK.Shoot Biomass Production among Accessions of Medicago truncatula Exposed to NaCl[J].Crop Science,Madison:2004,44 (3):1008-1014.
[3]康俊梅,杨青川,樊奋成.RAPD技术分析不同抗旱性苜蓿品种DNA的多态性[J].生物技术,2005,15(6):37-41.
[4]张琴,龙娟,张磊,等.不同pH值下接种根瘤菌对紫花苜蓿产量和品质的影响[J].草业学报,2006,15(5):59-62.
[5]李春明,张磊.根际联合固氮菌对玉米小麦及红薯的增产效应[J].西南农业大学学报,2003,25(6):506-509.
[6]张超,张磊.真菌产纤维素酶培养基中刚果红转移机理研究[J].微生物通报,2006,33(6):12-16.
[7]高振生,马其东,牛志强,洪绂曾.沿海滩涂地区苜蓿根瘤菌接种方法和效果的研究[J].草地学报,1996,4(4):288-292.
