干旱胁迫条件下菊苣的光合响应
2013-03-14韩永芬罗天琼赵相勇陆瑞霞
韩永芬,罗天琼,李 娟,赵相勇,杨 菲,陆瑞霞
(贵州省草业研究所,贵州 贵阳 550006)
菊苣(Cichoriumintybus)为菊科多年生草本植物,其产草量高、营养丰富、适口性好、刈割后再生能力强,是一种很有开发潜力的高产优质饲草[1-2]。国内对菊苣的生产性能及饲用效果进行了较多的报道,如普那菊苣不同生育期的营养动态与产草量的关系[3],菊苣用于养猪、兔的效果[4-5]等。但对菊苣生理特性,如光合特性、蒸腾特性及环境因子对生理反应的影响等方面的研究不多。Devacht等[6-8]研究了低温胁迫对商业种植菊苣早期活力、光合作用、叶绿素荧光和叶片色素含量的影响。Monti等[9]研究了菊苣净光合速率、气孔导度与水分条件的关系。当前,菊苣航天诱变育种获得成功[10],但对于普那菊苣原始品系和航天诱变筛选出的新品系(PA-82、PA-43)之间在干旱胁迫下的光合及叶绿素荧光特性的差异均无系统研究。笔者曾对筛选出的新品系和对照普那菊苣作了叶片旱生结构及水分胁迫下枯叶率等研究,结果表明,PA-82的抗旱性较强[11]。为了保证菊苣能在易遭遇干旱地区得到合理的推广应用,为草地畜牧业的发展提供优良牧草,有必要对菊苣在干旱胁迫状态下的光合特性等进行研究。
本试验通过观测3个抗旱性不同的菊苣品系在水分胁迫下的光合作用日动态、光合响应以及叶绿素荧光参数特征等,对这3个菊苣品系的光合特性及对干旱胁迫的响应进行研究,旨在揭示菊苣水分与光合生理之间的关系,了解菊苣的抗旱潜力,为菊苣选育和推广提供依据。
1 材料与方法
1.1试验材料 参试材料为航天诱变菊苣新品系PA-82(抗旱性强,与亲本普那菊苣相比叶片变短、薄,叶型为披针形,叶色9级深绿,有绒毛,叶脉绿色)和PA-43(抗旱性差,与亲本普那菊苣比叶片变窄、宽,披针形,叶色8级深绿,有绒毛,叶脉白色)[10-11]和亲本普那菊苣。
1.2试验处理 试验于2010年7月在贵州省草业研究所进行,采用盆栽方式。选用盆口直径40 cm、高30 cm的塑料盆,取田间表土[12](黄壤,土壤含水量19.65%),粉碎混匀,不做灭菌处理,每盆装干土8 kg。每盆播种籽粒饱满、大小均匀、无病虫的种子20粒。待苗齐后间苗,每盆留健苗10株,待苗高20 cm时进行试验。每个材料12盆,设4个水分处理,3次重复,完全随机区组排列。处理A(无水分胁迫),水分含量为田间持水量的75%~80%;处理B(轻度水分胁迫)为田间持水量的65%~70%;处理C(中度水分胁迫)为田间持水量的55%~60%;处理D(重度水分胁迫)为田间持水量的40%~45%[12]。处理前,每盆加水至土壤达到饱和状态,然后使其自然干旱至设定标准,并维持。待各水分梯度形成后开始进行水分胁迫,每盆中的水量用称重法控制,于每天17:00向盆中插孔补充水分,雨天将花盆搬至塑料大棚中,在保持设定的含水量15 d后测定各参数指标[13]。
1.3测定项目和方法
1.3.1光合作用日变化测定 选择晴朗无云的天气,利用Li-6400便携式光合作用测定系统,测定水分处理A(无水分胁迫)状态下菊苣的净光合速率(Pn,μmol·m-2·s-1)、蒸腾速率(Tr,μmol·m-2·s-1)、气孔导度(Cond, mol·m-2·s-1)、胞间CO2浓度(Ci,μmol·mol-1)、光合有效辐射(PAR,μmol·m-2·s-1)、气温(Ta,℃)、相对湿度(RH,%)、大气CO2浓度等。测定时间为08:00-20:00,每隔1 h测定一次,连续测定3 d,于2010年7月进行。测定时选取长势相近的健康植株,选取从植株顶端下数第3片成熟叶片,每次测定5株的平均值[14]。
水分利用效率 (WUE)=Pn/Tr。
气孔限制值(Ls)=(Ca-Ci)/Ca。
式中,Ca是大气中CO2浓度,Ci是胞间CO2浓度,均由光合作用测定系统导出。
1.3.2干旱胁迫条件下菊苣的光合响应 胁迫15 d后,固定光照强度为1 200 μmol·m-2·s-1,CO2浓度400 μmol·mol-1,于09:00-11:00用Li-6400光合作用测定系统测定菊苣的Pn、Tr、Cond、Ci等。
1.3.3叶绿素荧光参数的测定 功能叶片经过24 h的暗适应后,于05:00-09:00利用Li-6400便携式光合测定仪荧光叶室测定各处理荧光参数。如初始荧光(Fo)、最大荧光(Fm)、暗适应下可变荧光(Fv=Fm-Fo)、暗适应下PSⅡ最大光化学效率(Fv/Fm)、光化学猝灭系数(qP)、非光化学猝灭(qN)等。
1.4数据处理 数据统计与分析采用Excel和SPSS软件,图表处理采用 Excel软件。
2 结果与分析
2.1主要气象因子日变化 日出后,PAR逐渐增大,在10:00左右达到一个峰值,在13:00达到全天的最大值,然后呈下降的趋势,变化范围在763.61~1 418.96 μmol·m-2·s-1;Pn从早上开始上升,于13:00达到全天的最大值,然后开始下降,变化范围在26.10~34.46 ℃;RH早晚较高,13:00出现最低值,变化范围在42.93%~59.27%;大气CO2浓度早晨较高,至 10:00左右达到最低值,而后上升,于13:00时达到最高值,然后略有回升,变化范围在383.34~388.43 μmol·mol-1。
2.2菊苣光合特性的日变化规律
2.2.1菊苣叶片的Pn、Tr和Cond日变化规律 3个菊苣品系光合速率日变化趋势都是双峰曲线(图1a)。第一峰值出现时间是10:00,谷值出现时间是12:00,此时出现午休现象,第二峰值出现时间是14:00。PA-82的Pn峰值最大为31.2 μmol·m-2·s-1,PA-43的Pn峰值最小为27.3 μmol·m-2·s-1。3个菊苣品系Tr日变化也呈双峰曲线(图1b),其中第一峰值出现时间是11:00,第二峰值出现时间是16:00。第一、二峰值的出现时间比Pn推迟1~2 h。PA-82的Tr峰值最大为5.6 μmol·m-2·s-1,PA-43的Tr峰值最小为4.5 μmol·m-2·s-1。方差分析表明,菊苣的光合速率、蒸腾速率在品系差异间达显著水平。3个菊苣品系Cond日变化呈双峰曲线(图1c),其中第一峰值出现时间是10:00,第二峰值出现时间是14:00。PA-82的Cond最大,为0.44 mol·m-2·s-1,PA-43的Cond最小,为0.31 mol·m-2·s-1。
2.2.2菊苣叶片Ci和Ls的日变化规律 3个菊苣品系Ci日变化在10:00时降至低谷后在12:00升至一个高峰,其变化与Pn和Cond日变化曲线相反(图1d)。
12:00时,普那菊苣、PA-82、PA-43的Ls降低,Ci增高(图1d、图2),表明其光合速率的降低主要由非气孔限制导致。同时,叶片Pn和Cond均在12:00下降至谷点,表明菊苣的午休是由非气孔因素造成的。
2.2.3菊苣WUE日变化 菊苣WUE与Pn具有相同的规律,均呈双峰曲线(图1c、图3)。WUE于08:00开始上升,10:00达最高,之后下降,到12:00达第一谷值,然后缓慢升高,到14:00达第二峰值,而后下降。WUE以PA-82为最高,说明其节水能力强,耐旱生产力高,表现为最抗旱;普那菊苣居中,说明其节水能力、耐旱生产力一般,抗旱性为中等;PA-43的WUE值最低,说明其节水能力低、耐旱生产力弱,抗旱性差。
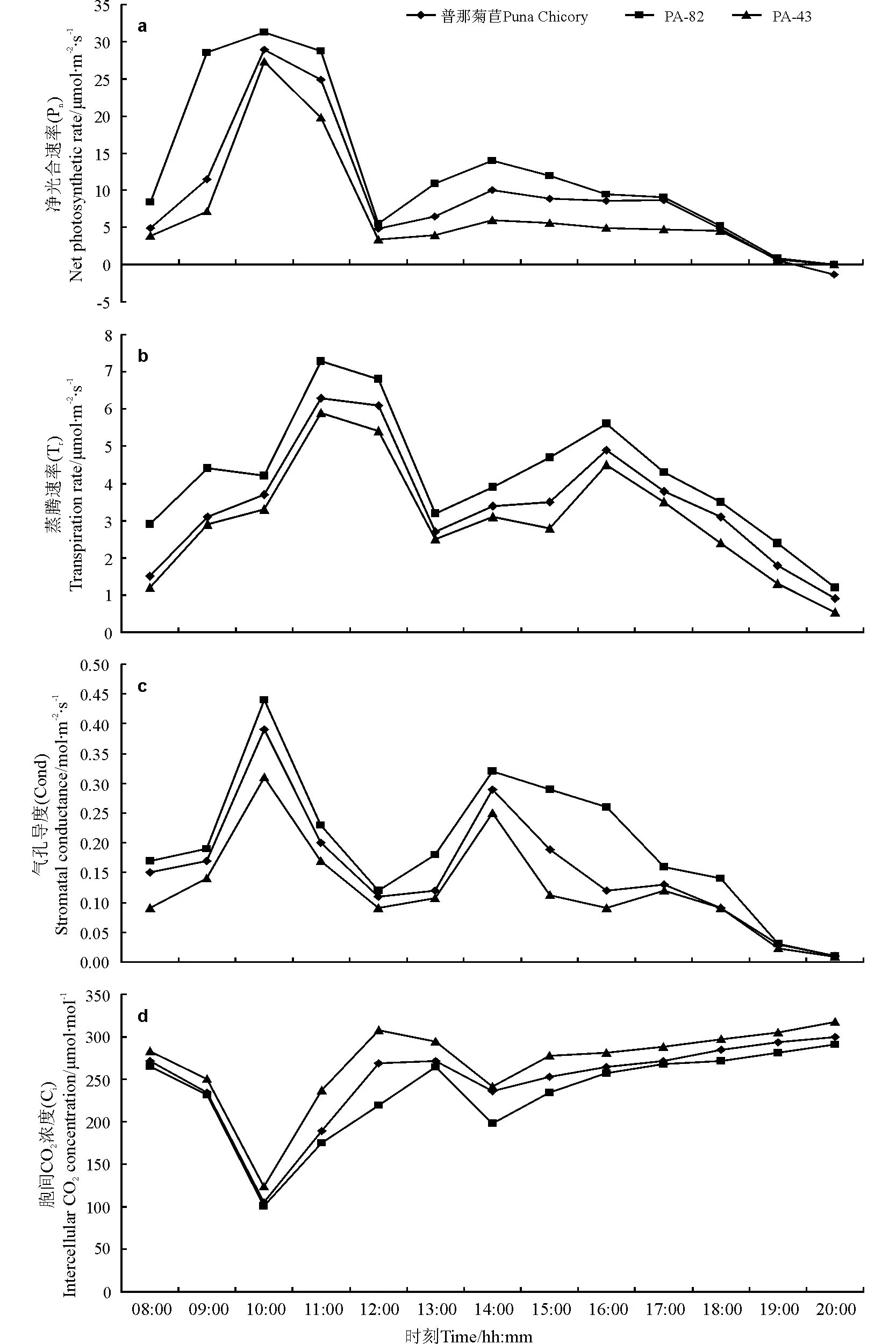
图1 3个菊苣品系叶片净光合速率(a)、蒸腾速率(b)、气孔导度(c)和胞间CO2浓度(d)的日动态Fig.1 Diurnal changes of net photosynthetic rate(a), transpiration rate(b), stromatal conductance(c) and intercellular CO2 concentration(d) in leaves of three chicory lines

图2 3个菊苣品系气孔限制值日动态Fig.2 Diurnal changes of stromatal limitation value in leaves of three chicory lines

图3 3个菊苣品系水分利用效率日变化Fig.3 Diurnal changes of water use efficiency in leaves of three chicory lines
2.3干旱胁迫对菊苣叶片Pn、Tr、Ci和Cond的影响 随着干旱胁迫程度的加剧,菊苣的Pn、Tr、Cond都有较大幅度的下降,以PA-43品系下降速率最快(图4)。其中,在中度和重度水分胁迫下,Pn下降到10 μmol·m-2·s-1以下,分别比对照降低了51%和62% 。另外两个品系下降速率相对缓慢,普那菊苣在轻、中、重度水分胁迫下,下降幅度分别是18%、27%、37%, PA-82在轻、中、重度水分胁迫下,下降幅度分别是11%、19%、25%。方差分析表明,在不同程度水分胁迫下,不同菊苣品系的Pn值间差异显著(P<0.05),说明土壤干旱对菊苣品系的影响很大。PA-43的Tr在轻、中和重度胁迫时分别比对照下降了17%、31%、41%。另外两个品系Tr的下降幅度相对较小,普那菊苣在轻、中、重度胁迫下,分别比对照下降了11%、16%、25%,PA-82在轻、中和重度胁迫下,分别比对照下降了8%、15%、21%。方差分析表明,不同菊苣品系在不同水分胁迫下Tr值差异显著(P<0.05)。PA-43的Cond在轻、中和重度胁迫时分别比对照下降了27%、38%、53%。与对照相比,普那菊苣在轻、中和重度胁迫时分别比对照下降了15%、27%、38%,PA-82在轻、中和重度胁迫时分别比对照下降了14%、25%、34%。方差分析表明,在不同程度的水分胁迫下,菊苣间的Cond值存在显著差异 (P<0.05),说明土壤干旱对菊苣品系的影响很大。
随着干旱胁迫程度的加剧,3个菊苣品系的Ci呈上升趋势。与普那菊苣相比,PA-43的Ci上升最快,在轻、中和重度胁迫时分别比对照上升了13%、25%、35%。另外两个品系的Ci上升幅度相对较小,普那菊苣在轻、中、重度胁迫下,分别比对照上升了11%、22%、27%,PA-82在轻、中、重度胁迫下,分别比对照上升了9%、16%、24%。方差分析表明,不同菊苣品系在不同水分胁迫下Ci值差异显著(P<0.05)(图4)。
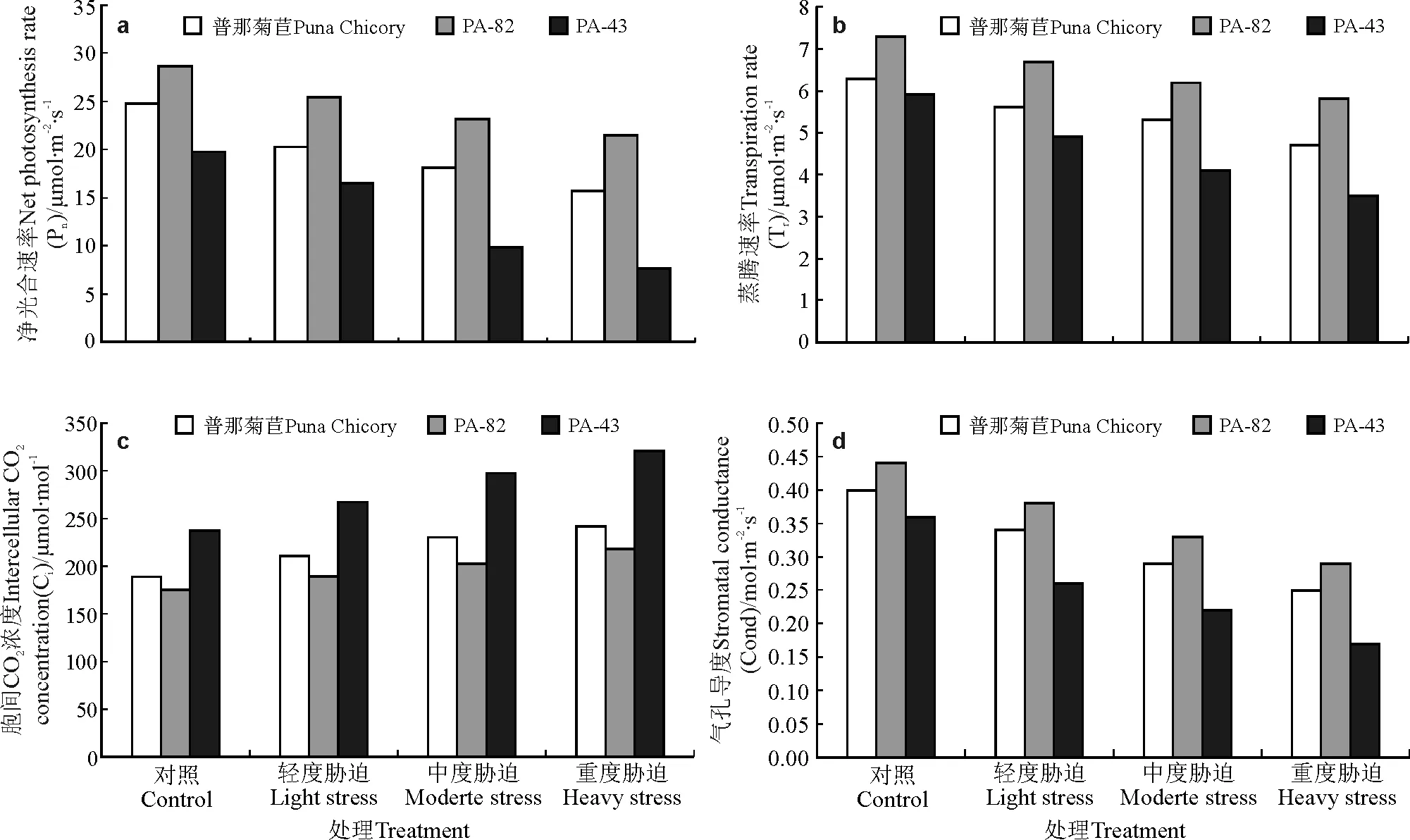
图4 3个菊苣品系不同水分胁迫下的净光合速率(a)、蒸腾速率(b)、胞间CO2浓度(c)和气孔导度(d)Fig.4 Net photosynthesis rate(a), transpiration rate(b), intercellular CO2 concentration(c) and stromatal conductance(d) in leaves of three chicory lines under different drought stresses
2.4干旱胁迫过程中菊苣叶绿素荧光参数的变化
2.4.1Fv/Fm和Fv/Fo的变化 在该试验中,水分胁迫下Fv/Fm与Fv/Fo均显著降低(图5a、图5b),但3个菊苣品系Fv/Fm和Fv/Fo的下降幅度不同。总体上PA-82下降幅度最小,PA-43下降幅度最大,即抗旱性越弱的品种下降幅度越大,其叶绿素荧光受水分胁迫的影响也越大。与对照相比,在轻、中、重度干旱胁迫下3个菊苣Fv/Fm的下降幅度分别为普那菊苣的8.2%、11.3%、16.7%,PA-82的5.6%、9.8%、10.5%,PA-43的10.6%、17.2%、26.3%。与对照相比,在轻、中、重度干旱胁迫下3个菊苣品系Fv/Fo的下降幅度分别为普那菊苣的8.7%、15.2%、28.3%,PA-82的6.7%、11.1%、17.6%,PA-43的17.2%、30.3%、36.8%。上述结果说明,抗旱性差的菊苣品系的PSⅡ的原初光能转化效率在水分胁迫条件下降低程度更高,PSⅡ潜在活性中心受损程度更大。
2.4.2水分胁迫对菊苣叶片qP、qN的影响 水分胁迫下3个菊苣品系qP值总体呈降低趋势(图6)。在轻度水分胁迫下,PA-82和普那菊苣的qP值下降幅度较小,分别为5.8%和6.7%,PA-43的qP值下降了11.3%。中度胁迫下,3个菊苣品系qP值都有较大幅度的降低,与对照相比,PA-43的下降幅度最大,为21.2%,PA-82的降低的幅度最小,为8.9%。重度胁迫下PA-82、普那菊苣、PA-43的qP值继续降低,与各自对照相比分别下降了11.5%、14.6%、25.4%。方差分析表明,普那菊苣在不同处理间qP值差异显著(P<0.05),PA-43方差分析结果与普那菊苣一致。PA-82在中度胁迫和重度胁迫下qP值差异不显著(P>0.05),其它处理间差异显著(P<0.05)。这表明,在干旱胁迫下菊苣叶片的PSⅡ反应中心电子传递活性受到了不同程度的影响,PA-82的qP值下降幅度较低,说明受到的影响最小,普那菊苣受到的影响相对较大,而PA-43受到的影响最大。
植物受到不利环境的胁迫时,qN值升高。本研究表明,菊苣的qN值在干旱条件下会增大,与对照相比,普那菊苣和PA-82的qN值增幅程度大于PA-43(图6b)。说明抗旱性强的菊苣在干旱胁迫时PSⅡ反应中心的开放程度高,电子传递与热耗散能力均较强,从而有效地避免了过剩光能对光合机构的损伤。
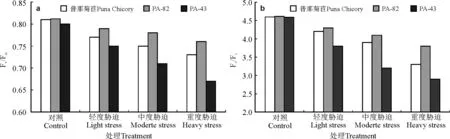
图5 水分胁迫对Fv/Fm(a)和Fv/Fo(b)的影响Fig.5 Effects of water stress on Fv/Fm(a) and Fv/Fo(b)
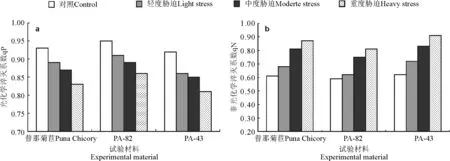
图6 水分胁迫对qP(a)和qN(b)的影响Fig.6 Effects of water stress on coefficient of photochemical quenching(a) and nonphotochemical quenching(b)
3 讨论
Pn的下降可归结为气孔限制和非气孔限制两个方面的原因。根据气孔导度和非气孔因素来测定叶片光合速率的变化方向,Cond下降会直接影响Ci降低和Ls升高;而非气孔因素下降会直接影响Ci升高和Ls降低[13]。本研究发现,午间Pn下降时,Ci升高,Ls下降,表明非气孔限制是3个菊苣品系在12:00时光合作用降低的主要原因,即菊苣的光午休现象主要是由非气孔因素所致。同时,Tr在12:00时也达到一天中的最高值,可能是中午时分菊苣受高温胁迫,蒸腾作用剧烈,导致叶片水势下降,光合磷酸化进程受阻,使得Pn降低。
在相同环境条件下,植物的WUE值越大,说明植物的经济用水能力越高,抵御干旱的能力越强。因此,在选育和栽培优良品种或农作物时,植物的WUE是评价其耐旱能力的重要因素之一[14]。WUE以PA-82为最高,说明其节水能力强,耐旱生产力高,表现为最抗旱;普那菊苣居中,说明其节水能力、耐旱生产力一般,抗旱性为中等;PA-43的WUE值最低,说明其节水能力低、耐旱生产力弱,抗旱性差。
在叶绿素荧光参数中,Fv/Fm代表参数的可变部分,能体现PSⅡ反应中心的开放程度和获取激发能的效率。该比值是反映植物遭受胁迫下的重要指标,任何对PSⅡ效能不利的因素都会降低Fv/Fm。高等植物在正常环境下,其叶片的Fv/Fm为0.80~0.83[12]。本研究表明,3个菊苣品系叶片在水分适当条件下,Fv/Fm在0.808~0.812范围内。随着干旱程度的加剧,3个菊苣品系叶片的Fv/Fm逐渐下降,说明这种胁迫损伤到PSⅡ效能,降低了PSⅡ反应中心的潜在活性能力,同时还抑制植物的光合作用,影响光合机构的电子传递(如QA、QB及PQ库的传递)。3个菊苣品系叶片的Fv/Fm从大到小排列分别是为PA-43>普那菊苣>PA-82,这表明抗旱性强的PA-82品系在干旱胁迫下的PSII效能受损最小,抗旱性弱的PA-43品系的PSII效能受损最大。
非辐射性热耗散采用非光化学猝灭(qN)来检测其消耗程度[15-16]。在干旱条件下,3个菊苣品系的PSⅡ效能明显下降,说明在干旱胁迫条件下,菊苣的光合作用受到抑制,非光化学猝灭系数升高,形成一种自我保护的生理机制,在一定程度上保护了自身的光合机构。与普那菊苣相比,PA-82品系的qN值增大的速率最快,而PA-43品系的qN值增大的速率最慢,充分说明了在同等干旱胁迫下,抗旱性强的PA-82具有很强的电子传递与PSⅡ潜在热耗散能力,而抗旱性弱的PA-43的电子传递与PSⅡ潜在热耗散能力较弱。抗旱性强的品系能够有效地避免胁迫环境损害光合机构,在一定程度上提高其耐旱和抵制不利环境的能力。
不同抗旱等级的菊苣品系光合特性和对干旱胁迫的响应也不同。航天诱变选育的PA-82品系在非干旱胁迫条件下具有最高的Pn、Tr、Cond和WUE值,在干旱胁迫条件下,PA-82的Fv/Fm、Fv/Fo、qP值的下降幅度最小,而qN值的增加幅度最大。因此,从其光合特性和叶绿素荧光参数看, PA-82的抗旱能力优于原始品系普那菊苣和另一航天诱变菊苣品系PA-43。结果与其叶片旱生结构研究的结果[8]相同, 说明普那菊苣的抗旱能力与其叶片的光合特性、光合作用中心荧光特性以及叶片旱生结构有密切关系。
[1] Lambert M G,Clark D A,Litherland A J.Advances in pasture management for animal productivity and health[J].New Zealand Veterinary Journal,2004,52(6):311-319.
[2] Kidane A,Houdijk J G,Athanasiadou S,etal.Effects of maternal protein nutrition and subsequent grazing on chicory (Cichoriumintybus) on parasitism and performance of lambs[J].Journal of Animal Science,2010,88(4):1513-1521.
[3] 韩永芬,刘正书,刘凤霞,等.普那菊苣不同生育期的营养动态与产草量的关系[J].贵州农业科学,2004(5):30-32.
[4] 左相兵,韩永芬,陈培燕,等.普那菊苣饲喂新西兰肉兔的效果研究[J].四川草原,2004(7):14-15.
[5] 左相兵,韩永芬,刘凤霞,等.普那菊苣饲喂三元杂交猪的效果[J].贵州农业科学,2005(2):65-66.
[6] Devacht S,Lootens P,Baert J,etal.Influence of anthocyanin on the photosynthetic performance of industrial chicory under cold stress conditions[J].Communications in Agricultural and Applied Biological Sciences,2009,74(4):121-126.
[7] Devacht S,Lootens P,Carlier L,etal.Effect of cold stress on early vigour,photosynthesis,chlorophyll A fluorescence and pigment content of industrial chicory[J].Communications in Agricultural and Applied Biological Sciences,2007,72(1):165-169.
[8] Devacht S,Lootens P,Roldan-Ruiz I,etal.The use of chlorophyll fluorescence imaging to evaluate the effect of cold stress for industrial chicory[J].Communications in Agricultural and Applied Biological Sciences,2008,73(1):137-140.
[9] Monti A,Amaducci M T,Pritoni G,etal.Growth,fructan yield,and quality of chicory (CichoriumintybusL.) as related to photosynthetic capacity,harvest time,and water regime[J].Journal of Experimental Botany,2005,56(415):1389-1395.
[10] 韩永芬,卢欣石,舒健虹,等.菊苣航天诱变材料的RAPD分析及高产品系筛选[J].草业学报,2011,20(5):133-141.
[11] 韩永芬,卢欣石,孟军江,等.菊苣航天诱变新品系叶片旱生结构的比较研究[J].中国草地学报,2011(1):111-115.
[12] 韩瑞宏.苗期紫花苜蓿(Medicagosativa)对干旱胁迫的适应机制研究[D].北京:北京林业大学,2007.
[13] 鲁如坤.土壤农业化学分析方法[M].北京:中国农业科技出版社,1999.
[14] 冯长松.紫花苜蓿(MedicagosativaL.)秋眠性差异的光合生理机制研究[D].北京:北京林业大学,2009.
[15] Farquhar G D,Sharkey T D.Stomatal conductance and photosynthesis[J].Annual Review of Plant Physiology,1982,33(1):317-345.
[16] Kramer D M,Johnson G,Kiirats O,etal.New fluorescence parameters for the determination of q(a) redox state and excitation energy fluxes[J].Photosynthesis Research,2004,79(2):209-218.
[17] Tezara W,Marín O,Rengifo E,etal.Photosynthesis and photoinhibition in two xerophytic shrubs during drought[J].Photosynthetica,2005,43(1):37-45.
[18] Henriques F S.Leaf chlorophyll fluorescence:background and fundamentals for plant biologists[J].The Botanical Review,2009,75(3):249-270.
