土壤水分胁迫对荻光合生理特性的影响
2013-03-14路雪梅王红庆
李 强,王 非,何 淼,路雪梅,王红庆,石 林
(东北林业大学园林学院,黑龙江 哈尔滨 150040)
光合作用是植物的重要代谢过程。光合能力直接影响植物的生长、生物量和抗逆性,因此,光合作用是衡量植物生长和抗逆性强弱的重要指标[1]。植物的光合作用受光照[2]、温度[3]、水分[3-4]等环境因子的影响。植物光合作用对水分胁迫非常敏感[5-6],水分胁迫会抑制植物叶绿素的合成,气孔的开张和光合作用中光反应的光能转换、电子传递、光合磷酸化和光合作用暗反应等一系列过程,导致光合速率下降[3]。
荻(Miscanthussacchariflorus)是多年生禾本科植物[7],具有较高的光合能力[8]和生物量[9],是一种重要的可再生能源植物[10]。然而,我国西北、东北以及华北地区属于干旱、半干旱或半湿润偏旱地区,水分不足是限制荻在当地生长和推广的一个重要的因素。我国对荻的研究起步较晚,对荻光合特性的研究相对较少,且多集中于对荻的光合日进程和光合速率的季度变化方面[11],而有关土壤水分胁迫对荻光合特性的影响则尚未见报导。本研究采用盆栽土壤控水的方法,通过测量不同土壤水分胁迫下荻光合作用的动态变化,揭示水分胁迫对荻光合特性的影响,以期为荻在我国干旱及半干旱地区的推广应用提供理论基础和科学依据。
1 材料与方法
1.1试验地点 盆栽试验在黑龙江省哈尔滨市东北林业大学园林学院苗圃(125°42′~130°10′ E,44°04′~46°40′ N)进行。该地区属于温带大陆性季风气候,年平均气温3.5~5.5 ℃,>10 ℃年积温2 700 ℃·d,年降水量247~1 081 mm,无霜期150 d左右,极端最高气温37.8 ℃,最低气温-42.6 ℃。
1.2试验材料 荻的种子于2011年10月在哈尔滨市太阳岛风景区采收。盆钵规格为35 cm×20 cm×27 cm(上径×下径×高)。试验所用土壤为黑色泥炭土,经自然风干,研磨,过2 mm筛,按照1∶1∶1质量比将泥炭土、蛭石、珍珠岩混合均匀制成培养基质,按照每盆6.5 kg的标准装入带托盘的花盆中备用。培养基质pH值为8.1,土壤有机质含量为124 g·kg-1,全氮为4.5 g·kg-1,全磷为13.1 g·kg-1,全钾为27.3 g·kg-1。试验前测得基质的最大田间持水量为 33.4%(参照国标GB7835-37测定)。
1.3试验设计与方法 于2012年1月,在东北林业大学园林学院苗圃温室内进行荻的播种繁殖。2012年5月15日,将温室中生长状况良好、发育基本一致的荻幼苗,按照每盆两株的标准移栽入盆钵内进行日常养护,每处理移植20盆,3次重复。待移植的荻恢复正常生长后,于2012年7月5日开始控水。共设4个土壤水分处理,分别为对照(保持土壤水分含量为该土壤最大持水量的80%,下同)、轻度水分胁迫(65%)、中度水分胁迫(45%)以及重度水分胁迫(30%),4种处理的土壤含水量分别是26.7%、21.7%、15%和10%,分别用CK、W1、W2和W2表示。
用称重法控制土壤含水量,在各处理期间于每日17:00时用电子天平称重补水,并架设防雨棚,防止自然降水影响土壤水分含量。当各处理的土壤含水量达到标准20 d后进行相关指标的测定。
1.4叶片气体交换参数的测定 于09:00-11:30期间,分别选取各处理完全展开的功能叶,采用LI-6400XT光合-荧光测定系统(IRGA,LI-COR,Lincoln,USA)测定荻的叶片气体交换参数。测定参数为:叶室环境温度为25 ℃,CO2浓度为400 μmol·mol-1,光量子通量密度(PPFD)为1 500 μmol·m-2·s-1。输出包括净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)和胞间CO2浓度(Ci)等,各处理测量5~6枚叶片。光响应曲线测定时的CO2浓度为400 μmol·mol-1,PPFD梯度分别为1 500、1 000、650、400、200、150、100、50和0 μmol·m-2·s-1,各处理测量3~6枚叶片。
1.5叶片各项生理指标的测定 叶片相对含水量(RWC)采用烘干法测定[12],叶绿素含量采用分光光度法测定[13],比叶重(SLW)采用烘干法测定叶片干质量[13],叶面积采用Photoshop图像法测定[14]。
1.6数据分析 采用SPSS 19.0 软件,根据Farquhar非直角双曲线模型[15]拟合光合特性回归曲线,求得最大光合速率(Pmax)、表观量子效率(AQE)和暗呼吸速率(Rd)。低光强时,净光合速率(Pn)随光强的增加呈线性增加,本研究中根据PPFD为0~200 μmol·m-2·s-1时光合特性的线性拟合方程求得光补偿点(LCP),按净光合速率(Pn)为最大净光合速率的90%时的PPFD求得光饱和点(LSP)[16]。
水分利用效率(WUE)[17]:
WUE=Pn/Tr;
气孔限制值(LS)[17]:
LS=1-Ci/Ca.
对采集的数据用 Excel 2003和SPSS 19.0软件进行统计分析。采用单因素方差分析(One-Way ANOVA)和最小显著性差异法(LSD)检验不同土壤水分处理间的显著性差异。
2 结果与分析
2.1土壤水分胁迫对荻叶片生理指标的影响 随着土壤水分胁迫程度的增加,荻叶片的相对含水量和比叶重均呈下降趋势,且各处理间叶片相对含水量和比叶重均差异显著(P<0.05)(图1)。与对照相比,轻度、中度和重度水分胁迫处理的叶片相对含水率分别下降了8%、26%和51%,比叶重分别下降了10%、27%和49%。

图1 水分胁迫对荻叶片相对含水量(A)和比叶重(B)的影响Fig.1 Effect of soil water stress on RWC(A)and SLW(B) in leaves of M. sacchariflorus
与对照相比较,轻度水分胁迫处理时荻叶片的叶绿素a、叶绿素 b和叶绿素总量下降,叶绿素a含量与对照间差异不显著(P>0.05),叶绿素b含量和叶绿素总量与对照间差异显著(P<0.05)。中度和重度水分胁迫下,荻叶片的叶绿素a、叶绿素 b和叶绿素总量均显著低于对照与轻度水分胁迫(P<0.05)处理,中度和重度水分胁迫处理叶绿素总量与对照相比分别下降了21%和39%(图2)。
2.2水分胁迫对荻叶片气体交换参数的影响 随着土壤水分胁迫程度的加深,荻的Pmax、AQE、Rd、Ci、Gs、Tr和LSP气体交换参数也随之下降,且各处理间差异显著(P<0.05)。Ls随着土壤水分胁迫程度的加深而升高,各处理间差异显著(P<0.05)。荻的WUE随着土壤水分胁迫程度的增加呈现出先上升后下降的趋势,中度水分胁迫处理的WUE最高达到了2.91, 是对照的1.52倍,显著高于其它各组处理(P<0.05),重度水分胁迫处理的水分利用效率虽然低于中度处理,但仍显著高于对照和轻度水分胁迫处理(P<0.05)。荻的LCP随着土壤水分胁迫程度的加深而下降,轻度和中度水分胁迫处理间差异不显著,其余各处理间差异显著(P<0.05)(表1)。

图2 水分胁迫对荻叶片叶绿素含量的影响Fig.2 Effect of water stress on chlorophyll content in leaves of M. sacchariflorus
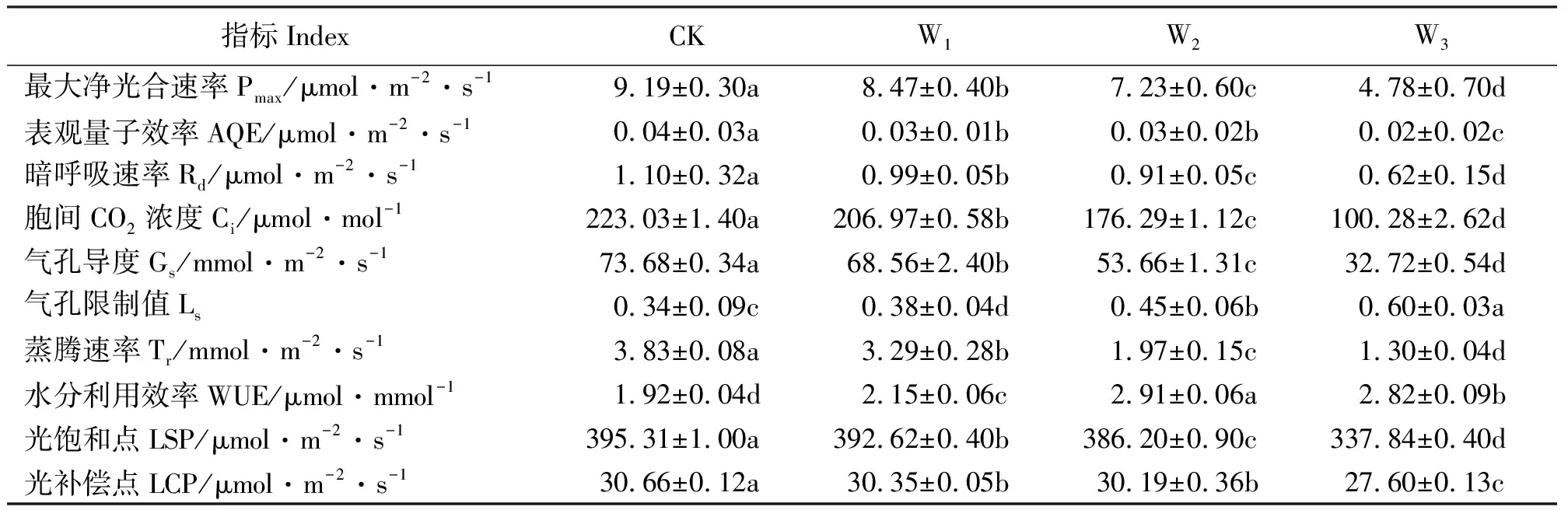
表1 土壤水分胁迫对荻叶片气体交换参数的影响Table 1 Effects of soil water stress on gas exchange parameters of leaves of M.sacchariflorus
3 讨论与结论
3.1土壤水分胁迫对荻叶片相对含水量、叶绿素含量及比叶重的影响 叶片相对含水量是反映植物水分状况的重要指标[18]。本研究表明,水分胁迫造成荻叶片相对含水量下降。这与蒋龙等[19]报道的4种画眉草(Eragrostispilosa)抗旱性比较研究中,叶片相对含水量随着水分胁迫的加剧而下降的结果一致。另外,中度和重度水分胁迫下荻叶片的相对含水量低于70%,这会对荻的光合作用造成破坏性的伤害[20]。
植物叶片叶绿素含量既可以衡量植物抗逆性,又可以直接反映植物光合能力[21]。一般情况下,叶绿素的含量会在水分胁迫过程中下降[19-21],然而也有一些研究证明某些植物在水分胁迫下,其叶绿素会显著增加[22]。本研究中,水分胁迫下荻叶绿素含量下降,这与刘丽平等[23]报道的阶段性干旱使小麦(Triticumaestivum)叶绿素含量下降的结果一致。
比叶重表示的是植物在叶片中积累有机物的量,是衡量植物合成同化物能力的一个重要参数,且与植物的生物量存在一定相关性[24]。陈金平等[25]研究了共生期土壤含水量对冬小麦旗叶比叶重的影响,结果表明,在土壤含水量高的生境下,冬小麦的旗叶具有较高的比叶重。本研究结果与前人的研究结果一致,土壤水分胁迫下荻的比叶重下降,表明水分胁迫降低了荻的同化能力,减少了叶片中有机质的积累。
3.2土壤水分胁迫对荻气体交换参数的影响 本研究表明,水分胁迫对荻的光合作用产生了严重的抑制作用,各项光合参数显著降低。这与张淑勇等[26]报道的,随着土壤含水量的降低,小叶扶芳藤(Euonymusfortunei)叶片的Pmax、AQE、Tr和Rd均显著下降的结果一致。水分胁迫对植物光合作用的抑制主要包括气孔关闭导致的气孔限制和叶肉细胞光合活性下降导致的非气孔限制两个方面[22]。Farquhar和Sharker[27]研究认为,只有Ci和Gs同时下降时,才能证明净光合速率的下降是由气孔限制造成的。本研究中,随着水分胁迫程度的增加,Pmax、Ci和Gs均显著下降,Ls显著上升,说明水分胁迫对荻光合作用的抑制是由气孔限制引起的。
光合作用的AQE是反映植物光能利用效率的重要指标[28],水分是影响植物表观量子效率的重要因素。本研究中,土壤水分胁迫下荻的表现量子效率下降,这与郎莹等[28]报道的在一定范围内,随着土壤含水量的下降,山杏(Prunusarmeniaca)的表观量子效率显著下降的结果一致。
LSP和LCP是植物光合作用的重要生理指标,光饱和点高的植物利用强光的能力较强,而光补偿点低的植物,则可以更有效地利用弱光[29]。许多研究表明[28-29],植物的光饱和点会随着水分胁迫程度的增强而下降,这与本研究的结果一致,在水分胁迫下荻对强光的利用能力下降。本研究中,水分胁迫下荻的LCP下降,荻对弱光的利用能力增强。这与朱艳艳等[30]对不同土壤水分条件下白榆(Ulmuspumila)的光响应研究结果相悖,究其原因,可能是不同植物在水分胁迫中对光的适应能力的差异所造成的。
植物水分利用效率是反映植物环境适应能力的重要指标,也是确定植物体生长发育所需水分供应情况的重要指标之一[31]。本研究表明,不同土壤水分胁迫处理中荻的水分利用效率均高于对照处理,这与严昌荣等[32]报道的在干旱生境中生长的植物具有较高的水分利用效率相一致。这说明荻在受水分胁迫时,能够通过减少蒸腾耗水等生理调节措施来适应土壤水分条件的变化,保持一定的光合作用,从而获得较高的水分利用效率。
综上所述,荻的光合生理特性对水分胁迫十分敏感,荻叶片的气体交换参数与生理指标对水分胁迫的适应能力较差,可塑性较低。因此,在荻的农业生产和园艺栽培过程中应重点注意其水分管理,保证其光合作用的正常进行。
[1] 惠红霞,许兴,李前荣.外源甜菜碱对盐胁迫下枸杞光合功能的改善[J].西北植物学报,2003,23(12):2137-2422.
[2] 张亚杰,冯玉龙.不同光强下生长的两种榕树叶片光合能力与比叶重、氮含量及分配的关系[J].植物生理与分子生物学学报,2004,30(3):269-276.
[3] 柯世省,金则新.水分胁迫和温度对夏蜡梅叶片气体交换和叶绿素荧光特性的影响[J].应用生态学报,2008,19(1):43-49.
[4] Kate M,Johnson G N.Chlorophyll fluorescence——A practical guide[J].Journal of Experimental Botany,2000,51(345):659-668.
[5] Zhou H H,Chen Y N,Li W H,etal.Photosynthesis ofPopuluseuphraticaand its response to elevated CO2concentration in an arid environment[J].Progress in Natural Science,2009,19(4):443-451.
[6] 史胜青,袁玉欣,杨敏生,等.水分胁迫对4 种苗木叶绿素荧光的光化学淬灭和非光化学淬灭的影响[J].林业科学,2004,40(10):168-173.
[7] 陈守良.中国植物志:第10卷[M].北京:科学出版社,2004:26.
[8] Glowaka K.A review of the genetic study of the energy cropMiscanthus[J].Biomass and Bioenergy,2011,35(1):2445-2454.
[9] Lewandowski I,Scurlockb J M O,Lindvall E,etal.The development and current status of perennial rhizomatous grasses as energy crops in the US and Europe[J].Biomass and Bioenergy,2003,25(4):335-361.
[10] Heaton E A,Dohleman F G,Long S P.Meeting US biofuel goals with less land:The potential ofMiscanthus[J].Global Change Biology,2008,14(9):2000-2014.
[11] 邓仲篪,谢成章.荻的光合特性[J].植物生理学通讯,1989(3):33-36.
[12] 郝再彬,苍晶,徐仲.植物生理实验[M].哈尔滨:哈尔滨工业大学出版社,2004:22-25.
[13] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:184-214.
[14] 肖强,叶文景,朱珠,等.利用数码相机和Photoshop软件非破坏性测定叶面积的简便方法[J].生态学杂志,2005,24(6):711-714.
[15] Farquhar G D,Von Caemmerer S,Berry J A.Models of photosynthesis[J].Plant Physiology,2001,125(4):42-45.
[16] Walker D A.Automated measurement of leaf photosynthetic O2evolution as a function of photon flux density[J].Philosophical transactions of the Royal Society London B,1989,323(4):313-326.
[17] 霍宏,王传宽.冠层部位和叶龄对红松光合蒸腾特性的影响[J].应用生态学报,2007,18(6):1181-1186.
[18] 高暝,李毅,种培芳,等.渗透胁迫下不同地理种源白刺的生理响应[J].草业学报,2011,20(3):99-107.
[19] 蒋龙,尹俊,孙振中.4 种画眉草抗旱性比较[J].草业科学,2009,26(11):64-72.
[20] Brodribb T J,Holbrook N M.Stomatal protection against hydraulic failure:A comparison of coexisting ferns and angiosperms[J].New Phytologist,2004,162(3):663-670.
[21] Patel P K,Hemantaranjian A.Salicylic acid induced alteration in dry matter pattiong antioxidant defence system and yield in chickpea (CicerarietinumL.)under drought stress[J].Asian Journal of Crop Science,2012,4(3):386-102.
[22] 崔秀妹,刘信宝,李志华,等.不同水分胁迫下水杨酸对分枝期扁蓿豆生长及光合生理的影响[J].草业科学,2012,21(6):82-93.
[23] 刘丽平,欧阳竹,武兰芳,等.阶段性干旱及复水对小麦光合特性和产量的影响[J].应用生态学报,2012,31(11):2797-2803.
[24] 白岩,张艳,杨潮,等.白术比叶重与地下根茎干重变化规律及相关性研究[J].中药材,2012,32(7):1013-1016.
[25] 陈金平,李利红,周新国,等.共生期土壤水分对麦棉套种冬小麦比叶重、WUE 和产量的影响[J].西北植物学报,2006,26(5):1048-1052.
[26] 张淑勇,周泽福,夏江宝,等.不同土壤水分条件下小叶扶芳藤叶片光合作用对光的响应[J].西北植物学报,2007,27(12):2514-2521.
[27] Farquhar G D,Sharker T D.Stomata conductance and photosynthesis[J].Annual Review of Plant Physiology and Plant Molecular Biology,1982,33(6):172-345.
[28] 郎莹,张光灿,张征坤,等.不同土壤水分下山杏光合作用光响应过程及其模拟[J].生态学报,2011,31(16):4449-4508.
[29] 华建峰,胡李娟,杜丽娟,等.水分条件对中山杉406 光合特性的影响[J].生态环境学报,2011,20(8):1221-1225.
[30] 朱艳艳,贺康宁,唐道锋,等.不同土壤水分条件下白榆的光响应研究[J].水土保持研究,2007,14(2):92-94.
[31] Van Den Boogaard R,Alewijnes D,Veneklaas E J,etal.Growth and water use efficiency of 10Triticumaestivumcultivars at different water availability in relation to allocation of biomass[J].Plant,Cell and Environment,1997,20(2):200-210.
[32] 严昌荣,韩兴国,陈灵芝,等.温带落叶林叶片δ13C 的空间变化和种间变化[J].植物学报,1998,40(8):853-859.
