一株新的具有高效降低烟碱含量的短小芽孢杆菌MK21的分离筛选及作用研究
2013-03-14陈德鑫许家来马志远郭志刚安德荣
陈德鑫,许家来,马志远,郭志刚,安德荣
1中国烟草总公司青州烟草研究所,山东省青岛崂山区科苑经四路11号 266101;2 山东烟草研究院, 山东省济南市新泺大街中段南侧 250101;3西北农林科技大学植物保护学院, 陕西省杨凌示范区邰城路3号 712100;4陕西中烟工业有限责任公司,陕西省宝鸡市宝烟路1号 720001
烟碱占烟草生物碱的95%以上[1-3],烟叶中烟碱的含量与自然条件、农业技术措施、烟草类型、调制方法等因素有关。近几年,利用微生物及其酶降解烟草中的烟碱含量,已成为一种既可降低烟碱含量又能改进卷烟品质的理想方法。目前研究表明,自然界特别是在优质烟叶表面存在多种能有效降解烟碱的微生物,如假单胞杆菌(Pseudomonasputid)、嗜烟碱节杆菌(Arthrobacter nicoti-novorans)、氧化节杆菌(Arthrobacter oxydans)等菌种[6-16]。
本研究从卷烟厂提供的国内外30余种醇化烟叶样品表面分离得到了10株降低烟碱含量细菌,进一步筛选出一株具有降解高浓度烟碱的降解菌,并研究了不同烟碱浓度下该菌株的降解能力和其在降低烟碱含量发酵试验中的降解能力。旨在为降低烟叶烟碱含量、提高烟叶可用性等方面提供依据。
1 材料与方法
1.1 试验材料
烟叶样品:云南昆明07C2F、陕西商洛07B4F-H2、贵州遵义08C3F、湖北十堰B2F、津巴布韦01C07等,均由陕西中烟公司提供。
烟碱(浓度≥98%):C10H14N2由陕西天则生物技术有限责任公司提供。
基础培养基:牛肉膏 3.0 g,蛋白胨 10.0 g,NaCl 5.0 g,琼脂 17.0 g,蒸馏水1000 mL,pH 7.0。
富集培养基:K2HPO413 g,(NH4)SO41 g,KH2PO44 g,酵母粉1 g和烟碱 1 g,蒸馏水1000 mL,pH 7.0。
液体发酵培养基:K2HPO413 g,(NH4)SO41 g,KH2PO44 g,酵母粉 1 g和烟碱 1 g,微量元素溶液10 mL,蒸馏水 1000 mL,pH 7.0。
微量元素:MgSO41 g,MnSO40.4 g,CaCl20.2g,FeSO40.2 g,用0.1 mol/L HCl定容至100 mL。
1.2 降低烟碱含量细菌的分离与筛选
1.2.1 降低烟碱含量细菌的初步分离
将5 g烟叶样品加入到含有100 mL液体富集培养基中,30 ℃和220 r/min下摇床振荡培养48 h,然后取100 μL上清液,加入900 μL无菌水,摇匀,即得10-1倍的菌液;再取100 μL 10-1倍的菌液,加900 μL无菌水,摇匀得10-2倍的菌液,稀释至10-8倍。吸取20 μL 10-7和10-8倍菌液,分别涂布于分离培养基平板,在30 ℃条件下培养48 h 挑选单菌落进一步划线分离,重复操作,直到获得纯化菌株。
1.2.2 降低烟碱含量细菌的复筛
将得到的细菌分别接种到基础培养基上,培养48 h后,用接种环接种于液体发酵培养基中,于30 ℃和220 r/min下摇床培养48 h,取出,采用紫外分光光度法测定烟碱含量。根据培养基中烟碱降低量的多少来复选优良菌株。
1.2.3 发酵液中烟碱的测定
以0.05 mol/L HCl为参比液,检测发酵液在236 nm,259 nm, 282 nm 处的吸光值,吸光值A为∶
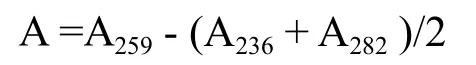
对照烟碱的标准曲线和稀释倍数,计算发酵液中烟碱的含量。
烟碱降解率公式为:

1.2.4 高效降低烟碱含量细菌的鉴定
在平板上观察菌落形态,并在电镜下观察菌株形态,进行生理生化和16SrDNA的鉴定。
1.3 降低烟碱含量细菌的功能研究
1.3.1 降低烟碱含量细菌菌剂的制备
将高效降解烟碱的菌株接种于100 mL的LB液体培养基中,30℃培养24 h,得到种子液。将种子液按10%接种量转接到1L的LB液体培养基中,30℃、150 r/min振荡培养24 h。培养液以4000 r/min离心10 min,用无菌水洗涤沉淀,最后用20 mL无菌水振荡均匀,使用时稀释10倍得到菌剂。
1.3.2 烟丝发酵
将供试烟丝50 g喷施菌剂10 mL,对照喷施等量无菌水。3次重复。然后将处理后的烟丝样品放入25 ℃,60%的恒温恒湿箱内发酵5 d,用于化学成分的测定。
1.3.3 烟样化学成分测定
将处理后的烟样送到陕西中烟工业公司技术中心进行化学成分检测。
1.3.4 感官评吸
将处理组和对照组的烟丝放入恒温恒湿箱中平衡24 h后,制成卷烟,样品和对照均随机编号。由评吸专家评吸。
2 结果与分析
2.1 降低烟碱含量细菌的筛选
经富集分离,筛选出10株降解烟碱效果较好的细菌。观察菌落形态,结果如表1所示。

表1 10株降低烟碱含量细菌的菌落形态
接种不同细菌后的液体培养基中的烟碱含量出现不同程度的变化,经过分析得到降解率,如表2。
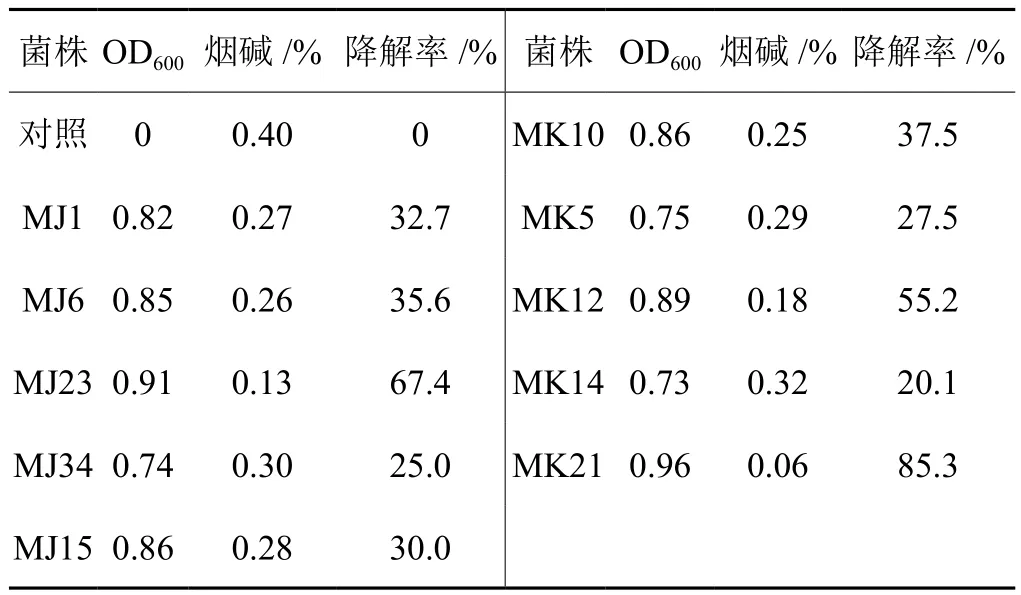
表2 液体培养基中不同细菌对烟碱的降解率
对烟碱降解效果最好的菌株MK21进行烟碱初始浓度2 mL/L的液体培养基发酵试验,对其烟碱含量变化进行分析:发现随着时间的增长,发酵液中的烟碱含量在下降,发酵时间达到46 h后,烟碱含量降低率超过了90%。结果如图1。
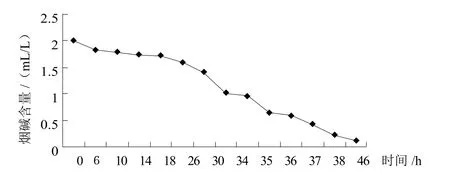
图1 MK21降低烟碱含量发酵试验
2.2 高效降低烟碱含量菌剂喷施烟丝的发酵实验
经过降低烟碱含量菌剂处理的各类烟样的化学成分发生了明显变化,总糖、还原糖和钾含量有所增加,烟碱和氯的含量明显降低,如表3。
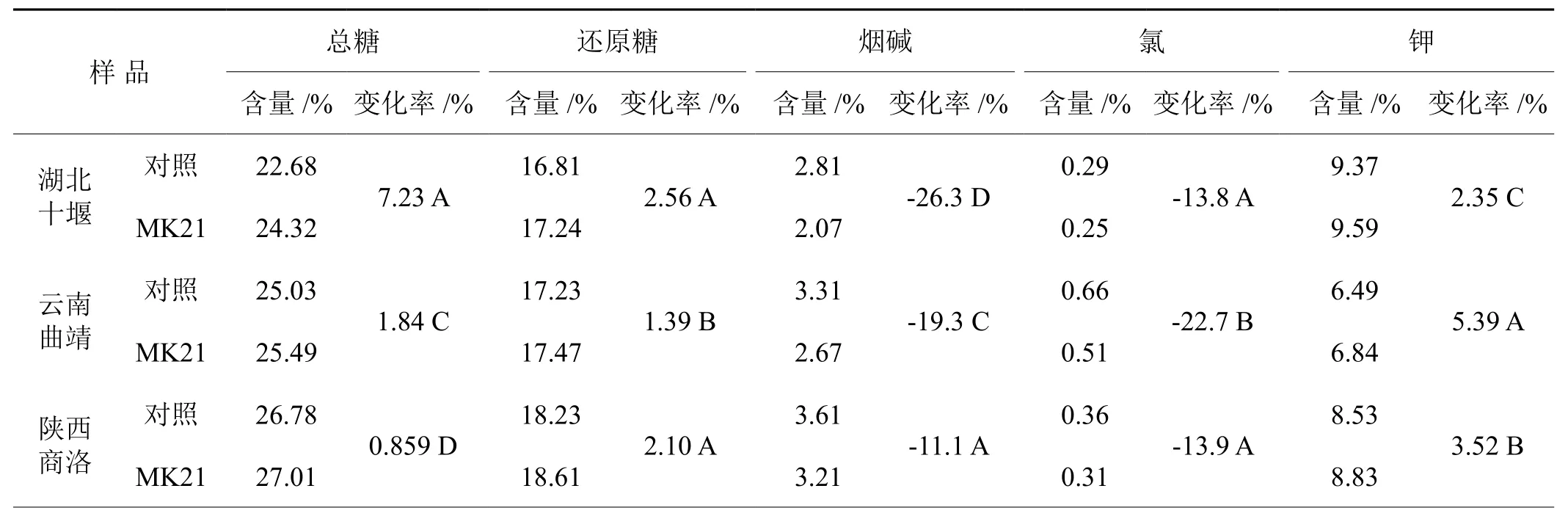
表3 菌剂对烟样化学成分含量的影响

(续表3)
2.3 烟样的感官评吸
将菌剂MK21的处理组和对照组的烟样制成卷烟,供卷烟专业评吸人员进行评吸。评吸结果表明经过菌剂MK21处理的烟样,具有明显提高香气,降低刺激性、掩盖杂气和改善口感的效果。如表4。

表4 菌剂对感官评吸的影响
2.4 高效降低烟碱含量菌株MK21的鉴定
2.4.1 生理生化特性
通过群体菌落观察,该菌落特征均为不规则型,边缘不整齐透明,为淡灰色,在液体中无菌膜,菌株浑浊、无沉淀。降低烟碱含量细菌MK21生理生化特性鉴定结果见表5。
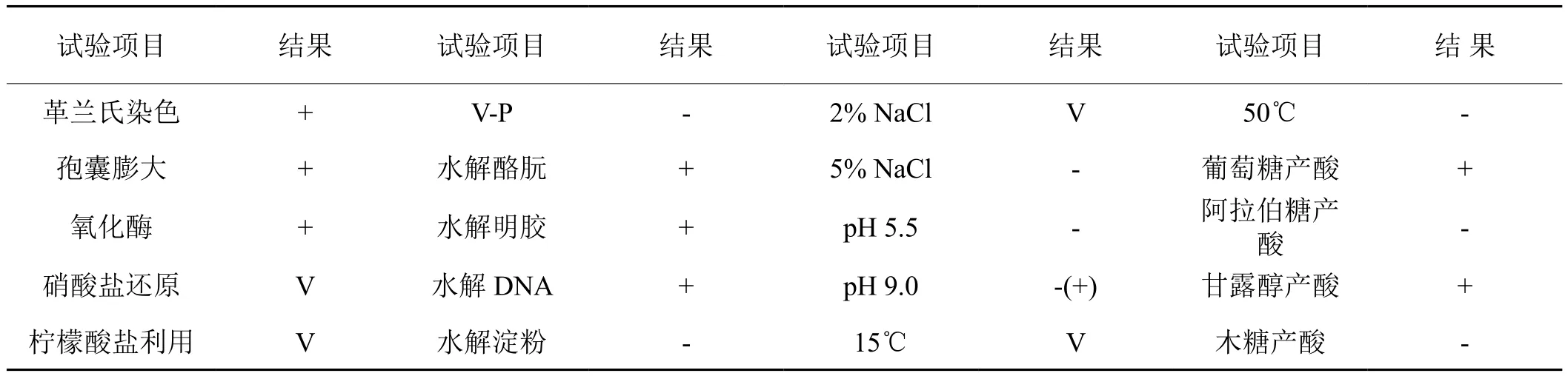
表5 菌株MK21的生理生化特征
将以上试验结果与《常用细菌系统鉴定手册》上有关细菌的描述比较,结果表明菌株MK21的生理生化特性与短芽孢杆菌属(Brevibacilles Shida)的特性基本一致,因此,降低烟碱含量细菌MK21初步鉴定结果为短芽孢杆菌属。
2.4.2 16S rDNA鉴定

图2 透射电镜和扫描电镜下MK21菌落形态
利用Blast在GenBank数据库中进行同源性检索,菌株MK21的16S rDNA序列与短短芽孢杆菌具有较高的同源性(>99.7%),并结合形态和生理生化特征,可确定该降低烟碱含量细菌为短小芽孢杆菌。
3 结论与讨论
本研究通过选用特殊的选择性培养基,即烟碱作为微生物生长所需的唯一的碳源和氮源,从醇化烟叶表面分离筛选到一株高效降解烟碱的细菌,经过初步鉴定为短小芽孢杆菌,命名为BrevibacillesShida MK21。将菌株制成菌剂后结合生物降解试验,处理后的烟样烟碱、氯含量较对照烟样有所降低,且处理后的烟叶香气质改善,香气量增加,烟叶内固有的刺激性和杂气都有所降低。因此,喷施菌剂MK21对烟叶的品质有明显的改善。
目前国内外报道的有降解烟碱功效的微生物主要有:恶臭假单胞菌(Pseudananas putida)、氧化节杆菌(Arthrobacter axidans)、纤维单胞菌(Cellulanonas sp)、嗜烟碱节杆菌(Arthrobacter nicoti-novorans)等,而本研究中获得的MK21尚未在国内外报道中出现类似降解烟碱的微生物。
在烟叶发酵过程中,微生物发挥着重要的作用。目前的研究表明,在烟叶发酵过程中,微生物的生长代谢所产生的许多次生代谢产物对烟叶的化学成分的变化起着催化作用,促进大分子化合物转化和增香物质的产生[17-20]。本实验中的短小芽孢杆菌MK21对烟叶中的烟碱有明显的降低作用,但其在发酵过程中是否会增加烟叶中的增香物质需要进一步的试验验证。与此同时,微生物降解烟碱提高香气,改善烟叶品质是多种因素共同作用的结果,其机理较为复杂,需要进一步深入的研究。
[1]王瑞新.烟草化学[M].北京∶中国农业出版社,2003∶65-84.
[2]周冀衡,朱小平,王彦亭,等.烟草生理与生物化学[M].合肥∶中国科学技术大学出版社,1996∶89-124.
[3]徐宜民,王树声,赖禄祥,等.烟草生物碱的研究现状[J].中国烟草科学,2003(2)∶12-16.
[4]夏振远,雷丽萍,吴玉萍,等.降低烟碱含量细菌-烟草节杆菌K9的分离及鉴定[J].中国烟草科学,2006(2)∶1-4.
[5]袁勇军,陆兆新,黄丽金,等.烟碱降解细菌的分离、鉴定及其降解性能的初步研究[J].微生物学,2005,45(2)∶181-184.
[6]Wang S N, Xu P, Tang H Z, et al. Biodegradation and detoxification of nicotine in tobacco solid waste by a Pseudomonas sp [J]. Biotechnology Letters, 2004,26∶ 1493-1496.
[7]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京∶科学出版社,2001.
[8]王广山,陈卫华,薛超群,等.烟碱形成的相关因素分析及降低烟碱技术措施[J].烟草科技,2001,(2)∶38-42.
[9]李梅云,雷丽萍,郭荣君,等.微生物对烤烟叶片烟碱含量的影响[J].中国农学通报,2006,22(9)∶94-96.
[10]雷丽萍,夏振远,郭荣君,等.降低烟碱含量细菌室内发酵条件研究初报[J].西南农业学报,2006,19(4)∶760-763.
[11]李梅云.烟碱的微生物降解研究进展[J].微生物学志 ,2005,26(3)∶94-97.
[12]李超,史宏志,刘国顺.烟草烟碱转化及生物碱优化研究进展[J].河南农业科学,2007(6)∶14-17.
[13]Sponza, Delia Teresa. Toxicity studies in a tobacco industry biological treatment plant [J]. Water, Air, and Soil Pollution ,2002,134(1/2/3/4)∶137- 164.
[14]闫克玉,王建民,屈剑波,等.河南烤烟评吸质量与主要理化指标的相关分析[J].烟草科技,2001(1)∶5-9.
[15]马林,武怡,曾晓鹰,等.降解烟碱微生物的筛选及其酶在烟草中的应用[J].烟草科技,2005(9)∶6-8,19.
[16]Meher K K, Panchwagh A M, Rangrass S,et al. Biomethanation of tobacco waste[J]. Environmental Pollution, 1995, 90(2)∶199-202.
[17]周谨,李雪梅,许传坤,等.利用微生物发酵改良烤烟碎片品质的研究[J].烟草科技,2002(6)∶64-67.
[18]邓小华,周冀衡,陈新联,等.烟叶质量评价指标间的相关性研究[J].中国烟草学报,2008,14(2)∶1-8.
[19]Deborah A Rathbone , Neil C Bruce. Microbial transformation of alkaloids [J]. Ecology and industry microbiology,2002(5)∶274-281.
[20]王书宁,杜毅,陈洪,等.微生物代谢尼古丁研究进展[J].中国生物工程杂志,2004(7)∶51.
