等离子体/蛋白酶联合整理对羊毛防缩性能的影响
2013-03-10余雪满李清政
余雪满,李清政
(1.浙江工业职业技术学院,浙江 绍兴 312000;2.浙江省现代纺织工业研究院,浙江 绍兴 312081)
羊毛织物作为高档服装面料,以其柔和的光泽和优越的手感赢得人们的喜爱。由于羊毛鳞片的存在,毛织物在洗涤时产生收缩,影响毛织物的服用性能,因此对毛织物进行防毡缩整理有着重要意义。
目前,羊毛防毡缩整理中,氯化/树脂法已相当成熟,可以达到很好的防毡缩效果,但此工艺会产生大量的可吸附有机卤化物类,严重污染环境,因此,绿色防缩方法,如蛋白酶、壳聚糖、等离子体等防缩方法成为羊毛防缩方法讨论的热点。但是单独使用酶处理羊毛,作用很小[1]。而壳聚糖防缩整理的耐久性不理想。等离子体整理可以直接利用空气作介质降低成本,是一种符合环保要求的新工艺[2-3]。等离子体技术还可使羊毛纤维更易接受后续化学药剂或生物酶的作用,改变羊毛的毡缩性能[4-6]。虽然单独的低温等离子体方式即可达到防毡缩的效果,但所用介质通常为氧气、氮气或氩气,成本高,并且处理后织物发黄,手感变硬。本文采用等离子体预处理与蛋白酶相结合的方法对羊毛进行处理,以研究防缩整理对羊毛毡缩性和断裂强力的影响。
1 实验部分
1.1 材料和仪器
纯毛白坯布(经纬纱线密度均为71 tex),蛋白酶 Savinase 4.0T,冰乙酸,渗透剂JFC,硅酸钠等。
HD-IB型辉光放电低温冷等离子体改性设备(常州世泰),YG089A型全自动缩水率洗衣机(常州第二纺织仪器厂),YG026B型电子织物强力仪(常州第二纺织仪器厂),JSM-6700型场发射扫描电镜仪(日本电子株子协会),Nexus470型傅里叶变换红外光谱仪,XRD-7000型X-射线衍射仪(日本理学公司)。
1.2 实验方法
1.2.1 低温等离子体(LTP)处理
功率为100W,压强为25 Pa,所用介质为空气。
1.2.2 蛋白酶整理
整理工艺:蛋白酶用量为3%(o.w.f),pH=8.0,温度 T为50℃,浴比为1∶30,处理时间为40min。
酶失活处理:用 pH=4,浴比为1∶50,80℃热水失活10min。
1.3 性能测试
1.3.1 缩水率
洗涤条件:采用质量浓度为4 g/L的洗衣粉,质量浓度为0.5 g/L的中性皂片,浴比为1∶40,温度为40℃,洗涤时间为3 h。洗后脱水烘干,吸湿平衡24 h后,按式(1)[7]计算面积毡缩率。

1.3.2 减量率
试样在干燥箱中105℃烘至恒重,用4位数天平精确称量,按式(2)[7]计算减量率。

1.3.3 强力损失
采用扯边纱条样法,试样规格为5cm×20cm,做5次求平均值。按式(3)[8]计算强力损失。

1.3.4 扫描电镜观察
处理前后的羊毛织物在真空喷金后,用扫描电镜拍摄织物的表面形态。
1.3.5 羊毛织物的红外光谱测试
所有红外测试均在Nexus470傅里叶变换红外光谱仪上完成。试样规格为32 mm×20mm,扫描范围为4000~400cm-1,扫描次数为200,分辨率为4 cm-1,扫描速度为1.8988 cm/s。
1.3.6 羊毛织物X射线衍射测试
羊毛织物防毡缩处理前后的试样在XRD-7000型X-射线衍射仪上测试。扫描速度为10(°)/min,扫面范围2θ为5°~50°,X 光管电压为 40kV,管电流为40mA。X射线为经过 Ni片滤光单色化的 CuKa射线,波长为15.4056 nm。
2 结果与讨论
2.1 LTP预处理工艺的确定
在LTP预处理之前,先将织物在50%的乙醇中浸渍1 h以去除加工残余物,在空气中干燥,然后在等离子体发生器中处理羊毛织物。
本文在气体压强和功率一定的情况下,考察了不同处理时间对结果的影响。整理工艺为:气体压强25 Pa、功率100W,处理时间分别为1、3、5、8、10min,结果如表1、2 所示。
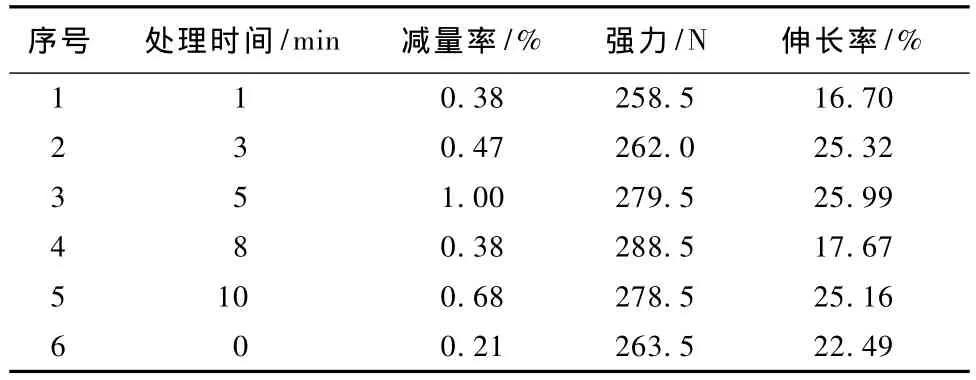
表1 LTP不同处理时间对羊毛拉伸性能的影响Tab.1 Effect of treatment time of LTP on tensile properties of wool fabric
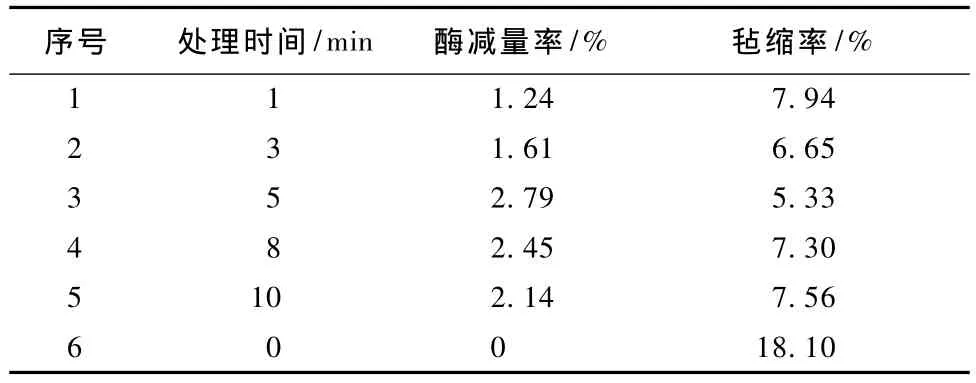
表2 LTP不同处理时间对后续酶处理毡缩性的影响Tab.2 Effect of treatment time of LTP on shrinkage of wool fabric subsequently finished with protease
由表1可看出,随着等离子体处理时间的延长其强力经历了下降、上升、下降的过程。首先在前3 min,羊毛纤维表层鳞片被部分剥除,强力受损,随着时间延长,在5 min左右,纤维因表面刻蚀而变得粗糙,纤维间抱合力增大,增加了织物的强力。如果继续增加处理时间,由于粒子的过度轰击,造成羊毛纤维表面的微观粗糙度下降,从而纤维抱合力下降,因而强力又出现下降趋势。
由表2可知,在同样的蛋白酶处理条件下,随着处理时间的延长,织物的减量率经历了先下降后上升的过程。当处理时间为5 min时,其强力没有损失,毡缩率最小。
羊毛织物的减量率和酶处理后织物的减量率随等离子体预处理时间的延长出现先增加后减小的现象,与强力的变化规律相符。
由强力和毡缩率2项指标可确定等离子体处理工艺:气体压强为25 Pa、功率为100W,处理时间为5 min。
2.2 LTP/蛋白酶联合整理
LTP预处理工艺:气体压强为25 Pa,功率为100W,处理时间为5 min;介质为空气。
Savinase蛋白酶处理工艺:用量为3%(o.w.f),用碳酸钠调节 pH值至 8,温度为50℃,浴比为1∶30,处理 40min。
酶失活处理:用 pH=4,浴比为1∶50,80℃热水失活10min。结果如表3所示。
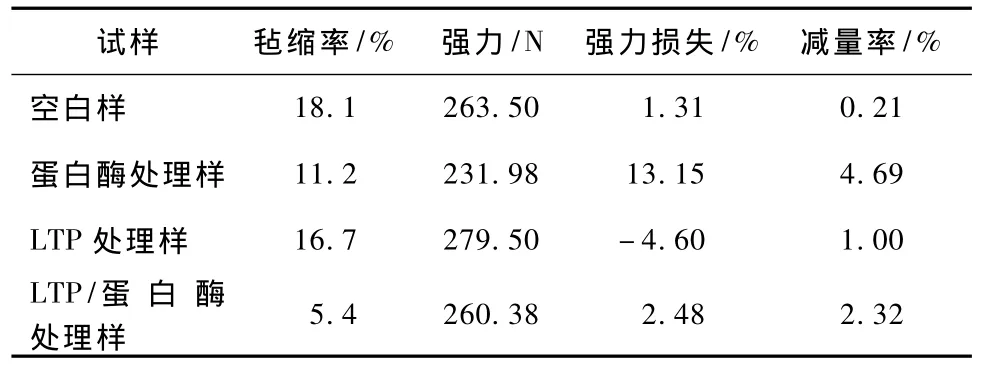
表3 LTP/蛋白酶联合整理结果Tab.3 Result of LTP/protease ombined finishing
由表3可知,与空白浴处理相比,只经蛋白酶处理虽然强力损失很大,但羊毛毡缩率下降不大,因为受羊毛鳞片层结构的影响,蛋白酶很难进入纤维内部,而且难以分解鳞片表层以及高硫蛋白,因此蛋白酶防缩处理前必须要对羊毛的鳞片结构进行改性。只经LTP处理的羊毛虽然强力有所提高,但对防毡缩性能改善不大。
经LTP预处理再用蛋白酶处理,其防毡缩性能得以提高,并且强力损伤只有2.48%。原因在于离子体的轰击作用导致鳞片层胱氨酸中部分二硫键断裂并使鳞片软化和降解,从而增大了外角质层的可及性,故蛋白酶比较容易扩散和催化水解鳞片的外角质层。利用低温等离子体对羊毛表面进行均匀刻蚀,也增加了蛋白酶在羊毛鳞片表层的吸附量和均匀水解作用。此外在蛋白酶处理前,先用等离子体处理使羊毛纤维表面产生刻蚀作用,导致纤维间摩擦抱合力增加,拉伸时不易滑脱,所以强力能够有所保留。
2.3 羊毛表面特征分析
用扫描电镜对整理前后羊毛的表面特征进行分析,LTP/蛋白酶联合整理后的扫描电镜照片如图1所示。

图1 整理前后羊毛的电镜照片(×1000)Fig.1 SEM images of wool fabric before and after treatment(×1000).(a)Original wool;(b)Treated with protease;(c)Treated with LTP;(d)Treated with LTP/protease
从图1(a)可看出,未经处理的羊毛鳞片结构紧密,棱角分明,尖角突出,鳞片重叠覆盖在羊毛毛干的外部,形成阶梯结构,从而使羊毛在溶胀后相互摩擦缠结而出现毡缩现象。单独使用savinase蛋白酶处理后(见图1(b)),鳞片的棱角变得圆滑。从图1(c)可看出,经LTP处理后,鳞片边缘有少许损伤,刻蚀作用明显,鳞片上出现碎片并有凸凹不平的凹槽,这为蛋白酶对鳞片的攻击提供了条件。从图1(d)可看出,经LTP/蛋白酶处理后,纤维表面不像未整理时鳞片重叠覆盖在羊毛毛干的外部,形成阶梯结构,鳞片清晰,可见边缘完整,而是鳞片明显出现被打碎的现象,说明LTP预处理后蛋白酶主要作用于鳞片层,从而保留了羊毛的力学性能。
2.4 红外光谱分析
羊毛纤维典型的吸收谱带有N—H伸缩振动谱带、酰胺Ⅰ谱带、酰胺Ⅱ谱带和酰胺Ⅲ谱带,其中2964 cm-1附近有—CH3非对称伸缩振动,2935cm-1附近有—CH2非对称伸缩振动,2877 cm-1附近有—CH3对称伸缩振动,2853cm-1附近有—CH2对称伸缩振动。整理前后羊毛的红外光谱见图2。
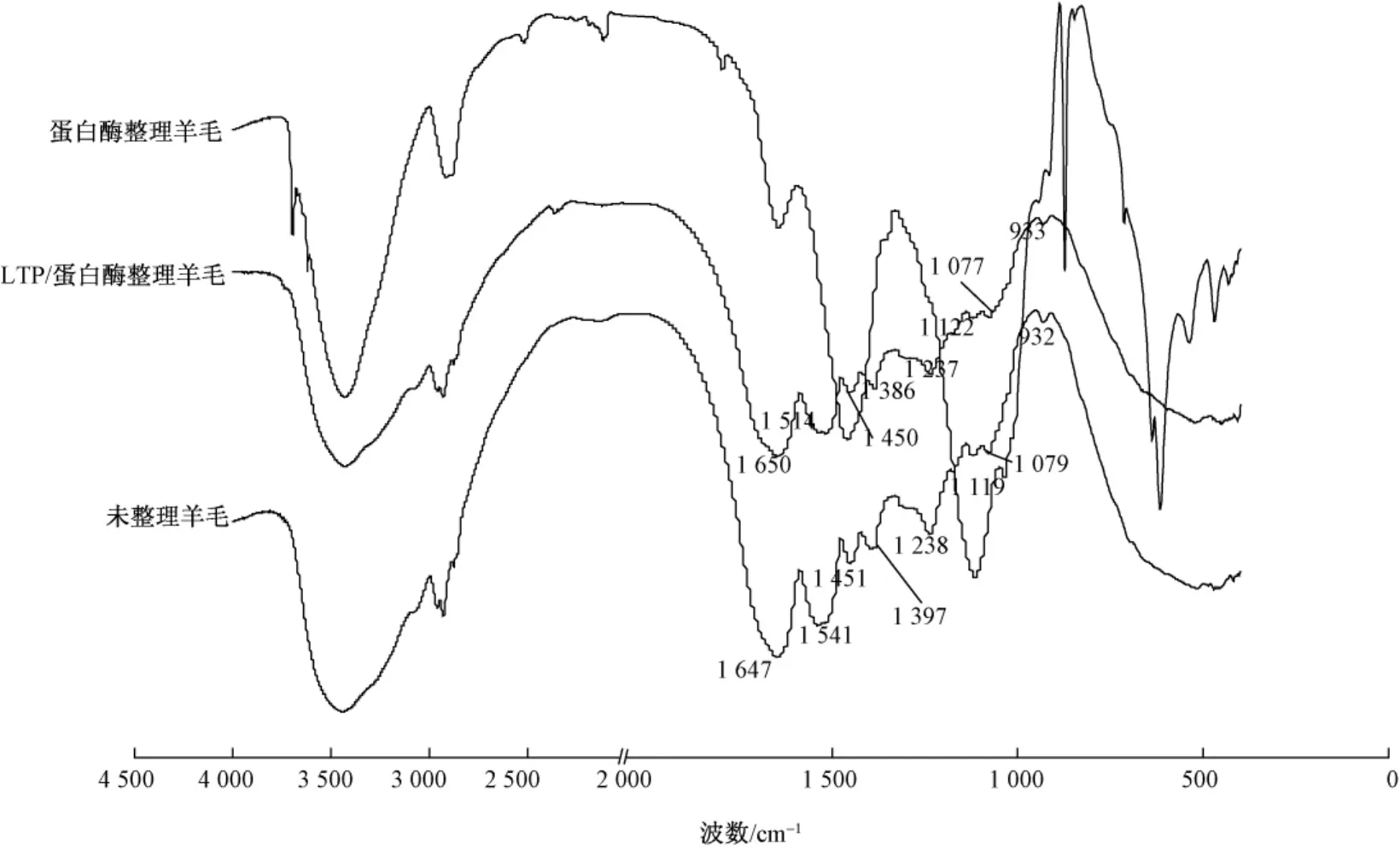
图2 整理前后羊毛的红外光谱图Fig.2 FT-IR spectra of wool before and after treatment
由图2可看出,经过LTP/蛋白酶处理后,羊毛表面鳞片被刻蚀,使蛋白酶能够更有效地作用于羊毛表层的蛋白质,图中酰胺Ⅰ谱带(1700~1600cm-1)和酰胺Ⅱ谱带(1600~1500cm-1)的吸收明显减弱,说明酶对羊毛表层蛋白质具有一定的水解作用。
本文分析了谱带在2930cm-1和2865cm-1处,二硫键对 C—H振动谱带的影响,谱带在1600cm-1和1380cm-1处,羊毛表面类脂物质对—CH3基团C—H变形振动的影响。各特征峰吸光度A及吸光度比值R1(A2865/A2965)和R2(A1600/A1380)变化的情况见表4。
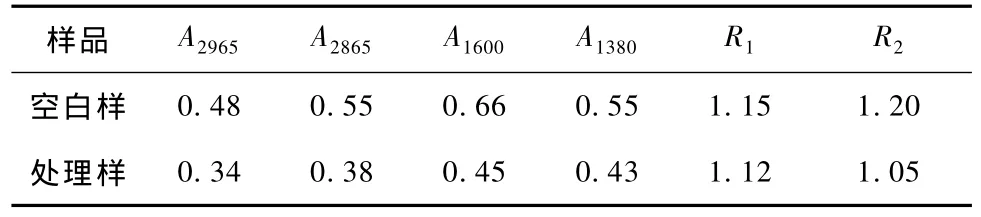
表4 各特征峰吸光度与吸光度比值Tab.4 Absorbance and ratio of absorbance
由表 4可看:R1的变化幅度小于 R2,即2965cm-1谱带处与2865cm-1处谱带变化情况相差不大;R2增加幅度相对较大,即1600cm-1处谱带吸光度相对1380cm-1处有较大的增幅,表明处理前后对二硫键的影响不大。而1380cm-1处属于—CH3基团的C—H变形振动,此处信号明显减弱,说明处理后羊毛表面的类脂物质得到一定程度的改性。
2.5 X射线衍射分析
图3示出羊毛织物处理前后的衍射图。曲线拟合后由电脑程序算出结晶度。
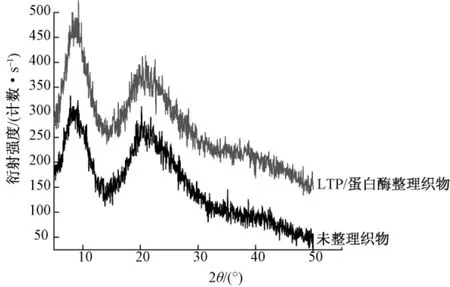
图3 羊毛的X射线衍射图Fig.3 X-ray diffraction patterns of wool
角朊蛋白纤维平行束试样的WAXD图有3个结晶衍射峰[9-10],其中α螺旋结晶的特征衍射峰为2θ在15°~31°之间,β折叠链结晶的特征衍射峰为2θ在16°~31°之间,α 螺旋结晶与 β 折叠链结晶的共同衍射峰为布拉格角2θ为9°[11-12]。
由图3可看出,羊毛织物经LTP/蛋白酶整理处理前后的WAXD曲线均具有2个衍射峰:2θ为9°左右的较强的衍射峰及2θ在15°~31°之间的弥散的衍射峰。二者的曲线走向相同,说明LTP/蛋白酶处理对羊毛纤维的结构无影响,同时可以明显看出经LTP/蛋白酶整理后2θ为9°左右的衍射峰增强,再由表5可知结晶度变大。由表2也可以看出,LTP处理5 min时酶减量率最大,由于蛋白酶主要水解无定形区,即减量越大,无定形区减少得越多,所以结晶度就会越大。
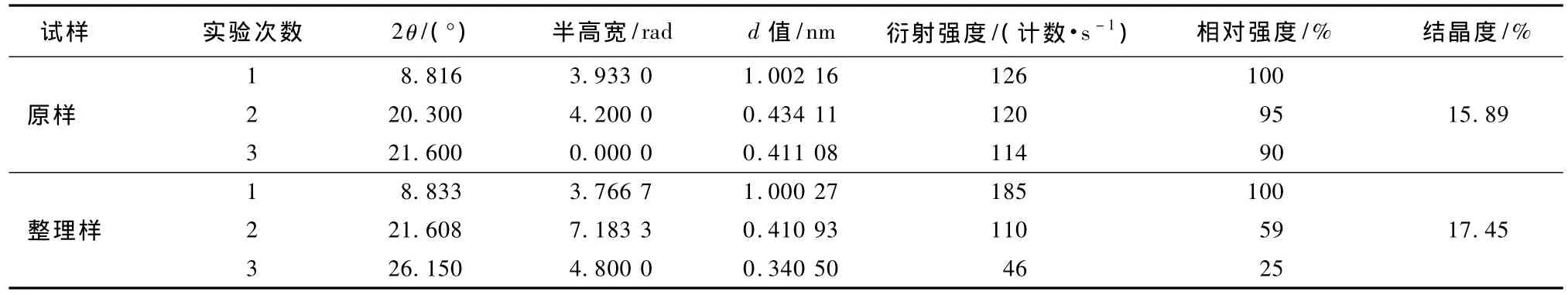
表5 处理前后羊毛织物的X衍射测试结果Tab.5 X-ray diffraction results of wool fabrics
3 结论
1)采用低温等离子体预处理与蛋白酶相结合,低温等离子体以空气为介质,短时间处理,可有效提高羊毛织物的防毡缩性,并能保留羊毛织物固有的强力,强力损失仅为2.48%,毡缩率下降为5.4%,并取得了理想效果。
2)羊毛织物处理前后羊毛表面形态的电镜照片结果表明,经LTP处理后,鳞片表面有明显的凹槽,对边缘的破坏不明显,说明经LTP处理后,可保留较好的强力。
3)红外光谱检测结果证明,经LTP/蛋白酶处理后,酰胺Ⅰ和酰胺Ⅱ谱带吸收明显减弱。这说明酶对羊毛表层蛋白质具有一定的水解作用。
4)X射线衍射结果表明,经LTP/蛋白酶处理后结晶度由15.9%提高到17.5%,衍射峰的强度发生了变化,而位置没有发生变化,说明LTP/蛋白酶处理对羊毛的结构影响不大。
[1]BROOK W R, PHILLIPSH. The application of enzymes to the production of shrinkage-resistant wool and mixture fabric[J].JSDC,1941,57:137-144.
[2]ERRA P,MOLIAN R,JOC IC D,et al.Shrinkage properties of wool treated with low temperature plasma and chitosan biopolymer[J].Textile Res J,1999,69(11):811-815.
[3]钟安华,何瑶.结合等离子体处理的羊毛织物生物防毡缩整理[J].毛纺科技,2005(7):15-17.ZHONG Anhua,HE Yao.Shrinkage properties of wool fabric treated with plasma and biopolymer[J].Wool Textile Journal,2005(7):15-17.
[4]刘今强,邵建中,王光明,等.羊毛表面改性对拒水拒油整理的作用及机理研究[J].高分子学报,2007(1):75-80.LIU Jinqiang,SHAO Jianzhong,WANG Guangming,et al.Effect of wool surface modification on water repellent and oil repellent finishings[J].Acta Polymerica Sinica,2007(1):75-80.
[5]RAKOW AKI W.Plasma treatment of wool today,partⅠ:fiber properties[J].JSDC,1997,113(9):250-254.
[6]TOKINO S,WAKIDA T.Laundering shrinkage of wool fabric treated with low temperature plasma under atmospheric pressure[J].JSDC1993,109(10):334-335.
[7]李影,丁霄霖,李伟.Savinase蛋白酶对羊毛织物的整理[J].毛纺科技,2002(6):31-34.LI Ying,DING Xiaolin,LI Wei.The wool fabric was treated by Savinase protease[J].Wool Textile Journal,2002(6):31-34.
[8]赵书经.纺织材料实验教程[M].北京:中国纺织出版社,1987:356-405.ZHAO Shujing. Experiment Course of Textile Materials[M].Beijing:China Textile& Apparel Press,1987:356-405.
[9]LEWIN M, PEARCE M. Handbook of Fiber Chemistry[M].2nd ed.New York:Marcel Dekker,1998:395.
[10]BENDIT E G.A quantitative X-ray diffraction study of the Alpha-Beta transfoymation in wool keratin[J].Text Res J,1960,30(8):547-553.
[11]CAO Jinan, BILLOWS Craig A. Crystallinity determination of native and stretched wool by X-ray diffraction [J].Polymer International,1999(48):1027-1033.
[12]JAKSIC D.New approach to wool phase structure[C]//The9thInternational Wool Textile Reseach Conference.Biella:[s.n.],1995.
